Abstrak
Toksin polimorfik (PT) adalah protein multidomain yang digunakan untuk persaingan dan patogenesis antarbakteri. Domain N-terminal PT menentukan moda transportasi dan memberi nama famili, sedangkan domain C-terminal variabel membawa aktivitas toksik, yang dapat dinetralisir oleh protein imunitas yang melindungi bakteri penghasil PT. Famili MuF dari toksin polimorfik secara khusus dikaitkan dengan fag beriklim sedang, dan penelitian terbaru kami menunjukkan bahwa domain C-terminal toksin MuF yang dikodekan oleh profag Streptococcus pneumoniae membawa aktivitas adenosin 3′-pirofosfokinase. Jenis toksin ini, yang menggabungkan domain N-terminal MuF dan domain C-terminal adenosine 3′-pyrophosphokinase, disebut Apk2 untuk famili adenosine 3′-pyrophosphokinase 2. Di sini, kami memperluas karakterisasi famili toksin baru ini dengan memberikan informasi tentang dua anggota baru yang dikodekan oleh profag Mannheimia haemolytica dan Pasteurella multocida . Produksi domain adenosine 3′-pyrophosphokinase (Apk2 tox ) pada inang heterolog Escherichia coli menunjukkan tingkat toksisitas yang berbeda, terutama karena stabilitasnya. Pengujian in vitro dengan domain Apk2 tox M. haemolytica yang dimurnikan menunjukkan bahwa, identik dengan S. pneumoniae , ia secara eksklusif menghasilkan (p)ppApp dari ATP. Peran protein imunitas dan pertukaran mereka dalam pengujian perlindungan silang dan interaksi protein-protein diuji. Sementara protein imunitas yang menghidrolisis pppApp menjadi ATP dapat dipertukarkan, protein yang menghambat toksin melalui interaksi protein-protein sebagian besar aktif terhadap mitra intrastrain-nya. Secara keseluruhan, studi ini menyoroti fitur-fitur yang dilestarikan dari domain enzimatik ini, seperti toksisitasnya, aktivitas spesifiknya terhadap ATP, dan imunitas universal dan spesifiknya.
Singkatan
AHTC
anhidrotetrasiklin
Aph1
adenosin 3′-pirofosfohidrolase
Apk2 racun
domain beracun Apk2
Apk(x)
keluarga adenosin 3′-pirofosfokinase (x)
Kualitas tinggi
motif hidrolisis
SayapK
kekebalan adenosin 3′-pirofosfokinase
Bahasa Indonesia: IPTG
isopropil β- d -thiogalactopyranoside
aku suka
Mannheimia hemolytica (penyakit yang disebabkan oleh bakteri Mannheimia hemolytica)
sore hari
Pasteurella multisida
PT
toksin polimorfik
RBS
situs pengikatan ribosom
RSH
Homolog RelA/SpoT
SAH
alarmone hidrolase kecil
Bahasa Indonesia: SAS
sintetase alarmone kecil
SAX-HPLC
pertukaran anion kuat kromatografi cair kinerja tinggi
tidur
Bakteri streptokokus pneumonia
Sinonim
motif sintesis
Terima kasih
sistem sekresi tipe x
Banyak dipelajari pada tahun 1970-an dan kemudian diabaikan, bakteriofag telah menjadi subjek minat baru dalam beberapa dekade terakhir. Dalam konteks fagoterapi, fag litik, yang menginfeksi dan membunuh bakteri, dianggap sebagai alternatif yang mungkin untuk penggunaan antibiotik [ [ 1 ] ]. Sebaliknya, fag beriklim sedang, yang mengintegrasikan materi genetiknya ke dalam kromosom bakteri inang, menawarkan sudut pandang studi untuk memahami evolusi genom [ [ 2 , 3 ] ].
Genom fag biasanya mengkode komponen struktural fag dan protein serta enzim yang menumbangkan fungsi inang [ [ 4 , 5 ] ]. Analisis terbaru lebih lanjut menunjukkan bahwa genom fag dapat mengkode putative toksin. Memang, keluarga toksin polimorfik (PT) yang secara spesifik terkait dengan fag beriklim sedang telah diidentifikasi dan memiliki domain MuF yang terkonservasi pada sisi N-terminal [ [ 6 , 7 ] ]. Toksin polimorfik adalah protein multidomain yang terlibat dalam patogenesis dan kompetisi antarbakteri. Mereka termasuk kolisin dan subfamili efektor sistem sekresi tipe V (T5SS), tipe VI (T6SS) dan tipe VII (T7SS) [ [ 8 ] ]. PT dicirikan oleh domain N-terminal terkonservasi yang terlibat dalam transpor toksin. Setiap domain N-terminal mendefinisikan keluarga PT. Toksin ini juga memiliki domain C-terminal variabel yang membawa aktivitas toksik. Dengan demikian, PT dari famili MuF memiliki domain MuF yang terkonservasi pada terminal-N, dinamai berdasarkan protein GpF dari fag Mu, dan ekstensi terminal-C yang membawa aktivitas toksik yang diprediksi. Gen muf secara sistematis dikaitkan dengan gen yang mengkode kepala fag. Sedikit yang diketahui tentang protein MuF kecuali bahwa mereka diperkirakan hadir dalam 2–3 salinan di kepala virion dan bahwa mereka mengikat DNA virus [ [ 9 , 10 ] ].
Baru-baru ini, kami mengkarakterisasi anggota keluarga MuF PT yang dikodekan oleh profag bakteri Gram-positif Streptococcus pneumoniae . Kami menunjukkan bahwa ekstensi C-terminalnya memiliki aktivitas sintetase (p)ppApp dan memberikan toksisitas ketika diproduksi dalam host heterolog Escherichia coli [ [ 11 ] ]. Keluarga protein yang mengaitkan domain MuF N-terminal dengan domain sintetase (p)ppApp C-terminal dikenal sebagai Apk2 (adenosine 3′-pyrophosphokinase family 2) [ [ 12 ] ]. Keluarga lain, disebut Apk1 (adenosine 3′-pyrophosphokinase family 1), juga ditunjukkan memiliki aktivitas sintetase (p)ppApp, tetapi dikaitkan dengan domain PAAR N-terminal, yang merupakan bagian dari kompleks ujung T6SS [ [ 12 , 13 ] ]. ppApp dan pppApp, yang secara kolektif ditulis (p)ppApp, adalah nukleotida termodifikasi yang dihasilkan dari penambahan gugus pirofosfat dari molekul ATP ke ujung 3′-hidroksil dari molekul ADP dan ATP, masing-masing. Kecuali untuk gugus adenosin sebagai pengganti guanosin, (p)ppApp mirip dengan alarmone (p)ppGpp, yang disintesis selama respons ketat terhadap stres nutrisi, seperti kekurangan asam amino. Akumulasi (p)ppGpp menurunkan jalur sintesis makromolekul dan meningkatkan jalur kontrol stres [ [ 14 , 15 ] ]. Produksi dan degradasi (p)ppGpp diatur oleh tiga jenis enzim: RSH (homolog RelA/SpoT), SAS (small alarmone synthetase), dan SAH (small alarmone hydrolase) [ [ 14 , 15 ] ]. Seperti SpoT, yang terkarakterisasi dengan baik dalam E. coli , RSH memiliki kedua situs katalitik yang terkait dengan sintesis dan hidrolisis (p)ppGpp. Namun, kedua situs tersebut tidak selalu berfungsi: RelA dalam E. coli tidak memiliki aktivitas hidrolase karena substitusi asam amino yang terkonservasi. SAS dan SAH, di sisi lain, mengandung satu domain katalitik, yang masing-masing bertanggung jawab untuk sintesis dan hidrolisis. Domain sintesis mengandung lima motif syn (sintesis) yang terlibat dalam koordinasi kofaktor magnesium, ATP, dan GTP/GDP. Domain hidrolisis mengandung enam motif HD (hidrolisis), yang terlibat dalam koordinasi kofaktor mangan, basa guanin, dan hidrolisis (p)ppGpp [ [ 14 , 16 ] ]. Domain sintetase (p)ppApp dari Apk2 menampilkan motif Syn yang mirip dengan sintetase (p)ppGpp, dengan beberapa variasi sekuens [ [ 11 ] ].
Dalam genom prophage S. pneumoniae , gen apk2 diikuti oleh gen iapK dan aph1 , yang mengkode protein imunitas. Protein IapK (imunitas adenosin 3′-pirofosfokinase) menghambat aktivitas toksin Apk2 dengan menutup situs pengikatan nukleotida akseptor pirofosfat [ [ 11 , 13 , 17 ] ]. Aph1 (adenosin 3′-pirofosfohidrolase) menghidrolisis (p)ppApp dengan cara yang mirip dengan hidrolase (p)ppGpp, yang sebagian meregenerasi kumpulan ATP dan ADP seluler [ [ 11 , 12 ] ]. Di sini, kami memperluas karakterisasi adenosin 3′-pirofosfokinase dengan memberikan informasi tentang dua anggota baru famili Apk2 yang dikodekan oleh profag bakteri Gram-negatif Mannheimia haemolytica dan Pasteurella multocida . Mirip dengan S. pneumoniae , domain toks Apk2 terminal-C mereka memberikan toksisitas ketika diproduksi dalam inang heterolog E. coli . Domain toks Apk2 M. haemolytica selanjutnya ditunjukkan memiliki aktivitas sintetase (p)ppApp secara in vitro . Kami kemudian mencoba mengubah toks Apk2 menjadi sintetase (p)ppGpp melalui substitusi motif Syn, namun tidak berhasil. Akhirnya, pertukaran protein imunitas juga diselidiki melalui uji netralisasi silang dan interaksi protein-protein.
Bahan dan metode
Strain bakteri dan media
Strain Escherichia coli yang digunakan dalam penelitian ini tercantum dalam Tabel S1 . Bakteri ditumbuhkan dalam 2YT, Lysogeny broth (LB) atau agar MacConkey (BD, Sparks, MD, AS), dengan adanya antibiotik untuk mempertahankan plasmid (ampisilin 100 μg·mL −1 , kanamisin 50 μg·mL −1 atau kloramfenikol 50 μg·mL −1 ).
Konstruksi plasmid dan mutagenesis terarah
Plasmid dan primer yang digunakan dalam penelitian ini masing-masing tercantum dalam Tabel S2 dan S3 . Amplifikasi PCR dilakukan dengan Phusion High-Fidelity DNA Polymerase (NEB, Evry, Prancis). Mutagenesis terarah-situs dilakukan pada plasmid dengan mengikuti petunjuk dari kit mutagenesis terarah-situs QuickChange (Stratagene). Templat DNA yang sesuai dengan sebagian wilayah genomik S. pneumoniae SPNA45, M. haemolytica D174, dan P. multocida subsp. multocida HN06 prophage dioptimalkan urutannya untuk E. coli dan disintesis dengan IDT. Semua konstruksi diperiksa dengan sekuensing DNA (Eurofins Genomics, Ebersberg, Jerman). Urutan protein dapat ditemukan di database Ensiklopedia Gen dan Genom Kyoto ( https://www.genome.jp/kegg/ ) menggunakan kode organisme dan tag lokus berikut untuk apk2 , iapK , dan aph1 , masing-masing:
snu, SPNA45_00317, SPNA45_00318, dan SPNA45_00319 untuk S. pneumoniae ;
mhao, J451_00890, J451_00895 dan J451_00900 untuk M. haemolytica ; dan
pmv, PMCN06_2090, PMCN06_2091 dan PMCN06_2092 untuk P. multocida .
Uji toksisitas, kelangsungan hidup, dan netralisasi toksisitas
Pengujian ini dilakukan seperti yang dijelaskan sebelumnya [ [ 11 ] ]. Pengujian toksisitas: Sel E. coli MG1655 ditransformasi dengan plasmid yang memungkinkan produksi domain toksin di bawah kendali promotor P BAD , yang terkunci glukosa dan diinduksi arabinosa. Untuk pengujian toksisitas, pengenceran serial kultur bakteri diteteskan pada pelat agar LB yang mengandung 1% glukosa atau 0,2% arabinosa, dan pelat diinkubasi pada 37 °C selama 18 jam. Pengujian kelangsungan hidup: 0,2% arabinosa ditambahkan ke media kultur saat bakteri berada dalam fase eksponensial. Kemudian, pada titik waktu yang berbeda, alikuot dipanen, dicuci, dan pengenceran serial diteteskan pada pelat agar LB yang mengandung 1% glukosa. Uji netralisasi toksisitas: Sel E. coli MG1655 ditransformasi bersama dengan dua plasmid, satu memungkinkan produksi domain toksin di bawah kendali promotor P BAD dan yang lainnya memungkinkan produksi protein imunitas di bawah kendali promotor P TET yang dapat diinduksi anhidrotetrasiklin (AHTC) . Pengenceran serial kultur bakteri diteteskan pada pelat agar LB yang mengandung 1% glukosa atau 0,2% arabinosa, dan 200 ng·mL −1 AHTC, dan pelat diinkubasi pada suhu 37 °C selama 18 jam.
Imunodeteksi
Sampel protein dianalisis dengan SDS/PAGE standar dan western blot. Imunodeteksi dilakukan menggunakan antibodi tikus anti-FLAG primer (Klon M2; Merck, Darmstadt, Jerman), dan antibodi sekunder anti-tikus yang terkonjugasi alkali fosfatase (Jackson ImmunoResearch, Cambridge, Inggris).
Sintesis in vitro (p)ppApp atau (p)ppGpp yang digabungkan dengan analisis HPLC
Percobaan ini dilakukan seperti yang dijelaskan sebelumnya [ [ 11 , 18 ] ]. Secara singkat, reaksi sintesis pppApp atau pppGpp in vitro dilakukan dalam 10 m m Tris–HCl pH 8, 100 m m NaCl, dan 15 m m MgCl 2 yang mengandung 5 m m substrat nukleotida (ATP saja atau dengan GTP) dan 1 μ m enzim yang dimurnikan, dan hingga 50 μ m untuk enzim yang motif Syn-nya telah dimodifikasi (lihat Ref. [ [ 11 ] ] untuk proses pemurnian enzim). Setelah inkubasi selama 2 jam pada 37 °C, campuran reaksi dilewatkan melalui kolom spin filter dan disuntikkan ke sistem HPLC yang dilengkapi dengan kolom analitis pertukaran anion yang kuat (SAX, Waters Spherisorb). Pemisahan nukleotida dilakukan menggunakan gradien kekuatan ionik dari pelarut A (50 m m KH 2 PO 4 pH 3,4) ke pelarut B (1 m KH 2 PO 4 pH 3,4).
Bakteri hibrida dua
Plasmid yang memungkinkan produksi protein yang menyatu dengan domain T18 atau T25 dari adenilat siklase Bordetella pertussis ditransformasi bersama dalam E. coli BTH101. Bakteri ditumbuhkan semalaman dalam LB yang dilengkapi dengan 0,5 m m IPTG, dan 2 μL diteteskan pada media agar MacConkey yang mengandung 1% maltosa.
Hasil
Domain adenosin 3′-pirofosfokinase yang diprediksi dikodekan oleh profag M. haemolytica dan P. multocida bersifat toksik pada E. coli
Investigasi distribusi sintetase (p)ppApp mengungkapkan keberadaan dua famili. Kedua famili memiliki domain C-terminal dengan aktivitas 3′-adenosin pirofosfokinase tetapi berbeda dalam domain N-terminalnya: PAAR untuk famili Apk1 dan MuF untuk famili Apk2. Delapan puluh sembilan sekuens homolog Apk2 ditemukan dan didistribusikan di beberapa filum bakteri seperti Pseudomonadota, Bacteroidota, Bacillota, dan Actinomycetota [ [ 12 ] ] . Dua penelitian terbaru mengkarakterisasi aktivitas sintetase (p)ppApp dari domain C-terminal Apk2 (Apk2 tox ) yang dikodekan oleh profag dari Bacteroides caccae dan dari S. pneumoniae yang masing-masing termasuk dalam filum Bacteroidota dan Bacillota [ [ 11 , 12 ] ]. Dalam studi ini, kami memperluas karakterisasi ke dua anggota baru yang dikode oleh profag dari M. haemolytica dan P. multocida yang termasuk dalam filum Pseudomonadota. Untuk mengevaluasi dan membandingkan toksisitas domain Apk2 tox , urutan pengkodean yang sesuai dari S. pneumoniae , M. haemolytica , dan P. multocida (selanjutnya disebut sebagai Apk2 tox-snu , Apk2 tox-mhao, dan Apk2 tox-pmv , masing-masing) dikloning ke dalam vektor pBAD33 di bawah kendali promotor P BAD dan situs pengikatan ribosom (RBS) yang dilemahkan (5G). Domain-domain ini kemudian diproduksi secara heterolog dalam E. coli . Pengenceran serial kultur E. coli yang ditransformasi dengan vektor kosong atau dengan konstruksi pBAD33- apk2 tox-snu , pBAD33- apk2 tox-mhao , dan pBAD33- apk2 tox-pmv ditanam pada agar LB yang mengandung glukosa atau arabinosa untuk menekan atau menginduksi promotor P BAD , masing-masing (Gbr. 1A ). Sementara pertumbuhan bakteri yang ditransformasi oleh plasmid yang berbeda sebanding dalam kondisi represi, produksi domain Apk2 tox memberikan penghambatan pertumbuhan. Domain Apk2 tox-mhao menunjukkan aktivitas toksik yang tinggi, mirip dengan domain Apk2 tox-snu , sedangkan domain Apk2 tox-pmv kurang toksik pada E. coli .
 Gbr. 1
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Toksisitas domain toksin Apk2 Streptococcus pneumoniae , Mannheimia haemolytica , dan Pasteurella multocida pada Escherichia coli . (A) Uji toksisitas— E. coli yang ditransformasi dengan vektor pBAD33 yang mengodekan domain C-ter toksik Apk2 dari S. pneumoniae , M. haemolytica , atau P. multocida (masing-masing Apk2 tox-snu , Apk2 tox-mhao, atau Apk2 tox-pmv ) ditumbuhkan hingga fase pertengahan eksponensial, dan pengenceran serial ditotolkan pada media selektif yang menekan atau menginduksi ekspresi toksin apk2 . Data yang ditampilkan mewakili n ≥ 3 percobaan. (B) Uji kelangsungan hidup— E. coli yang ditransformasi dengan vektor pBAD33 yang mengodekan Apk2 tox-snu , Apk2 tox-mhao , atau Apk2 tox-pmv ditumbuhkan hingga fase pertengahan eksponensial. Setelah induksi gen apk2 tox selama 0–90 menit seperti yang ditunjukkan, sampel kultur dipanen, dicuci, diencerkan secara serial, dan ditotolkan ke media selektif yang menekan ekspresi gen ini. Percobaan dilakukan dua kali. (C) Produksi protein—Gen yang mengkode varian katalitik-null berlabel FLAG dari domain Apk2 tox diinduksi dalam E. coli selama 5 jam. Protein dari ekstrak sel yang sesuai dipisahkan dengan SDS/PAGE, dan domain Apk2 tox berlabel FLAG diimunodeteksi. Bentuk panjang penuh dan produk degradasi ditunjukkan dengan kepala panah hitam dan tanda bintang, masing-masing. Penanda berat molekul ditunjukkan di sebelah kiri (dalam kDa). Panel di bagian bawah menunjukkan sepotong membran yang diwarnai dengan merah Ponceau sebagai kontrol untuk pemuatan protein. Data yang ditunjukkan merupakan representasi dari n = 3 percobaan.
Produksi heterologus domain toksin Apk2 S. pneumoniae dan M. haemolytica bersifat bakterisida terhadap E. coli
Bahasa Indonesia : Untuk menguji apakah toksin Apk2 tox memiliki efek bakterisida atau bakteriostatik, uji kelangsungan hidup dilakukan. Untuk ini, sampel kultur E. coli yang memproduksi domain Apk2 tox dipanen pada waktu induksi yang berbeda (0–90 menit) dan ditotolkan pada media padat dalam kondisi represif. Ini memungkinkan kami untuk memperkirakan jumlah sel yang bertahan hidup dari periode induksi. Gambar 1B menunjukkan bahwa aktivitas Apk2 tox-snu dan Apk2 tox-mhao bersifat bakterisida, karena pertumbuhan bakteri yang diamati pada media padat represif berkurang saat waktu induksi untuk produksi domain meningkat. Sebaliknya, Apk2 tox-pmv tidak membunuh E. coli , karena pertumbuhan bakteri sebanding dengan sel E. coli yang mengandung vektor kosong, bahkan setelah induksi hingga 90 menit.
Estimasi tingkat domain toksin Apk2 pada E. coli inang heterolog
Percobaan sebelumnya menunjukkan bahwa produksi sementara toksin Apk2 dari S. pneumoniae atau M. haemolytica dalam E. coli bersifat bakterisida, sedangkan produksi sementara toksin Apk2 dari P. multocida tidak bersifat bakterisida, meskipun pengaturan percobaannya sama: promotor yang sama, RBS yang sama, dan DNA sintetis yang dioptimalkan untuk E. coli . Hasil-hasil ini menggemakan hasil-hasil penelitian lain yang menunjukkan bahwa produksi toksin Apk1 dari Pseudomonas aeruginosa dalam inang heterolog E. coli memiliki efek bakterisida, sedangkan produksi toksin Apk2 dari B. caccae memiliki efek bakteriostatik [ [ 12 ] ]. Secara keseluruhan, hasil-hasil ini menimbulkan pertanyaan apakah domain toksin Apk memiliki aktivitas dengan efisiensi yang berbeda atau apakah masalah produksi/stabilitas terjadi meskipun kondisi produksi identik.
Untuk menjawab pertanyaan ini, jumlah domain Apk2 tox pada E. coli diperiksa dengan western blot. Oleh karena itu, ekstrak protein disiapkan dari strain E. coli yang memproduksi domain Apk2 tox berlabel FLAG (yang menunjukkan toksisitas yang identik dengan versi yang tidak berlabel, Gambar S1 ) selama 5 jam. Untuk menghindari toksisitas selama percobaan, residu aspartat utama dari situs katalitik domain Apk2 tox digantikan oleh glisin. Protein kemudian dipisahkan dengan SDS/PAGE, dan domain Apk2 tox berlabel FLAG diimunodeteksi dengan antibodi anti-FLAG. Domain berlabel Apk2 tox-snu dan Apk2 tox-mhao dideteksi pada ukuran yang diharapkan (~23 kDa) (Gambar 1C ). Menurut replikasi yang berbeda, Apk2 tox-snu dan Apk2 tox-mhao diproduksi dalam jumlah yang sebanding atau sedikit lebih sedikit untuk yang kedua, sebuah pengamatan yang konsisten dengan hasil uji kelangsungan hidup, di mana Apk2 tox-mhao secara reproduktif sedikit kurang beracun daripada Apk2 tox-snu (Gbr. 1B ). Domain yang ditandai Apk2 tox-pmv tidak terdeteksi pada ukuran yang diharapkan, tetapi fragmen degradasi terdeteksi pada ~ 11 kDa, yang menunjukkan bahwa Apk2 tox-pmv terbelah dan menjelaskan toksisitas yang berkurang yang diamati untuk Apk2 tox-pmv dalam E. coli .
Bahasa Indonesia: Untuk mengorelasikan tingkat protein dan toksisitas secara tidak ambigu tanpa bekerja dengan domain yang berbeda, produksi Apk2 tox-snu dan toksisitas dibandingkan dalam host heterolog E. coli menggunakan RBS 5G yang dilemahkan awal atau RBS suboptimal lebih lanjut (4G) (Gbr. 2A ). Imunodeteksi menunjukkan perbedaan yang signifikan dalam produksi Apk2 tox-snu di bawah kendali RBS 4G dibandingkan dengan 5G (Gbr. 2B ). Dalam percobaan western blot kami, kami mengamati bahwa waktu induksi 5 jam untuk menghasilkan Apk2 tox-snu memungkinkan akumulasi domain dengan panjang penuh, sedangkan waktu induksi yang lebih pendek menyebabkan deteksi produk degradasi mayoritas. Kami menyarankan bahwa sistem degradasi harus jenuh untuk mengamati bentuk dengan panjang penuh dan bahwa menggunakan RBS yang lebih rendah (4G) mengurangi produksi, mencegah saturasi sistem degradasi dan membuat bentuk dengan panjang penuh lebih sulit dideteksi dibandingkan dengan produk degradasi. Penurunan ini berkorelasi dengan efek bakterisida yang melemah (Gbr. 2C ), menunjukkan bahwa perbedaan toksisitas dapat dijelaskan oleh perbedaan produksi atau stabilitas heterolog.
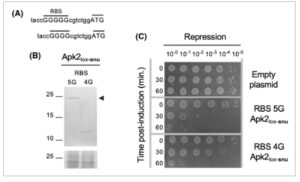 Gambar 2
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Korelasi antara kuantitas Apk2 tox dan toksisitas. (A) Urutan varian situs pengikatan ribosom (RBS) suboptimal Apk2 tox-snu 5G dan 4G. (B) Produksi protein—Varian catalytic-null berlabel FLAG dari Apk2 tox-snu diproduksi dalam Escherichia coli selama 5 jam menggunakan RBS suboptimal 5G atau 4G. Protein dari ekstrak sel yang sesuai dipisahkan dengan SDS/PAGE, dan domain Apk2 tox-snu berlabel FLAG diimunodeteksi. Bentuk panjang penuh ditunjukkan dengan kepala panah hitam (massa yang diharapkan ~ 23 kDa, penanda berat molekul di sebelah kiri). Panel di bagian bawah menunjukkan sepotong membran yang diwarnai dengan merah Ponceau sebagai kontrol untuk pemuatan protein. Data yang ditampilkan merupakan representasi dari n = 3 eksperimen. (C) Uji kelangsungan hidup— E. coli yang ditransformasi dengan vektor pBAD33 yang mengkode gen Apk2 tox-snu yang dikloning di hilir RBS 5G atau 4G yang suboptimal ditumbuhkan hingga fase eksponensial tengah. Setelah induksi domain Apk2 tox-snu selama 0–60 menit seperti yang ditunjukkan, sampel kultur dipanen, dicuci, diencerkan secara serial, dan ditotolkan ke media selektif yang menekan ekspresi apk2 tox-snu . Percobaan dilakukan dua kali.
Sintesis pppApp secara in vitro oleh domain toksin Apk2
Untuk mengonfirmasi aktivitas adenosine 3′-pyrophosphokinase yang diprediksi dari domain Apk2 tox , reaksi sintesis pppApp in vitro dilakukan. Domain Apk2 tox-mhao yang dimurnikan diinkubasi dengan ATP selama 2 jam pada 37 °C, dan produk dianalisis dengan kromatografi cair kinerja tinggi pertukaran anion kuat (SAX-HPLC). Apk2 tox-snu , yang aktivitas adenosine 3′-pyrophosphokinasenya sebelumnya dikarakterisasi [ [ 11 ] ], digunakan sebagai kontrol positif. Ketidakstabilan Apk2 tox-pmv mencegah produksi dan pemurniannya. Kromatogram yang diperoleh setelah analisis SAX-HPLC menunjukkan puncak tunggal yang sesuai dengan substrat ATP dalam reaksi kontrol tanpa enzim, puncak yang menurun dalam reaksi dengan domain Apk2 tox-snu dan Apk2 tox-mhao , yang mencerminkan konsumsi ATP (Gbr. 3 ). Dua puncak tambahan muncul dalam sampel yang sama, yang sesuai dengan AMP dan pppApp, keduanya merupakan produk dari transfer gugus pirofosfat dari satu molekul ATP ke molekul lainnya. Ketika percobaan serupa dilakukan dengan ATP dan GTP sebagai substrat, tidak ada pppGpp yang terdeteksi (Gbr. S2 , panel kiri), yang mengonfirmasi bahwa domain Apk2 tox-mhao , seperti domain Apk2 tox-snu yang dikarakterisasi sebelumnya , secara khusus mensintesis pppApp.
 Gambar 3
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Analisis SAX-HPLC nukleotida setelah reaksi in vitro dengan domain toks Apk2 . Kromatografi cair kinerja tinggi pertukaran anion kuat (SAX-HPLC) dari produk nukleotida reaksi sintesis in vitro , dengan ATP sebagai substrat dan domain toks Apk2 murni yang ditunjukkan . Kromatogram kontrol (panel atas) sesuai dengan reaksi yang tidak mengandung enzim apa pun. Puncak yang sesuai dengan AMP dan ATP ditentukan dengan eksperimen kontrol menggunakan nukleotida komersial. Eksperimen dilakukan dua kali.
Konversi motif syn2-3-4 dari racun Apk2 menjadi motif syn dari guanosin 3′-pirofosfokinase tidak mengubah spesifisitas nukleotida
Berdasarkan penyelarasan sekuens protein jamak yang membandingkan anggota RSH guanosin 3′-pirofosfokinase dengan adenosin 3′-pirofosfokinase yang diprediksi atau terbukti, studi sebelumnya mengidentifikasi tanda-tanda spesifik pada situs syn yang dilestarikan yang berbeda dari satu famili ke famili lainnya [ [ 11 ] ]. Dengan demikian, kami menyelidiki apakah mungkin untuk mengubah sintetase pppApp menjadi sintetase pppGpp dengan memperkenalkan substitusi pada motif syn dari domain Apk2 tox-snu . Motif syn2, syn3, dan syn4 Apk2 tox-snu disubstitusi untuk berkorespondensi dengan sekuens konsensus yang diasosiasikan dengan RSH. Residu GxN diubah menjadi SxH pada situs syn3, yang telah dijelaskan mengenali guanosin di RSH [ [ 16 ] ], sementara residu RYT dan YH dari motif syn2 dan syn4, masing-masing, diubah menjadi AVR dan IR. Varian domain Apk2 tox-snu dimurnikan dan digunakan dalam reaksi sintesis in vitro dengan analisis SAX-HPLC dari produk-produknya. Pengenalan substitusi-substitusi ini menghasilkan inaktivasi progresif aktivitas adenosine 3′-pyrophosphokinase Apk2 tox-snu tetapi tidak menghasilkan produksi pppGpp (Gbr. S2 , panel kanan). Kegagalan untuk mengubah sintetase Apk2 tox-snu (p)ppApp menjadi sintetase (p)ppGpp dengan mensubstitusi asam amino yang terkonservasi dalam motif syn menunjukkan bahwa asam amino tambahan adalah kunci untuk mengendalikan spesifisitas substrat atau reaksi, atau bahwa lingkungan yang disediakan oleh tulang punggung protein tidak cocok untuk menghasilkan enzim fungsional setelah substitusi-substitusi ini.
Pertukaran protein imunitas toksin Apk2
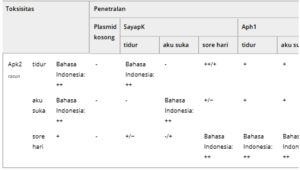
Gen apk2 diikuti oleh dua gen, iapK (imunitas apk) dan aph1 (adenosin 3′-pirofosfohidrolase), yang mengkode protein imunitas. IapK terbukti menetralkan toksin Apk2 dengan menyumbat situs aktif toksin, sedangkan Aph1 membelah gugus pirofosfat pppApp, sehingga meregenerasi kumpulan ATP [ [ 11 , 12 ] ]. Untuk menilai pertukaran protein imunitas yang gennya terkait secara genetik dengan gen muf S. pneumoniae , M. haemolytica , dan P. multocida , kami melakukan uji netralisasi. Untuk ini, sel E. coli dikotransformasi dengan plasmid yang memungkinkan produksi salah satu domain toksin Apk2 (snu, mhao, dan pmv) dan plasmid yang memungkinkan produksi salah satu dari enam protein imunitas. Kultur kotransforman kemudian diencerkan secara serial dan ditotolkan pada agar LB yang dilengkapi dengan l -arabinose dan AHTC untuk menginduksi ekspresi gen toksin dan imunitas yang diklon. Hasilnya menunjukkan bahwa, seperti yang diharapkan, imunitas silang nonspesifik disediakan oleh protein Aph1 yang berbeda, yang menghidrolisis pppApp, produk reaksi yang dikatalisis oleh domain tox Apk2 yang berbeda (Tabel 1 dan Gambar S3 ). Namun, dalam pengaturan eksperimen kami, netralisasi hanya sebagian, kecuali dalam kasus Apk2 tox-pmv , yang toksisitasnya rendah. Sebaliknya, kami mengamati hubungan ortolog untuk protein imunitas IapK: Setiap toksisitas domain tox Apk2 dinetralkan oleh imunitas IapK yang sesuai (Tabel 1 dan Gambar S3 ). Namun, IapK pmv mampu sepenuhnya melindungi sel dari toksisitas Apk2 tox-snu dan kami melihat penurunan gradien fleksibilitas: IapK pmv > IapK snu > IapK mhao .
Tabel 1. Uji netralisasi toksisitas. Evaluasi tingkat toksisitas pada produksi heterolog dalam Escherichia coli diberi peringkat kuat (++) atau sedang (+) (Gbr. 1A ). Profil penyelamatan berdasarkan beberapa percobaan dirangkum dalam tabel ini. Evaluasi netralisasi diberi peringkat total (++), sedang (+, koloni kecil atau terlihat pada pengenceran yang lebih rendah daripada dengan netralisasi total), dan tidak ada netralisasi (−) (Gbr. S3 ).
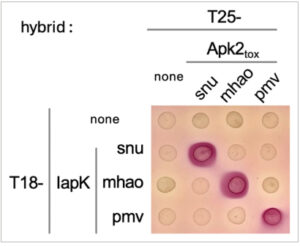
 Bahasa Indonesia: Untuk lebih memahami spesifisitas netralisasi silang antara toksin Apk2 dan imunitas IapK, interaksi protein-protein dinilai dengan hibrida dua bakteri. Gambar 4 menunjukkan bahwa hubungan ortolog yang ketat ada antara pasangan serumpun. Anehnya, sementara uji netralisasi toksisitas menunjukkan bahwa IapK pmv melindungi dari toksisitas Apk2 tox-snu , kedua protein ini tidak berinteraksi dalam uji hibrida dua bakteri. Interpretasi yang mungkin adalah bahwa dalam pengaturan eksperimen netralisasi (yaitu, rasio toksin/imunitas mendukung protein imunitas), protein imunitas dengan afinitas rendah terhadap toksin dapat mengimbanginya dengan tingkat produksinya yang lebih tinggi. Namun, interaksi yang terlalu labil dan/atau dinamis mungkin tidak ditangkap oleh metode hibrida dua bakteri, seperti yang telah kami amati sebelumnya [ [ 19 ] ].
Bahasa Indonesia: Untuk lebih memahami spesifisitas netralisasi silang antara toksin Apk2 dan imunitas IapK, interaksi protein-protein dinilai dengan hibrida dua bakteri. Gambar 4 menunjukkan bahwa hubungan ortolog yang ketat ada antara pasangan serumpun. Anehnya, sementara uji netralisasi toksisitas menunjukkan bahwa IapK pmv melindungi dari toksisitas Apk2 tox-snu , kedua protein ini tidak berinteraksi dalam uji hibrida dua bakteri. Interpretasi yang mungkin adalah bahwa dalam pengaturan eksperimen netralisasi (yaitu, rasio toksin/imunitas mendukung protein imunitas), protein imunitas dengan afinitas rendah terhadap toksin dapat mengimbanginya dengan tingkat produksinya yang lebih tinggi. Namun, interaksi yang terlalu labil dan/atau dinamis mungkin tidak ditangkap oleh metode hibrida dua bakteri, seperti yang telah kami amati sebelumnya [ [ 19 ] ].
 Gambar 4
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Interaksi domain toks Apk2 dan protein imunitas IapK–protein. Analisis dua hibrida bakteri—Tetesan kultur sel reporter Escherichia coli BTH101 yang menghasilkan varian katalitik-null berlabel FLAG dari domain toks Apk2 yang ditunjukkan dan protein imunitas IapK yang menyatu dengan domain T25 dan T18 dari adenilat siklase Bordetella pertussis , masing-masing, dibintiki pada media agar McConkey. Warna merah koloni melaporkan rekonstitusi adenilat siklase karena interaksi antara protein yang diuji. Data yang ditampilkan merupakan representasi dari n = 4 percobaan.
Diskusi
Tiga penelitian sebelumnya mengkarakterisasi toksin polimorfik dengan aktivitas adenosine 3′-pyrophosphokinase (Apk) dari keluarga Apk1, yang terkait dengan domain PAAR dari sistem sekresi Tipe VI (T6SS) [ [ 13 ] ] dan dari keluarga Apk2, yang terkait dengan protein fag MuF [ [ 11 , 12 ] ]. Penelitian ini memperluas karakterisasi keluarga enzim baru ini untuk mencakup dua anggota baru keluarga Apk2 yang dikodekan oleh bakteriofag dari bakteri Gram-negatif M. haemolytica dan P. multocida . Secara keseluruhan, hasil kami pada domain Apk ini menunjukkan bahwa (a) produksi heterologus domain ini dalam E. coli bersifat toksik, (b) kadar protein berkorelasi dengan toksisitas, dengan potensi efek bakterisida, (c) enzim ini mengkatalisis sintesis eksklusif (p)ppApp, (d) substitusi motif syn2, 3, dan 4 yang terpelihara tidak cukup untuk mengubah spesifisitas reaksi terhadap sintesis (p)ppGpp, dan (e) protein imunitas IapK bersifat ortolog terhadap domain toksik Apk2 yang terkait dengan keketatan yang lebih atau kurang menonjol.
Karena ketidakstabilannya, kami tidak dapat menunjukkan aktivitas adenosine 3′-pyrophosphokinase dari domain tox Apk2 dari P. multocida . Namun, aktivitas potensial ini juga didukung oleh fakta bahwa gen aph1 , yang secara genetik terkait dengannya, memiliki tanda-tanda khas hidrolase (p)ppApp dan semua residu situs aktif yang terkonservasi yang menentukan spesifisitas untuk (p)ppApp [ [ 12 ] ].
Protein imunitas Aph1, yang merupakan enzim yang menghidrolisis produk (p)ppApp, memiliki antara 43% dan 57% identitas (Tabel 2 ). Di sisi lain, persentase identitas protein imunitas IapK turun menjadi 35–38% (Tabel 2 ) dan mungkin mencerminkan adaptasi IapK terhadap toksin yang sesuai, mengingat cara kerjanya melalui interaksi protein-protein dan penyumbatan situs aktif. Hasil hibrida dua bakteri kami menyoroti ortogonalitas ini. Namun, pengaturan eksperimental kami dalam uji netralisasi toksisitas mengungkapkan sedikit fleksibilitas dengan IapK pmv , yang memberikan perlindungan terhadap toksin Apk2-snu . Apakah pengamatan ini mencerminkan sejarah evolusi? M. haemolytica dan P. multocida cukup jauh di pohon filogenetik bakteri dari S. pneumoniae , orang dapat berhipotesis bahwa elemen profag berpindah dari satu galur ke galur lain melalui transfer gen horizontal. Walaupun sulit untuk memahami bahwa elemen prophage diperoleh melalui transduksi karena spesifisitas fage terhadap spesies bakteri, strain Streptococcus dan Pasteurella secara alami kompeten dan terkenal karena kapasitasnya untuk memperoleh DNA asing melalui transformasi.
Tabel 2. Persentase identitas antara domain toksin Apk2 dan kekebalan IapK dan Aph1 berdasarkan penyelarasan urutan protein Omega Clustal.
 Patut dicatat bahwa spesies bakteri ini menempati saluran pernapasan atas. Namun, Mannheimia dan Pasteurella berkontribusi terhadap penyakit pernapasan sapi [ [ 20 ] ] sementara S. pneumoniae adalah patogen oportunistik saluran pernapasan atas yang menyebabkan infeksi pada manusia [ [ 21 ] ]. Infeksi pernapasan manusia yang disebabkan oleh Pasteurella relatif jarang, tetapi beberapa kasus dilaporkan pada pasien dengan penyakit paru kronis [ [ 20 ] ] dan bakteri dari genus Streptococcus terdapat dalam mikrobiota bakteri saluran pernapasan sapi [ [ 22 ] ]. Akan menarik untuk menguraikan pertukaran dinamis materi genetik, dan terutama elemen profag, antara strain bakteri di habitat alaminya dan untuk memahami peran fisiologis profag ini dan toksin polimorfik MuF.
Patut dicatat bahwa spesies bakteri ini menempati saluran pernapasan atas. Namun, Mannheimia dan Pasteurella berkontribusi terhadap penyakit pernapasan sapi [ [ 20 ] ] sementara S. pneumoniae adalah patogen oportunistik saluran pernapasan atas yang menyebabkan infeksi pada manusia [ [ 21 ] ]. Infeksi pernapasan manusia yang disebabkan oleh Pasteurella relatif jarang, tetapi beberapa kasus dilaporkan pada pasien dengan penyakit paru kronis [ [ 20 ] ] dan bakteri dari genus Streptococcus terdapat dalam mikrobiota bakteri saluran pernapasan sapi [ [ 22 ] ]. Akan menarik untuk menguraikan pertukaran dinamis materi genetik, dan terutama elemen profag, antara strain bakteri di habitat alaminya dan untuk memahami peran fisiologis profag ini dan toksin polimorfik MuF.
Kesimpulan
Sebagai kesimpulan, penelitian ini memperluas pemahaman kita tentang toksin polimorfik dengan aktivitas adenosine 3′-pyrophosphokinase (Apk) dengan menganalisis dua anggota baru dari keluarga Apk2. Integritas/stabilitas mereka harus diperhitungkan saat membandingkan aktivitas/toksisitas mereka pada host heterolog E. coli . Dua jenis protein imunitas dapat menangkal toksisitas mereka, baik melalui interaksi protein-protein dengan toksin atau dengan menghidrolisis produk dan dengan demikian memulihkan kumpulan ATP. Meskipun sangat mirip dengan protein RSH, konversi aktivitas (p)ppApp sintetase mereka menjadi (p)ppGpp sintetase tidaklah mudah dan, jika memungkinkan, akan memerlukan analisis lebih lanjut. Peran fisiologis dari toksin polimorfik ini masih harus ditetapkan.