Abstrak
Karsinoma sel skuamosa kepala dan leher (HNSCC) merupakan beban kesehatan global yang besar, sering dikaitkan dengan prognosis yang buruk dan pilihan terapi yang terbatas. Long non-coding RNA (lncRNA), sekelompok molekul RNA non-coding yang beragam dengan panjang > 200 nukleotida, telah muncul sebagai pengatur penting dalam patogenesis HNSCC. Tinjauan ini merangkum mekanisme yang digunakan lncRNA tertentu untuk mengatur modifikasi kromatin, penyambungan mRNA, dan interaksi dengan protein pengikat RNA serta berkontribusi pada perkembangan dan progresi HNSCC. Interaksi lncRNA dengan jalur onkogenik utama, seperti PI3K/AKT dan Wnt/β-catenin, menyoroti pentingnya jalur tersebut dalam progresi tumor. Peran lncRNA, seperti ELDR, MALAT1, NEAT1, HOTAIR, dan UCA1, yang mendorong proliferasi sel, metastasis, penghindaran imun, dan resistensi terapi dibahas. Selain itu, beberapa lncRNA sedang dievaluasi dalam uji klinis untuk potensinya sebagai biomarker, yang mencerminkan signifikansi klinisnya. Kami selanjutnya membahas tantangan dan peluang untuk menargetkan lncRNA secara terapeutik, yang menyoroti janji intervensi berbasis lncRNA untuk perawatan kanker yang dipersonalisasi. Memperoleh wawasan tentang fungsi lncRNA dalam HNSCC dapat membuka jalan bagi strategi terapeutik baru untuk berpotensi meningkatkan hasil pasien.
Singkatan
Bahasa Inggris ANLN
protein pengikat aktin anillin
Bahasa Indonesia: ANRIL
antisense non-coding RNA di lokus INK4
ATM-CHK2
ataksia telangiektasia mutasi-checkpoint kinase 2
AURKA
Kinase Aurora A
KURUNGAN
analisis tutup ekspresi gen
bahasa Indonesia: cerna
RNA endogen yang bersaing
Bahasa Indonesia: CSC
sel induk kanker
CTCF
Faktor pengikat CCCCTC
DNMT1
DNA metiltransferase 1
Bahasa Indonesia: EGFR
reseptor faktor pertumbuhan epidermal
EGFR-AS1
reseptor faktor pertumbuhan epidermal antisense RNA 1
ELDR
RNA hilir non-coding panjang EGFR
Petugas medis
transisi epitel ke mesenkim
Bahasa Indonesia: ESCC
karsinoma sel skuamosa esofagus
EZH2
penambah semangat homolog 2
API
elemen RNA pengulangan intergenik fungsional
FOXM1
kotak kepala garpu M1
FZD3
reseptor kelas frizzled 3
GCN5
kontrol umum tidak dapat ditekan 5
HNRNPK
ribonukleoprotein nuklir heterogen K
HNSCC
karsinoma sel skuamosa kepala dan leher
UDARA PANAS
Transkrip HOX antisense RNA intergenik
TIPS PANAS
Transkrip HOXA pada ujung distal
Penyakit HPV
virus papiloma manusia
SMA HSCC
karsinoma sel skuamosa hipofaring
HuR
antigen manusia R
IGF2BP2
protein pengikat mRNA faktor pertumbuhan mirip insulin 2
ILF3
faktor pengikat penguat interleukin 3
JAK/STAT3
Janus kinase/transduser sinyal dan pengaktif jalur transkripsi 3
Bahasa Indonesia: LINGKUNGAN
RNA non-coding intergenik panjang
LINRIS
RNA non-coding intergenik panjang untuk stabilitas IGF2BP2
lncRNA
RNA non-coding panjang
LSCC
karsinoma sel skuamosa laring
LSD1
demetilase spesifik lisin 1
m6a
N6-metiladenosin
MALAT1
transkrip adenokarsinoma paru terkait metastasis 1
MEG3
gen 3 yang diekspresikan secara maternal
MEK/ERK
mitogen-activated protein kinase/jalur kinase yang diatur oleh sinyal ekstraseluler
METTL14
metiltransferase seperti 14
RNA kecil
mikroRNA
Bahasa Indonesia:
RNA pembawa pesan
MTFR1
pengatur pembelahan mitokondria 1
RNA duta
RNA non-coding
RAPIH1
transkrip yang diperkaya nuklir berlimpah 1
rapi2
transkrip yang diperkaya nuklir berlimpah 2
NF-κB
faktor nuklir kappa B
NPC
karsinoma nasofaring
NSCLC
kanker paru non sel kecil
OSCC
karsinoma sel skuamosa rongga mulut
OTSCC
karsinoma sel skuamosa pada lidah dan mulut
PABPN1
protein pengikat poliadenilat 1
PCAT-1
transkrip terkait kanker prostat 1
PD1
protein kematian sel terprogram 1
PI3K/AKT
jalur fosfoinositida 3-kinase/protein kinase B
Bahasa Indonesia: PRC2
kompleks represif polycomb 2
PRMT5
protein arginin metiltransferase 5
PTENP1
fosfatase dan tensin homolog pseudogene 1
PVT1
varian plasmacytoma translokasi 1
RBP
Protein pengikat RNA
RNA-nya
RNA ribosom
SNHG1
gen host RNA nukleolus kecil 1
bahasa Indonesia: snoRNA
RNA nukleolus kecil
RNA pendek
RNA nuklir kecil
Bahasa Indonesia: SOX4
Faktor transkripsi kotak SRY 4
Bahasa Indonesia: SR
kaya serin/arginin
TCGA
Atlas Genom Kanker
TGF-β
transformasi faktor pertumbuhan beta
TINK
diferensiasi terminal yang diinduksi RNA non-coding
TLR5
reseptor tipe tol 5
RNA duta besar
pemindahan RNA
TSCC
karsinoma sel skuamosa lidah
TUG1
taurin meningkatkan gen 1
UCA1
karsinoma urotelial terkait 1
Sayuran dan Buah-buahan
faktor pertumbuhan endotel vaskular
Bahasa Indonesia: XIST
Transkrip spesifik X-tidak aktif
Deskripsi umum lncRNA
Dogma sentral klasik biologi molekuler menyatakan bahwa DNA mengkode RNA, yang mengkode protein. Namun, analisis genomik telah menunjukkan fakta yang mengejutkan: < 5% genom manusia mengkode protein. Sebagian besar genom yang tersisa pernah diberi label sebagai “sampah” tanpa kepentingan fungsional. Namun, penelitian selama beberapa dekade terakhir telah menantang dan membuat gagasan ini ketinggalan zaman [ [ 1 ] ], sehingga merevolusi pemahaman kita tentang dogma sentral biologi molekuler. Sekarang sudah mapan bahwa sebagian besar DNA mengkode RNA non-coding (ncRNA), yang memainkan peran penting dalam berbagai fungsi fisiologis, seperti regulasi gen dan perkembangan penyakit. Baik transfer RNA (tRNA) dan ribosomal RNA (rRNA) adalah pemain penting dalam proses penerjemahan transkrip messenger RNA (mRNA) di dalam ribosom [ [ 2 ] ], sementara small nuclear RNA (snRNA) membantu dalam penyambungan transkrip primer mRNA [ [ 3 ] ], small nucleolar RNA (snoRNA) berkontribusi terhadap pemrosesan rRNA [ [ 4 ] ], dan microRNA (miRNA) bekerja untuk menekan ekspresi gen target [ [ 5 ] ]. Beberapa kelas ncRNA lainnya juga ada dan terus ditemukan. Penelitian tentang ncRNA menjadi semakin berdampak. Faktanya, Hadiah Nobel Kedokteran atau Fisiologi 2024 dianugerahkan untuk penelitian tentang microRNA. Salah satu kelompok ncRNA yang paling beragam adalah lncRNA, yang telah menjadi pusat penelitian dalam beberapa tahun terakhir. lncRNA didefinisikan sebagai transkrip RNA yang tidak diterjemahkan menjadi protein dan terdiri dari setidaknya 200 nukleotida [ [ 6 ] ].
Beberapa laporan telah mengungkapkan bahwa lncRNA adalah komponen utama genom manusia. Hampir 28.000 gen lncRNA manusia diidentifikasi dalam studi tahun 2017 yang menggunakan data analisis ekspresi gen (CAGE) cap FANTOM5 [ [ 7 ] ], sementara sekitar 95.000 gen lncRNA manusia diidentifikasi pada tahun 2021 menggunakan analisis dengan repositori berbeda yang disebut NONCODE [ [ 8 ] ]. Menurut basis data saat ini, ada kurang dari 20.000 gen pengkode protein dalam genom manusia [ [ 9 ] ]. Penemuan lncRNA baru yang berkelanjutan menambah ketidakpastian seputar jumlah pasti gen lncRNA, tetapi jelas bahwa lncRNA sangat umum, memainkan peran fisiologis penting, dan menentang kepercayaan lama bahwa mereka hanyalah produk sampingan dari “kebisingan” transkripsi latar belakang. LncRNA luar biasa karena kehadirannya dalam berbagai spesies dan bentuk kehidupan. Mereka menunjukkan konservasi terbatas di antara spesies-spesies ini, karakteristik unik yang membedakan mereka dari banyak jenis RNA lain yang dikenal karena tingkat konservasinya yang lebih tinggi [ [ 10 ] ]. Banyak lncRNA menunjukkan karakteristik yang mirip dengan mRNA, memiliki beberapa ekson dan tutup 5′ dan ekor poli-A 3′. Namun, lncRNA berbeda dari gen pengkode protein karena sangat spesifik jaringan dan sering diekspresikan pada tingkat rendah, terutama pada jaringan yang rumit [ [ 11 ] ].
Fitur yang paling khas dari lncRNA adalah heterogenitasnya. Mereka memiliki komposisi yang bervariasi dan berkontribusi terhadap beragam proses biologis. Heterogenitas ini telah menyebabkan beberapa upaya berbeda untuk mengkategorikan lncRNA. Ma et al. mengklasifikasikan lncRNA menurut empat karakteristik berbeda: lokasi dan konteks genomik, efek yang diberikan pada urutan DNA, mekanisme fungsi, dan mekanisme penargetan [ [ 12 ] ]. Dalam lokasi dan konteks genomik, lncRNA dapat tergolong dalam kategori intergenik (ditranskripsi dari daerah antara gen) atau intronik (ditranskripsi dari intron gen penyandi protein), dan baik sense atau antisense tergantung pada untai DNA mana lncRNA ditranskripsi. LncRNA dapat dipahami dalam hal efeknya pada urutan DNA sebagai cis-acting atau trans-acting, tergantung pada apakah mereka memengaruhi gen yang terletak di proksimal atau distal, masing-masing. Jenis mekanisme kerja lncRNA meliputi regulasi transkripsi, regulasi pascatranskripsi, replikasi telomer, dan interferensi RNA. Beberapa lncRNA bekerja dengan mengikat dan menghilangkan target protein dari matriks, sedangkan yang lain bekerja dengan mengendalikan lokalisasi kompleks ribonukleoprotein.
Sifat dan peran lncRNA yang sangat beragam ini memberikan penjelasan atas beragamnya hubungannya dengan beberapa penyakit manusia seperti infark miokard [ [ 13 – 15 ] ], penyakit Huntington, Alzheimer, sklerosis lateral amiotrofik, dan penyakit Parkinson [ [ 16 ] ], dan berbagai kanker manusia, seperti payudara, usus besar, otak, paru-paru, hati, kandung kemih, serta kepala dan leher [ [ 17 ] ]. Tinjauan ini akan memberikan peran lncRNA dalam kaitannya dengan kanker kepala dan leher, khususnya potensinya sebagai target terapi dan aplikasi klinisnya.
Kanker kepala dan leher
HNSCC adalah kanker ketujuh yang paling umum di dunia, yang diperkirakan menyebabkan 890.000 kasus baru dan 450.000 kematian per tahun [ [ 18 ] ]. Pada tahun 2030, diperkirakan lebih dari 1 juta kasus HNSCC akan terjadi setiap tahunnya [ [ 19 ] ], yang menunjukkan meningkatnya insiden kanker tersebut. HNSCC mengacu pada sekelompok kanker yang secara biologis serupa yang dimulai di bibir, lidah, rongga mulut (mulut), rongga hidung (di dalam hidung), sinus paranasal, faring, dan laring. Prevalensi HNSCC berbeda berdasarkan wilayah global, dengan kanker amandel dan faring tertinggi di Eropa Barat, kanker laring tertinggi di wilayah Karibia, dan kanker nasofaring sangat mempengaruhi Afrika Utara dan Asia [ [ 18 , 20 ] ]. HNSCC sangat heterogen dan mengandung banyak perubahan genetik yang membuatnya refrakter terhadap obat target tertentu.
Faktor risiko untuk HNSCC sebagian besar diketahui. Penggunaan alkohol dan tembakau sangat terkait dengan kanker ini. Ada bukti bahwa lebih dari 30% kanker faring dan lebih dari 20% kanker laring disebabkan oleh penggunaan alkohol [ [ 21 ] ]. Jumlah alkohol dan jangka waktu minum alkohol berperan dalam menentukan risiko. Mekanisme pasti yang menyebabkan alkohol menyebabkan HNSCC belum sepenuhnya dijelaskan; namun, satu kemungkinan jalan mungkin melalui kerusakan DNA yang disebabkan oleh produk metabolisme alkohol. Bersamaan dengan alkohol, penggunaan tembakau (dihisap atau dikunyah) merupakan faktor pendorong yang signifikan untuk kanker kepala dan leher. Faktanya, peluang mengembangkan HNSCC pada mereka yang merokok 2,13 kali lebih tinggi daripada di antara mereka yang bukan perokok, dan belum terbukti apakah berhenti merokok dapat sepenuhnya menghilangkan peningkatan risiko [ [ 22 ] ]. Meskipun alkohol dan tembakau merupakan faktor risiko yang independen, keduanya memiliki efek yang lebih besar dalam meningkatkan risiko berkembangnya HNSCC ketika digunakan bersamaan, dengan efek yang paling menonjol pada pria dan populasi yang lebih tua [ [ 23 ] ]. Human papillomavirus (HPV) merupakan faktor penyebab signifikan lainnya untuk perkembangan HNSCC. Virus DNA untai ganda ini dapat menginfeksi sel epitel di daerah kepala dan leher, dan bertanggung jawab atas hingga 60% kanker subtipe orofaring, dengan untai HPV16 menjadi agen penyebab yang paling umum [ [ 24 ] ]. Namun, infeksi HPV diperkirakan akan menurun di masa mendatang karena kampanye vaksinasi yang berhasil dan prognosis yang lebih baik [ [ 18 ] ].
Ada berbagai pilihan pengobatan untuk HNSCC, termasuk operasi pengangkatan, terapi radiasi, kemoterapi, terapi target, dan imunoterapi. Salah satu cara paling efektif untuk menghindari kematian akibat kanker ini pada pasien adalah dengan operasi pengangkatan tumor dari lokasi primer lokalnya [ [ 25 ] ]. Terapi radiasi sering digunakan untuk membunuh sel kanker, tetapi ada berbagai efek samping akut dan tertunda yang terkait dengan terapi radiasi HNSCC. Efek samping akut radiasi untuk HNSCC dapat mencakup mukositis, dermatitis, malnutrisi, dehidrasi, mulut kering, dan nyeri saat menelan [ [ 26 ] ]. Efek tertunda dapat mencakup nekrosis radiasi, karies gigi, hipotiroidisme, hiperparatiroidisme, fibrosis, kerusakan mata dan otak, dan kanker sekunder [ [ 27 ] ]. Kemoterapi telah diteliti secara luas terkait dengan kanker kepala dan leher, dengan meta-analisis yang menunjukkan peningkatan kelangsungan hidup dari kemoterapi, dan manfaat yang lebih besar dari kemoradioterapi bersamaan dibandingkan dengan kemoterapi induksi atau adjuvan [ [ 28 ] ]. Terapi yang ditargetkan memiliki efek yang menjanjikan dalam melawan HNSCC, dengan pensinyalan EGFR menjadi target utama untuk kanker ini, dan pensinyalan VEGF dan MEK/ERK berfungsi sebagai target klasik lainnya [ [ 29 ] ]. Penelitian dalam imunoterapi untuk HNSCC juga berkembang pesat dan mengarah pada hasil yang menjanjikan, seperti penggunaan antibodi anti-PD1 (pembrolizumab) yang memiliki harapan baik [ [ 30 ] ].
Mekanisme regulasi patogenesis HNSCC yang dimediasi lncRNA
Regulasi gen dan modifikasi kromatin
Salah satu mekanisme yang paling banyak dipelajari adalah regulasi epigenetik, di mana lncRNA memengaruhi struktur dan fungsi kromatin—kompleks DNA dan protein yang membentuk kromosom. lncRNA dapat memberikan efek fisiologisnya melalui regulasi gen melalui modifikasi kromatin. Kromatin adalah DNA yang telah dipadatkan di dalam nukleus sel, yang disusun dalam model “manik-manik pada seutas tali”. Dalam model ini, protein histon, khususnya delapan di antaranya yang terdiri dari dua salinan masing-masing H2A dan H2B serta H3 dan H4, terikat dan dililit oleh DNA, membentuk nukleosom. DNA dapat tidak dapat diakses untuk transkripsi dalam bentuk heterokromatin yang terkondensasi rapat atau dapat diakses untuk transkripsi dalam bentuk eukromatin yang terkondensasi lebih longgar. lncRNA dapat merekrut kompleks perombakan kromatin ke area genom tertentu, bersaing dengan pengikatan kompleks ini, menghambat ekspresinya, mengubah ubikuitinasinya, atau mengendalikan transkripsi subunit proteinnya [ [ 31 ] ]. Misalnya, lncRNA HOTAIR berinteraksi dengan Polycomb Repressive Complex 2 (PRC2), kompleks pengubah histon yang memangkas metilasi histon H3 pada lisin 27, dan membungkam gen [ [ 32 ] ]. LncRNA RASAL2-AS1 berinteraksi dengan METTL14, metiltransferase yang menambahkan modifikasi m6A (bentuk metilasi RNA) ke mRNA dan memengaruhi stabilitas mRNA dan produksi protein dalam sel HNSCC [ [ 33 ] ]. LncRNA ANRIL telah terbukti memodulasi struktur kromatin melalui interaksinya dengan PRC2, mengatur gen siklus sel dalam berbagai kanker, termasuk HNSCC [ [ 34 ] ]. Fungsi pembungkaman penekan tumor dari lncRNA sering kali melibatkan interaksinya dengan protein pengubah kromatin, yang menyebabkan represi transkripsi. Misalnya, ANRIL membungkam gen penekan tumor utama dalam berbagai kanker, termasuk dalam HNSCC dan meningkatkan pertumbuhan tumor [ [ 35 ] ]. Di sisi lain, lncRNA MX1-215 membentuk kompleks dengan GCN5 dan berfungsi sebagai penekan tumor pada HNSCC, menghambat proliferasi dan metastasis sel. Dalam penelitian terbaru, Song et al. melaporkan peran lncRNA yang terkait dengan super enhancer dalam memprogram ulang lanskap transkripsi HNSCC [ [ 36 ] ]. Peran perancah lncRNA ini memungkinkan mereka untuk memengaruhi represi transkripsi pada HNSCC, berkontribusi pada pembungkaman gen penekan tumor dan peningkatan onkogenesis.
penyambungan mRNA
Fungsi utama lain dari lncRNA adalah keterlibatannya dalam penyambungan mRNA, sebuah proses di mana pre-mRNA dimodifikasi untuk membuang intron dan menggabungkan ekson bersama-sama, menciptakan mRNA matang yang siap untuk diterjemahkan menjadi protein. LncRNA dapat berinteraksi dengan komponen-komponen mesin penyambungan, memengaruhi peristiwa penyambungan alternatif yang dapat menghasilkan isoform protein yang berbeda. Misalnya, MALAT1 berperan dalam regulasi faktor penyambungan seperti protein SR (protein kaya serin/arginin) dan telah terbukti mengubah pola penyambungan berbagai mRNA, sehingga memengaruhi profil ekspresi gen yang mendorong proliferasi dan migrasi sel tumor [ [ 37 ] ]. Peran regulasi ini sangat penting untuk proses seperti transisi epitel-ke-mesenkimal (EMT), di mana penyambungan alternatif dapat mendorong pergeseran dari fenotipe epitel ke keadaan mesenkimal yang lebih invasif, sehingga meningkatkan metastasis. MALAT1 mengatur penyambungan alternatif ANLN, sebuah protein yang terlibat dalam dinamika sitoskeletal, dalam HNSCC. Penyambungan yang berubah berkontribusi pada produksi isoform ANLN yang berbeda, yang memiliki peran berbeda dalam mendorong proliferasi dan invasi tumor pada sel HNSCC [ [ 38 ] ].
Sekuestrasi miRNA
LncRNA juga mengisolasi miRNA dan mencegah miRNA mengikat mRNA targetnya. Proses ini, yang dikenal sebagai jaringan ceRNA (competing endogenous RNA), memungkinkan lncRNA bertindak sebagai spons molekuler [ [ 39 ] ]. Penelitian sebelumnya pada PTENP1, lncRNA yang berasal dari pseudogen, meletakkan dasar untuk memahami bagaimana lncRNA dapat memengaruhi ketersediaan miRNA, sehingga secara tidak langsung mengatur ekspresi onkogen kritis dan penekan tumor [ [ 40 ] ]. Misalnya, LINC00662 di HNSCC telah terbukti menyerap miR-15b-5p, sehingga melindungi mRNA onkogenik dari degradasi yang dimediasi miRNA [ [ 41 ] ]. Dengan mengisolasi miRNA, LINC00662 memastikan ekspresi berkelanjutan dari gen target yang meningkatkan proliferasi dan kelangsungan hidup sel tumor, sehingga memfasilitasi perkembangan kanker. Dengan menstabilkan mRNA, lncRNA NEAT1 berkontribusi pada ekspresi berkelanjutan gen yang mendorong proliferasi sel tumor dan resistensi terhadap apoptosis [ [ 42 ] ]. Dalam HNSCC, lncRNA PVT1 berinteraksi dengan mRNA c-Myc, menstabilkannya dan dengan demikian meningkatkan ekspresi onkogen ini, yang mendorong proliferasi sel dan perkembangan tumor [ [ 43 ] ]. Interaksi ini memungkinkan lncRNA untuk memodulasi jalur pensinyalan yang penting untuk perkembangan dan perkembangan HNSCC, dan penelitian terkini tentang peran regulasi lncRNA dalam berbagai jalur pensinyalan HNSCC akan dibahas di bagian berikut dari tinjauan ini.
Interaksi dengan protein pengikat RNA
LncRNA secara fisik berasosiasi dengan protein pengikat RNA (RBP) untuk menjalankan aktivitas biologisnya. RBP memiliki satu atau lebih domain yang memungkinkannya untuk mengikat dan berinteraksi dengan RNA. Dengan mengikat RBP, lncRNA mampu mengatur modifikasi pascatranslasi protein ini. Ini dapat dilakukan dengan berbagai metode, seperti dengan meningkatkan tingkat ubikuitinasi RBP dan menargetkannya untuk degradasi, dengan melakukan yang sebaliknya dan menurunkan ubikuitinasi RBP, atau dengan menghambat fosforilasi RBP [ [ 44 ] ]. Misalnya, lncRNA Long Intergenic Non-coding RNA for IGF2BP2 Stability (LINRIS) memblokir ubikuitinasi K139 dari Insulin-like Growth Factor 2 mRNA-Binding Protein 2 (IGF2BP2) dan menstabilkan protein IGF2BP2 untuk mengendalikan glikolisis aerobik pada sel kanker kolorektal dan meningkatkan pertumbuhan kanker ini [ [ 45 ] ]. NEAT1 dikaitkan dengan RBP seperti HNRNPK (heterogeneous nuclear ribonucleoprotein K) dalam berbagai kanker termasuk HNSCC dan meningkatkan pertumbuhan tumor [ [ 46 ] ].
Menariknya, ada jalur dua arah di sini: lncRNA tidak hanya mengatur RBP tetapi juga diatur sendiri oleh RBP. Misalnya, RBP Human Antigen R (HuR) dan Polyadenylate-Binding Protein 1 (PABPN1) memengaruhi stabilitas dan ekspresi lncRNA. HuR menggunakan motif pengenalan RNA untuk memblokir sinyal degradasi RNA dan menstabilkan lncRNA seperti NEAT1 dan PABPN1 [ [ 47 ] ]. Sebaliknya, beberapa lncRNA terdegradasi atau diasingkan oleh RBP, yang dapat memengaruhi ketersediaannya untuk menjalankan fungsi pengaturan [ [ 48 ] ]. Selain itu, pengikatan lncRNA dan RBP dapat menyebabkan promosi tumor. LINC00460 berinteraksi dengan PRDX1, memfasilitasi translokasi nuklirnya dan mempromosikan transkripsi gen terkait EMT [ [ 49 ] ]. LncRNA FIRRE berasosiasi dengan HuR dan mempromosikan pertumbuhan hepatosit [ [ 50 ] ]. Secara keseluruhan, disregulasi lncRNA berkontribusi terhadap perilaku agresif kanker termasuk HNSCC, yang dapat menjadikannya target potensial untuk terapi kanker.
Pengaturan transkripsi
Regulasi transkripsi adalah peran umum lain yang dimainkan oleh lncRNA. Ini adalah bidang penelitian yang terus berkembang, dan mekanisme yang digunakan lncRNA untuk mengendalikan transkripsi hanya dipahami sebagian. Regulasi transkripsi oleh lncRNA dapat terjadi dalam cara kerja cis- (pada molekul DNA yang sama) atau trans- (pada molekul DNA yang berbeda). Lebih jauh lagi, beberapa lncRNA telah ditemukan mengandung urutan pengikatan yang komplementer terhadap mRNA dari gen yang jauh, yang mengarah ke regulasi transkripsi in-trans [ [ 51 ] ]. lncSOX4 berkontribusi terhadap perkembangan kanker hati dengan merekrut faktor transkripsi STAT3 ke promotor SOX4 [ [ 52 ] ]. Selain itu, lncRNA dapat secara langsung memengaruhi transkripsi dengan mencegah RNA Polimerase II dari pengikatan ke promotor tertentu [ [ 53 ] ]. Melalui berbagai mekanisme ini, seperti keterlibatan dalam penyambungan mRNA dan bertindak sebagai perancah molekuler, mengatur stabilitas mRNA dan mengisolasi miRNA, lncRNA memainkan peran integral dalam jaringan regulasi gen kompleks yang mendorong proliferasi, kelangsungan hidup, dan invasi HNSCC. Interaksi ini tidak hanya membantu lncRNA mendukung pertumbuhan tumor tetapi juga menjadikannya target terapi potensial untuk mengganggu jalur onkogenik utama. Gambar 1 memberikan gambaran umum tentang mekanisme utama lncRNA dalam HNSCC.
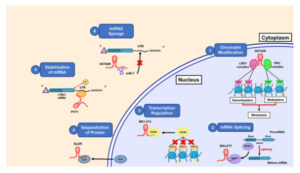 Gbr. 1
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Fungsi molekuler lncRNA dengan contoh. 1–3: fungsi lncRNA dalam nukleus, 4–6: fungsi lncRNA dalam sitoplasma. 1: Modifikasi epigenetik. HOTAIR berinteraksi dengan kompleks PRC atau LSD1 dan menginduksi demetilasi atau metilasi dan mendorong metastasis. 2: penyambungan mRNA: MALAT1 berinteraksi dengan SRSF1 untuk penyambungan mRNA. 3: Regulasi transkripsi: MX1-215 mengikat GCN5 dan memodulasi aktivitas transkripsi. 4: Sekuestrasi protein: ELDR secara fisik berinteraksi dengan protein pengikat RNA ILF3 dan menyekuestrasi ILF3 dalam sitoplasma. 5: Stabilisasi mRNA: PVT1 secara fisik berinteraksi dan menstabilkan mRNA dengan mengikat elemen kaya AU dalam 3′UTR. 6: Bertindak sebagai spons: HOTAIR bertindak sebagai spons miRNA dan berinteraksi dengan miR-7 untuk membentuk kompleks, dengan demikian, miR-7 tidak dapat mengikat 3′ UTR gen targetnya.
Peran fungsional lncRNA dalam perkembangan dan progresi HNSCC
lncRNA memainkan peran penting dalam mengatur berbagai aspek patogenesis HNSCC, termasuk proliferasi sel, kelangsungan hidup, metastasis, resistensi pengobatan, respons imun, dan angiogenesis [ [ 54 – 57 ] ]. Seperti dibahas di atas, lncRNA berinteraksi dengan mRNA untuk mengatur transkripsi, sintesis makromolekul, dan proses imunologi, termasuk pensinyalan sel B dan T dan pensinyalan reseptor TGF-β [ [ 58 , 59 ] ]. Studi awal tahun 2012 mengidentifikasi MALAT1 sebagai pengatur perkembangan siklus sel, yang mendorong pertumbuhan sel HNSCC dengan memfasilitasi transisi antara berbagai tahap siklus sel [ [ 37 ] ]. Di sisi lain, LINC00491 mengatur pertumbuhan melalui interaksinya dengan sumbu miR-508-3p/SATB1, yang memengaruhi ekspresi gen yang mengendalikan proliferasi sel di HNSCC [ [ 60 ] ].
LncRNA juga berkontribusi secara signifikan terhadap metastasis dan invasi. HOTAIR, misalnya, telah dipelajari secara ekstensif atas kemampuannya untuk mempromosikan EMT dengan membungkam gen yang menghambat metastasis, memungkinkan sel kanker terlepas dan menyebar ke bagian tubuh lainnya [ [ 61 ] ]. LncRNA XIST (transkrip spesifik X-inactive) telah terbukti berinteraksi dengan miR-34a, miRNA penekan tumor yang diketahui menargetkan gen yang terlibat dalam EMT [ [ 62 ] ]. Dengan mengikat miR-34a, XIST mencegahnya dari menekan gen target, memungkinkan ekspresi faktor yang mempromosikan EMT dan metastasis. Sebuah studi baru-baru ini pada LINC00662 lebih lanjut membangun pemahaman ini dengan menunjukkan bagaimana lncRNA dapat memodulasi jaringan miRNA, meningkatkan kemampuan migrasi dan invasif sel HNSCC [ [ 41 ] ].
LncRNA juga memodulasi sifat-sifat seperti sel induk kanker (CSC), yang terkait dengan kekambuhan tumor dan resistensi terapi. LncRNA PCAT-1 (Prostate Cancer-Associated Transcript 1) telah terbukti mempertahankan keseluruh sel kanker, membuatnya lebih tangguh terhadap terapi konvensional [ [ 63 ] ]. Studi lain melaporkan peran PCAT6 dengan pensinyalan Notch untuk mempertahankan kapasitas pembaruan diri CSC di HNSCC [ [ 64 ] ]. FOXD2-AS1 terlibat dalam mempertahankan sifat-sifat ini melalui interaksinya dengan STAT3, yang mendorong pembaruan diri dan resistensi terhadap kemoterapi [ [ 65 ] ]. Demikian pula, penekanan lincRNA-p21 mengganggu karakteristik CSC dan meningkatkan sensitivitas terhadap terapi di HNSCC, menjadikannya target terapi yang potensial [ [ 66 ] ]. Peran lain yang muncul dari lncRNA dalam biologi kanker adalah regulasi angiogenesis, proses pembentukan pembuluh darah baru untuk memasok nutrisi ke tumor. MALAT1 telah terlibat dalam mempromosikan angiogenesis melalui peningkatan VEGF, meskipun peran spesifiknya dalam HNSCC memerlukan penelitian yang lebih terarah [ [ 37 ] ]. Kemampuan lncRNA untuk mempengaruhi angiogenesis menunjukkan potensinya sebagai target untuk mengganggu suplai darah ke tumor.
Bukti yang muncul menunjukkan bahwa lncRNA berkontribusi pada jalur pensinyalan yang berbeda pada HNSCC dengan memodulasi jalur PI3K/AKT, JAK/STAT3, TGF-β/Smad, dan Wnt/β-catenin [ [ 67 – 69 ] ]. Jalur PI3K/AKT sangat penting untuk mengatur kelangsungan hidup dan proliferasi sel, dan jalur pensinyalan Wnt/β-catenin adalah pengatur penting pertumbuhan dan proliferasi sel, yang sering terlibat dalam perkembangan kanker. Jalur ini melibatkan stabilisasi dan translokasi nuklir β-catenin, yang kemudian mengaktifkan transkripsi gen responsif Wnt. H19 dikaitkan dengan miRNA untuk regulasi jalur EMT, yang menghasilkan perubahan pertumbuhan sel [ [ 70 ] ]. MALAT1 mempromosikan translokasi nuklir β-catenin, meningkatkan pensinyalan Wnt dan berkontribusi pada agresivitas tumor pada HNSCC [ [ 71 ] ]. MALAT1 juga mempromosikan resistensi terhadap cisplatin pada OSCC dengan mengaktifkan jalur PI3K/AKT/m-TOR [ [ 72 ] ]. lncRNA lainnya, seperti MEG3, UCA1, TUG1, NEF, dan LINC00473, mengatur pensinyalan Wnt/β-catenin, memengaruhi ekspresi β-catenin, proliferasi sel, apoptosis, dan radio-resistensi pada sel HNSCC [ [ 73 – 76 ] ]. Asosiasi m6A/HOXA10-AS/ITGA6 memengaruhi respons stres oksidatif dan mengaktifkan jalur pensinyalan Notch, yang mendorong perkembangan tumor pada LSCC [ [ 77 ] ]. Jalur pensinyalan JAK/STAT3 memainkan peran penting dalam perkembangan kanker, sering diaktifkan pada HNSCC. Jalur STAT3 mengatur EMT dan pembaruan diri CSC, memungkinkan transmisi sinyal dari membran sel ke nukleus. FOXD2-AS1 meningkatkan aktivitas STAT3 dengan bertindak sebagai perancah yang membawa STAT3 dan PRMT5 (protein arginine N-methyltransferase 5) ke dalam jarak dekat, yang mengarah ke peningkatan aktivitas transkripsi STAT3 [ [ 65 ] ]. Interaksi ini mempromosikan sifat-sifat seperti CSC dan berkontribusi pada resistensi kemoterapi di HNSCC. Sebaliknya, lincRNA-p21 berfungsi sebagai penekan tumor dengan menghambat pensinyalan JAK2 / STAT3 [ [ 66 ] ]. Ini secara langsung mengikat STAT3, mencegah aktivasinya, dan menginduksi penangkapan siklus sel G1 dan apoptosis pada sel kanker [ [ 66 , 78 ] ]. STAT3 yang diaktifkan juga dapat berkontribusi pada perubahan epigenetik yang mempromosikan onkogenesis. Misalnya, STAT3 mengikat ke daerah promotor gen HOTAIR, meningkatkan ekspresinya dan dengan demikian mempromosikan pembungkaman gen penekan tumor yang dimediasi EZH2 di HNSCC [ [ 79 ] ].
Jalur TGF-β/Smad memainkan peran kompleks dalam HNSCC. Sementara TGF-β memiliki peran penekan tumor pada tahap awal kanker, ia sering mendorong perkembangan tumor dan EMT pada tahap lanjut HNSCC [ [ 80 ] ]. Pensinyalan TGF-β/Smad yang terkait dengan lncRNA ANRIL atau EPB41L4A-AS2 mengatur pertumbuhan dan migrasi sel dalam HNSCC [ [ 81 , 82 ] ]. LINC01133 berinteraksi dengan pensinyalan TGF-β/Smad dan mendorong ekspresi gen yang mendorong EMT dan metastasis [ [ 83 ] ]. LncRNA UCA1 terbukti mendorong EMT dan metastasis melalui induksi TGF-β melalui pensinyalan JAG1/Notch dalam mekanisme regulasi lncRNA-miRNA-mRNA [ [ 84 ] ]. Temuan ini menyoroti interaksi antara berbagai jalur pensinyalan onkogenik dan lncRNA, yang menunjukkan potensinya sebagai target terapeutik untuk pengobatan kanker.
Beberapa area penelitian lncRNA masih belum dieksplorasi. Misalnya, variabilitas fungsional lncRNA di berbagai subtipe anatomi HNSCC, seperti kanker mulut, laring, dan hipofaring, masih belum jelas. Selain itu, peran lncRNA dalam pemrograman ulang metabolik, yang melibatkan perubahan proses produksi energi sel kanker untuk mendukung pertumbuhannya yang cepat, perlu diselidiki lebih lanjut. Memahami aspek-aspek ini dapat menghasilkan target terapi baru, terutama untuk mengatasi resistensi terhadap pengobatan saat ini. Lebih jauh, diperlukan lebih banyak penelitian untuk mengeksplorasi bagaimana lncRNA yang dibawa dalam eksosom (vesikel kecil yang dilepaskan oleh sel) memfasilitasi komunikasi antara sel HNSCC dan sel lain dalam lingkungan mikro tumor, yang dapat memberikan wawasan tentang metastasis dan mekanisme penghindaran imun.
Sorotan untuk lncRNA yang diteliti dengan baik sebagai onkogen atau gen penekan tumor pada HNSCC
Studi telah mengkarakterisasi profil ekspresi lncRNA dalam jaringan HNSCC, mengungkapkan pola yang berbeda dibandingkan dengan jaringan normal. Sebuah studi mengidentifikasi 488 lncRNA yang diekspresikan secara berbeda dalam HNSCC menggunakan database The Cancer Genome Atlas (TCGA) [ [ 85 ] ]. Untuk lebih mengonfirmasi ekspresi 24 lncRNA yang dipilih, mereka memeriksa tingkat ekspresi dalam jaringan klinis dan menemukan empat biomarker lncRNA signifikan yang diekspresikan secara tinggi dalam jaringan HNSCC (LINC00460, LINC00941, CTC-241F20.4, dan RP11-357H14.17) dengan dua dari lncRNA ini (LINC00460 dan CTC-241F20.4) meningkat pada HNSCC stadium akhir dan status HPV-negatif [ [ 85 ] ]. Prevalensi dan pola ekspresi lncRNA dalam HNSCC memiliki implikasi untuk diagnosis, prognosis, dan terapi. lncRNA yang tidak teregulasi dalam HNSCC menjanjikan sebagai biomarker untuk deteksi dan pemantauan dini, sementara menargetkan RNA non-coding ini dapat memberikan strategi terapi inovatif untuk meningkatkan hasil pengobatan. Dalam tinjauan ini, kami membahas beberapa lncRNA yang telah diteliti dengan baik yang terlibat dalam HNSCC. Tabel 1 mencantumkan peran fungsional dan jalur pensinyalan lncRNA tertentu dalam HNSCC.
Tabel 1. Daftar lncRNA dalam promosi dan supresi HNSCC.
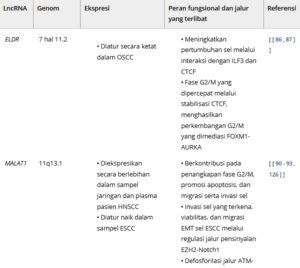
ELDR
EGFR long non-coding downstream RNA (ELDR) adalah lncRNA manusia yang relatif baru dan berdekatan dengan gen EGFR pada kromosom 7 pada untai yang berlawanan. Gen ELDR murine memiliki homolog manusia yang terdapat pada kromosom 11, dan fungsinya belum ditentukan. Kami telah menunjukkan bahwa ELDR adalah onkogen untuk kanker mulut dan berinteraksi dengan ILF3 dan CTCF untuk meningkatkan pertumbuhan sel [ [ 86 ] ]. Sebuah studi berikutnya menunjukkan bahwa ELDR eksogen meningkatkan proliferasi pada keratinosit mulut normal dengan mempercepat fase G 2 /M dari perkembangan siklus sel melalui stabilisasi CTCF, menghasilkan perkembangan G 2 /M yang dimediasi FOXM1-AURKA [ [ 87 ] ]. Dalam aspek terapeutik, pemberian ELDR intratumor secara signifikan mengecilkan pertumbuhan tumor pada model xenograft yang berasal dari pasien [ [ 86 , 88 ] ]. Namun, efek terapeutik ELDR harus dievaluasi dalam model praklinis yang berbeda dengan adanya sistem imun yang utuh.
MALAT1
Metastasis-associated lung adenocarcinoma transcript 1 (MALAT1) (kromosom 11q13.1) adalah lncRNA terkenal yang pertama kali ditemukan pada lini sel kanker paru non-sel kecil (NSCLC) tahap awal dan sampel pasien [ [ 89 ] ]. MALAT1 diekspresikan secara berlebihan pada lini sel dan jaringan HNSCC dibandingkan dengan sampel non-tumor yang berdekatan [ [ 90 – 92 ] ]. Knockdown MALAT1 menyebabkan agregasi sel pada fase G 2 /M, yang menyebabkan peningkatan apoptosis, penghambatan migrasi dan invasi sel, dan pengurangan pembentukan koloni. Ekspresi berlebihan MALAT1 menyebabkan defosforilasi jalur ATM-CHK2, jalur penting yang terlibat dalam respons kerusakan DNA dan penangkapan G 2 /M, sehingga meningkatkan pertumbuhan ESCC [ [ 93 ] ]. MALAT1 bertindak sebagai ceRNA untuk spons miRNA, seperti miR-101-3p, miR-217, miR-30a, dan miR-125b di HNSCC [ [ 54 , 92 , 94 ] ]. Pengobatan bersama MALAT1 dengan cisplatin dan radiasi meningkatkan kemanjuran terapi dalam model praklinis HNSCC [ [ 91 ] ].
RAPIH1
Nuclear-enriched plenty transcript 1 (NEAT1) ada di kromosom 11q13.1. Peran arsitektur NEAT1 dalam pembentukan paraspeckle—badan nuklir dinamis dengan banyak peran dalam ekspresi gen—telah diteliti dengan baik [ [ 95 ] ]. Penelitian terkini telah mengamati dua isoform NEAT1, isoform yang lebih pendek NEAT1_1 (3,7 kb pada manusia) dan isoform yang lebih panjang NEAT1_2 (22,7 kb pada manusia) [ [ 96 ] ], yang masing-masing menampilkan peran berbeda dalam mengatur berbagai fenotipe pada sel kanker [ [ 97 , 98 ] ]. Sementara NEAT1_2 dapat berfungsi dalam pembentukan dan perakitan paraspeckle, NEAT1_1 ditemukan memiliki fungsi yang tidak bergantung pada paraspeckle [ [ 96 ] ]. Meskipun kontribusi spesifik isoform masih belum diketahui, mempelajari keduanya dapat efektif dalam menentukan peran NEAT1 sebagai promotor tumor atau penekan tumor pada kanker. Mengenai penelitian pada HNSCC, NEAT1 diekspresikan secara berlebihan pada LSCC [ [ 99 – 101 ] ], OSCC [ [ 102 ] ] dan karsinoma sel skuamosa sinonasal [ [ 103 ] ] jika dibandingkan dengan jaringan non-kanker yang berdekatan. Pada sel LSCC, knockdown NEAT1 mencegah proliferasi dan invasi sel sambil menginduksi penangkapan siklus sel pada fase G1 dan mendorong apoptosis [ [ 99 ] ]. Dalam model xenograft, knockdown NEAT1 mengurangi pertumbuhan tumor dan menginduksi apoptosis sel kanker. NEAT1 juga dapat terlibat dalam aktivasi jalur pensinyalan Wnt dengan bertindak sebagai ceRNA untuk mengikat miR-411-3p dan dengan demikian mendorong ekspresi FZD3 [ [ 101 ] ].
UDARA PANAS
Homeobox (HOX) Transcript Antisense Intergenic RNA (HOTAIR) (kromosom 12q13.13) diekspresikan secara tinggi pada jaringan kanker dan berperan dalam perkembangan tumor, invasi, dan metastasis [ [ 104 ] ]. Ekspresi HOTAIR juga tinggi pada HNSCC [ [ 104 – 107 ] ]. Secara mekanistis, HOTAIR mengatur transkripsi dengan mengikat kompleks modifikasi histon, PRC2 dan Lysine-Specific Demethylase 1 (LSD1), ke lokus HOXD pada kromosom 2, yang kemudian mengubah keadaan kromatin dengan menggabungkan metilasi histon H3K27 dan demetilasi H3K4, dan ini menyebabkan metastasis. Dalam OSCC, pembungkaman HOTAIR menyebabkan penurunan pengikatan EZH2 dan H3K27me3 dengan promotor E-kadherin, yang menunjukkan bahwa HOTAIR dapat menekan ekspresi E-kadherin dengan merekrut EZH2 dan, dengan demikian, menghambat proliferasi dan invasi sel kanker [ [ 104 ] ]. Studi lain menemukan bahwa knockdown HOTAIR oleh shRNA dalam lini sel HNSCC menghambat proliferasi sel dan menyebabkan penangkapan siklus sel dan apoptosis [ [ 105 ] ]. Kemungkinan lingkaran regulasi feed-forward antara HuR dan HOTAIR mendukung teori bahwa aktivitas HuR ditekan oleh miR-7, dan HOTAIR meringankan hal ini dengan bertindak sebagai spons untuk miR-7 di HNSCC [ [ 105 ] ]. Sebuah studi baru-baru ini mengenai LSCC mengamati peran potensial HOTAIR dalam mengaktifkan jalur PI3K/p-AKT/AKT untuk induksi polarisasi makrofag menjadi fenotipe M2 [ [ 106 ] ]. Studi-studi ini telah menyoroti potensi HOTAIR sebagai biomarker untuk HNSCC.
TIPS PANAS
Transkrip HOXA di ujung distal (HOTTIP) (kromosom 7p15.2) terletak di ujung 5′ dari gugus homeobox A (HOXA) dan mengatur aktivasi sejumlah gen HOXA 5′ [ [ 108 ] ]. HOTTIP terlibat dalam banyak proses seluler, seperti pertumbuhan sel, invasi, migrasi, dan apoptosis. Laporan terbaru menunjukkan bahwa HOTTIP meningkat dalam spesimen HNSCC [ [ 108 , 109 ] ]. HOTTIP adalah molekul kunci dalam eksosom yang berasal dari makrofag M1 dan aktivasi jalur pensinyalan TLR5/NF-κB melalui persaingan spons miR-19a-3p dan miR-19b-3p [ [ 110 ] ]. Dalam penelitian lain pada sel karsinoma nasofaring (NPC), HOXA13 mengalami penurunan regulasi akibat penekanan HOTTIP, dan hal ini kemudian menyebabkan penekanan proliferasi sel, invasi, dan metastasis, serta menginduksi apoptosis [ [ 108 ] ]. Dengan demikian, pemeriksaan peran HOTTIP sebagai target terapi potensial dapat menjadi penting dalam evaluasi klinis kanker.
UCA1
Karsinoma urotelial terkait 1 (UCA1) (kromosom 19p13.12) pertama kali ditemukan pada tahun 2006 pada kanker kandung kemih manusia [ [ 111 ] ]. UCA1 juga terlibat dalam tumorigenesis dan metastasis karsinoma nasofaring [ [ 81 ] ]. Lebih lanjut, dibandingkan dengan jaringan non-tumor yang berdekatan, sampel tumor pasien dengan LSCC [ [ 112 ] ], OSCC [ [ 102 ] ], ESCC [ [ 113 ] ], dan karsinoma sel skuamosa hipofaring [ [ 114 ] ] menunjukkan ekspresi UCA1 yang lebih tinggi. Beberapa penelitian melaporkan bahwa peran UCA1 pada tumor ganas lainnya dan khususnya fungsinya dalam neoplasma, apoptosis, resistensi obat anti-kanker, metabolisme, dan crosstalk dengan miRNA [ [ 81 , 115 , 116 ] ]. Ekspresi berlebihan UCA1 berkontribusi pada aktivasi jalur pensinyalan Wnt/β-catenin dengan menghambat aktivator negatif jalur pensinyalan ini sambil meningkatkan ekspresi β-catenin [ [ 112 ] ]. Dalam studi lain, Wu et al . menganalisis peran potensial UCA1 dalam jalur PI3K/AKT melalui pengikatan miR-134 dan OSCC cancer stem cell-derived small extracellular vesicle (CSC-derived sEV) yang menyebabkan peningkatan polarisasi M2 makrofag [ [ 117 ] ].
PCAT-1
Transkrip terkait kanker prostat 1 (PCAT-1) terletak pada kromosom 8q24.21, sekitar 725 kb hulu dari onkogen Myc, dan wilayah tersebut sering diperkuat dalam HNSCC. Faktanya, ekspresi berlebihan PCAT-1 dalam sampel pasien HNSCC dibandingkan dengan jaringan non-tumor yang berdekatan juga dicatat [ [ 118 ] ]. c-Myc dan AKT1 berkorelasi positif dengan ekspresi PCAT-1 dalam HNSCC. Kami menunjukkan bahwa penipisan PCAT-1 menghambat pertumbuhan sel HNSCC, ekspresi c-Myc dan AKT1, dan menginduksi apoptosis [ [ 118 ] ]. Penghambatan PCAT-1 yang ditargetkan mengurangi pertumbuhan tumor dalam model praklinis.
Implikasi klinis dan arah masa depan
Ekspresi abnormal lncRNA terkait erat dengan beberapa fungsi patofisiologis yang merangsang tumorigenesis. Akibatnya, lncRNA sangat menjanjikan untuk aplikasi terapeutik pada kanker termasuk HNSCC. Penghambatan atau pemulihan lncRNA yang ditargetkan dapat mengubah jaringan regulasi sel kanker dengan cara yang bergantung pada konteks. LncRNA dapat secara bersamaan mengatur beberapa target, yang dapat bermanfaat atau menantang karena mekanisme umpan balik yang rumit. Oleh karena itu, memahami mekanisme dan fungsi lncRNA secara terperinci dalam HNSCC sangatlah penting, terutama dalam mengidentifikasinya sebagai target terapeutik.
Seperti dibahas di atas, deregulasi lncRNA, seperti ELDR, HOTAIR, LEMD1-AS1, dan MALAT1, telah dikaitkan dengan timbulnya dan perkembangan HNSCC [ [ 86 , 119 ] ]. Misalnya, ELDR diekspresikan secara tinggi dalam sampel pasien OSCC dan dalam lini sel [ [ 86 ] ], dan ekspresi ektopik ELDR dalam keratinosit oral normal meningkatkan pertumbuhan sel [ [ 87 ] ]. MALAT1 meningkat regulasinya dalam OSCC dan berkorelasi dengan diferensiasi dan stadium klinis [ [ 120 ] ]. HOTAIR diekspresikan secara tinggi dalam OSCC dan tingkat ekspresinya berkorelasi dengan stadium metastasis kelenjar getah bening tumor, derajat histologis, dan metastasis kelenjar getah bening regional [ [ 121 ] ]. LncRNA LEMD1-AS1 meningkat dalam OSCC [ [ 122 ] ]. Sejauh ini, ada 35 uji klinis yang menggunakan lncRNA, dan lima di antaranya dengan HNSCC. Uji klinis yang relevan telah dirangkum dalam Tabel 2 dan dapat diakses di situs web berikut: https://clinicaltrials.gov/ .
Tabel 2. Daftar lncRNA dalam uji klinis HNSCC.
 Berdasarkan basis data uji klinis yang tersedia, lima uji klinis pada lncRNA sebagai biomarker potensial pada HNSCC telah dipelajari. Sebuah uji klinis menganalisis tingkat ekspresi HOTAIR dan tingkat ekspresi midkine, faktor pertumbuhan pengikat heparin yang terkait dengan perkembangan stadium tumor, dalam biopsi cair pasien dan individu sehat untuk menentukan potensi HOTAIR dan midkine sebagai biomarker pada kanker tiroid (NCT03469544). Uji klinis lain yang telah selesai di bidang ini mempelajari penggunaan lncRNA saliva LINC00657 dan miRNA-106a sebagai biomarker diagnostik pada OSCC dan kondisi inflamasi kronis liken planus oral (NCT05821179). Studi ini merekrut 36 subjek dan membaginya menjadi tiga kelompok yang sama: mereka yang menderita OSCC, mereka yang menderita liken planus oral, dan mereka yang tidak menderita salah satu kondisi tersebut. LINC00657 memiliki ekspresi yang lebih tinggi secara signifikan secara statistik pada kelompok OSCC dibandingkan dengan dua kelompok lainnya, dan LINC00657 memiliki akurasi diagnostik yang lebih tinggi daripada miRNA-106a [ [ 123 ] ]. Sebuah studi observasional pada MALAT1 sebagai biomarker saliva potensial pada OSCC melalui interaksi miRNA-124 telah selesai (NCT05708209). Studi ini merekrut 40 subjek, dengan setengah dari kelompok tersebut terdiri dari pasien dengan OSCC dan setengah lainnya terdiri dari subjek yang sehat. Studi ini menemukan peningkatan yang signifikan secara statistik dalam ekspresi lncRNA MALAT1 pada pasien OSCC dibandingkan dengan kontrol. Lebih jauh, hasil menunjukkan peningkatan yang signifikan secara statistik dalam ekspresi MALAT1 pada pasien dengan kanker metastasis dengan keterlibatan kelenjar getah bening dibandingkan dengan kanker non-metastasis [ [ 124 ] ]. Uji klinis lain sedang berlangsung, mengamati kemanjuran obat oral, Dacomitinib, untuk pasien dengan tumor padat lanjut yang dipicu oleh Reseptor Faktor Pertumbuhan Epidermal (EGFR) dengan ekspresi EGFR-AS1 yang rendah (NCT04946968). Uji klinis ini saat ini berada pada Fase II dengan 104 peserta yang terdaftar.
Berdasarkan basis data uji klinis yang tersedia, lima uji klinis pada lncRNA sebagai biomarker potensial pada HNSCC telah dipelajari. Sebuah uji klinis menganalisis tingkat ekspresi HOTAIR dan tingkat ekspresi midkine, faktor pertumbuhan pengikat heparin yang terkait dengan perkembangan stadium tumor, dalam biopsi cair pasien dan individu sehat untuk menentukan potensi HOTAIR dan midkine sebagai biomarker pada kanker tiroid (NCT03469544). Uji klinis lain yang telah selesai di bidang ini mempelajari penggunaan lncRNA saliva LINC00657 dan miRNA-106a sebagai biomarker diagnostik pada OSCC dan kondisi inflamasi kronis liken planus oral (NCT05821179). Studi ini merekrut 36 subjek dan membaginya menjadi tiga kelompok yang sama: mereka yang menderita OSCC, mereka yang menderita liken planus oral, dan mereka yang tidak menderita salah satu kondisi tersebut. LINC00657 memiliki ekspresi yang lebih tinggi secara signifikan secara statistik pada kelompok OSCC dibandingkan dengan dua kelompok lainnya, dan LINC00657 memiliki akurasi diagnostik yang lebih tinggi daripada miRNA-106a [ [ 123 ] ]. Sebuah studi observasional pada MALAT1 sebagai biomarker saliva potensial pada OSCC melalui interaksi miRNA-124 telah selesai (NCT05708209). Studi ini merekrut 40 subjek, dengan setengah dari kelompok tersebut terdiri dari pasien dengan OSCC dan setengah lainnya terdiri dari subjek yang sehat. Studi ini menemukan peningkatan yang signifikan secara statistik dalam ekspresi lncRNA MALAT1 pada pasien OSCC dibandingkan dengan kontrol. Lebih jauh, hasil menunjukkan peningkatan yang signifikan secara statistik dalam ekspresi MALAT1 pada pasien dengan kanker metastasis dengan keterlibatan kelenjar getah bening dibandingkan dengan kanker non-metastasis [ [ 124 ] ]. Uji klinis lain sedang berlangsung, mengamati kemanjuran obat oral, Dacomitinib, untuk pasien dengan tumor padat lanjut yang dipicu oleh Reseptor Faktor Pertumbuhan Epidermal (EGFR) dengan ekspresi EGFR-AS1 yang rendah (NCT04946968). Uji klinis ini saat ini berada pada Fase II dengan 104 peserta yang terdaftar.
Sebuah studi tambahan mengevaluasi lncRNA DQ786243 sebagai biomarker potensial dan efeknya pada miRNA-146a (NCT05730855). Tingkat ekspresi DQ786243 dan miRNA-146a diamati dalam air liur dari tiga kelompok yang berbeda: pasien yang menderita liken planus oral, pasien yang menderita leukoplakia, dan individu sehat yang tidak menderita lesi mukosa oral apa pun. Hasil studi ini belum dipublikasikan, tetapi menilai DQ786243 sebagai biomarker potensial dapat berguna dalam mendiagnosis lesi ganas oral. Secara keseluruhan, uji klinis ini menyoroti dampak lncRNA yang semakin berkembang dan menjanjikan dalam perawatan pasien dengan HNSCC, yaitu dalam diagnosis dan prognosis kondisi tersebut. Meskipun diagnosis karsinoma sel skuamosa kepala dan leher tidak sulit dilakukan, memiliki tanda tangan lncRNA dapat berguna sebagai biomarker prognostik. Ini juga dapat membantu sebagai biomarker prediktif di area tempat HNSCC sangat prevalen. Oleh karena itu, mungkin masuk akal untuk mengidentifikasi sekelompok lncRNA sebagai biomarker prediktif dan/atau prognostik untuk HNSCC.
Mengidentifikasi lncRNA sebagai biomarker potensial untuk HNSCC akan bermanfaat; namun, menargetkan lncRNA menghadapi beberapa tantangan. Dalam model praklinis, pengiriman lncRNA intratumor menunjukkan hasil yang menjanjikan, tetapi aplikasi klinis yang menargetkan lncRNA terhalang oleh pengiriman, stabilitas, dan spesifisitas. Mempertahankan stabilitas lncRNA in vivo sulit dilakukan, dan saat ini, dalam pengaturan klinis, tidak ada sistem pengiriman lncRNA yang efektif dalam sel tumor. Selain itu, masalah mengenai spesifisitas lncRNA mencakup efek on- dan off-target yang tidak diinginkan di mana intervensi terapeutik yang ditujukan pada lncRNA tertentu secara tidak sengaja memengaruhi jalur atau proses seluler lainnya, dan ini menyebabkan efek samping atau komplikasi yang tidak diinginkan [ [ 125 ] ]. Karena tantangan ini, investigasi diperlukan dalam teknologi kimia, dengan fokus pada peningkatan stabilitas lncRNA in vivo , dan nanoteknologi, yang menjawab kebutuhan untuk menemukan kendaraan pengiriman yang efisien untuk lncRNA in vivo atau pengiriman yang ditargetkan dengan vektor berbasis virus. Hal penting lainnya yang perlu disebutkan adalah inkonsistensi hasil antara penelitian. Hasil yang direproduksi sangat penting, dan hasil yang bervariasi ini mungkin dipertanyakan karena kurangnya konsensus. Oleh karena itu, ada kebutuhan untuk mengatasi variabilitas ini dan mengatasi tantangan terapi tertarget yang menggunakan lncRNA untuk meningkatkan kemanjurannya dalam pengaturan klinis.
Kesimpulannya, lncRNA merupakan target yang menjanjikan untuk terapi kanker dan memiliki potensi besar untuk berfungsi sebagai biomarker untuk prediksi dan prognosis kanker, yang akan mengarahkan pengambilan keputusan secara klinis. Penelitian lncRNA merupakan bidang yang sedang berkembang dengan harapan besar untuk pengobatan kanker, terutama untuk menargetkan gen yang ‘tidak dapat diobati’. Investigasi lebih lanjut memang diperlukan untuk mengatasi dan menangani tantangan ini serta menerapkannya dalam aplikasi klinis. Oleh karena itu, pemahaman yang lebih baik tentang regulasi lncRNA akan menjadi batu loncatan untuk modalitas terapi masa depan untuk HNSCC.
