Abstrak
Inhibitor titik pemeriksaan imun penting untuk pengobatan di semua jenis tumor tetapi tidak efektif secara universal dalam mengendalikan penyakit. Pemahaman awal tentang respons tumor, atau ketiadaan respons, dapat menginformasikan keputusan pengobatan. Studi ini mengevaluasi perubahan dalam DNA tumor yang bersirkulasi (ctDNA) dan beban mutasi tumor darah (bTMB) untuk asosiasi dengan respons terhadap blokade ligan 1 kematian sel terprogram 1 (PD-L1). Kami mengurutkan DNA bebas sel yang dikumpulkan pada awal terapi, pada pengobatan, dan pada akhir terapi untuk 153 pasien yang diobati dengan atezolizumab sebagai bagian dari studi MyPathway pan-tumor (NCT02091141). Fraksi tumor ctDNA (TF) dan bTMB dinilai untuk korelasi dengan kelangsungan hidup bebas progresi (PFS) dan kelangsungan hidup keseluruhan (OS). Kami menemukan bahwa respons molekuler (MR, ≥50% penurunan TF pada siklus 3 hari 1) dikaitkan dengan perbaikan PFS (9,7 vs 1,5 bulan dari C3D1; HR = 0,27) dan OS (21,1 vs 14,3 bulan dari C3D1; HR = 0,44). Temuan ini konsisten ketika dibatasi pada pasien dengan penyakit stabil (SD; PFS HR = 0,55; OS HR = 0,39). bTMB berkorelasi dengan TMB berbasis jaringan (tTMB) ketika TF tinggi (≥1%), tetapi tidak dengan OS dalam kohort ini. Secara total, 61% sampel dasar memiliki varian hematopoiesis klonal (CH) yang diprediksi. Tidak terlihat korelasi antara frekuensi alel varian maksimum (maxVAF) dari CH yang diprediksi dan TF. Singkatnya, MR dikaitkan dengan hasil untuk pasien yang diobati dengan atezolizumab dan dapat membuat strata pada pasien dengan SD. Meskipun CH umum terjadi, maxVAF untuk varian CH tidak dikaitkan dengan ctDNA TF. Kuantifikasi ctDNA memungkinkan pemantauan respons terapi dan penting untuk interpretasi bTMB sebagai proksi untuk tTMB.
Singkatan
bTMB
beban mutasi tumor darah
Bahasa Indonesia: C1D1
bersepeda satu hari satu
Bahasa Indonesia: C3D1
siklus tiga hari pertama
cBOR
konfirmasi respons keseluruhan terbaik
CCC
koefisien korelasi konkordansi
DNA-Cf
DNA bebas sel
Bahasa Inggris
hematopoiesis klonal
Bahasa Inggris
tanggapan lengkap
CRC
karsinoma kolorektal
DNA-nya
DNA tumor yang beredar
CANGKIR
kanker primer yang tidak diketahui
DCR
tingkat pengendalian penyakit
Waktu Akhir
akhir pengobatan
F1LCDx
FoundationOneLiquid CDx
SDM
Rasio bahaya
AKU CI
penghambat titik pemeriksaan kekebalan
Posyandu
imunohistokimia
IQR
rentang interkuartil
VAF maks
frekuensi alel varian maksimum
TN
respon molekuler
MSI
ketidakstabilan mikrosatelit
MSI-H
ketidakstabilan mikrosatelit tinggi
mut/Mb
mutasi per megabase
NSCLC
kanker paru non sel kecil
ORR
tingkat respons keseluruhan
Sistem Operasi
kelangsungan hidup secara keseluruhan
PD
penyakit progresif
PD-L1
ligan kematian terprogram 1
PFS
kelangsungan hidup bebas perkembangan
hubungan masyarakat
tanggapan parsial
DAFTAR ULANG
Kriteria Evaluasi Respon pada Tumor Padat
SD
penyakit stabil
SLD
jumlah lesi target diameter terpanjang
TF
fraksi tumor
TMB
beban mutasi tumor jaringan
Bahasa Inggris
prediksi asal varian
1 Pendahuluan
Terapi penghambat titik pemeriksaan imun (ICI) telah menjadi perkembangan yang sangat penting dalam pengobatan kanker pada tumor padat, tetapi responsnya tidak universal [ [ 1 , 2 ] ]. Penilaian respons yang cepat dan andal dapat membantu pengambilan keputusan di antara berbagai macam terapi, kombinasi, dosis, dan rejimen yang tersedia untuk berbagai jenis tumor. Identifikasi biomarker prediktif seperti ekspresi ligan 1 kematian terprogram (PD-L1), ketidakstabilan mikrosatelit (MSI), dan beban mutasi tumor (TMB) membantu memandu penggunaan ICI, tetapi masih diperlukan penyempurnaan lebih lanjut terhadap strategi pengobatan sebelum dan selama pengobatan [ [ 3 – 5 ] ].
Circulating tumor DNA (ctDNA) bersifat prognostik pada pasien dengan tumor padat dan telah muncul sebagai alat yang ampuh untuk menilai respons terhadap terapi [ [ 6 – 11 ] ]. Pada pasien yang diobati dengan ICI, pemantauan ctDNA dapat memberikan nilai tambah pada interpretasi pencitraan radiografi, yang mungkin membingungkan karena pseudo-progresi atau tidak meyakinkan [ [ 12 , 13 ] ]. Selain itu, jaringan tidak selalu tersedia untuk menilai biomarker yang memprediksi respons ICI. Studi telah menunjukkan bahwa beban mutasi tumor darah (bTMB) yang ditemukan dalam ctDNA dasar berkorelasi dengan TMB yang dinilai dari biopsi jaringan (tTMB), yang menunjukkan bahwa bTMB dapat berfungsi sebagai pengganti ketika jaringan tidak tersedia untuk penilaian TMB [ [ 14 , 15 ] ]. Uji coba B-FIRST dan analisis retrospektif dari uji coba OAK dan POPLAR menunjukkan manfaat bagi pasien kanker paru non-sel kecil yang diobati dengan atezolizumab yang bTMB dasarnya meningkat [ [ 16 , 17 ] ]. Namun, deteksi bTMB bergantung pada sampel yang mengandung fraksi tumor (TF) ctDNA yang cukup [ [ 15 ] ]. Interaksi antara nilai prediktif bTMB vs ctDNA TF sebagai faktor prognostik dan indikator sensitivitas belum dijelaskan secara memadai dalam konteks pengobatan ICI.
MyPathway, sebuah studi keranjang fase IIa berlabel terbuka, non-acak, multisenter, mengevaluasi beberapa terapi target pada pasien dengan tumor padat lanjut dengan perubahan yang berpotensi dapat ditindaklanjuti [ [ 18 ] ]. Dalam satu kelompok, atezolizumab dinilai pada pasien dengan tumor padat tanpa persetujuan FDA untuk pengobatan dengan obat studi. Perbaikan signifikan dalam PFS dan OS terlihat pada mereka dengan tTMB ≥16 mutasi per megabase (mut/Mb) dibandingkan dengan mereka dengan tTMB ≥10 mut/Mb tetapi <16 mut/Mb [ [ 19 ] ]. Di sini kami melaporkan analisis retrospektif sampel plasma yang dikumpulkan dari pasien yang diobati dengan atezolizumab sebagai bagian dari uji coba MyPathway. Kami menyelidiki dinamika ctDNA dan bTMB sebagai penanda respons dalam kelompok pan-tumor serta hubungan antara kedua biomarker berbasis darah ini. 2 Bahan dan Metode 2.1 Desain penelitian dan pemilihan pasien Desain uji coba MyPathway (NCT02091141) telah dijelaskan sebelumnya [ [ 19 ] ]. Secara singkat, orang dewasa yang tumornya memiliki tTMB ≥10 mut/Mb sebagaimana ditentukan secara lokal oleh uji tersertifikasi CLIA apa pun diberikan atezolizumab 1200 mg intravena setiap 3 minggu hingga perkembangan penyakit atau toksisitas yang tidak dapat diterima. Ukuran dan respons tumor dinilai oleh peneliti per Kriteria Evaluasi Respons pada Tumor Padat (RECIST) versi 1.1 pada awal dan setiap dua siklus pengobatan (setiap 6 minggu) selama 24 minggu pertama, dan kemudian setiap empat siklus pengobatan (setiap 12 minggu) setelahnya. Pengujian IHC PD-L1 dilakukan menggunakan kit pharmDx klon 22C3 dan dilaporkan sebagai skor proporsi tumor (TPS). Pasien yang tidak dilaporkan di sini tidak memiliki hasil uji PD-L1 lokal dan tidak ada jaringan atau jaringan yang tidak mencukupi untuk pengujian sentral. Beban tumor diukur menggunakan jumlah diameter terpanjang lesi (target) (SLD). Pasien dirawat antara Juli 2017 dan Mei 2023. Plasma dikumpulkan pada awal siklus perawatan 1 dan 3 dan pada perkembangan atau akhir perawatan (EOT). Untuk meminimalkan bias, pengukuran ctDNA dilakukan dengan mengabaikan data klinis ( misalnya , jenis kelamin dan usia). MyPathway dilaksanakan sesuai dengan pedoman International Conference on Harmonization for Good Clinical Practice dan Deklarasi Helsinki. Protokol dan studi disetujui oleh dewan peninjau institusional/komite etik di setiap pusat uji klinis. Semua pasien memberikan persetujuan tertulis untuk berpartisipasi dalam studi. 2.2 Pengurutan dan analisis DNA bebas sel Sampel dianalisis menggunakan FoundationOne® Monitor, uji pemantauan ctDNA agnostik jaringan menggunakan hibrid capture next generation sequencing, memanfaatkan platform uji yang sama seperti FoundationOne®Liquid CDx (F1LCDx), dengan metode yang dijelaskan sebelumnya [ [ 20 ] ]. Kedalaman sekuensing median pembacaan non-redundan untuk semua sampel biopsi cair yang dianalisis adalah 2056X (IQR: 1712-2288X). Uji mendeteksi dan mengukur fraksi ctDNA dari total cell-free DNA (cfDNA) yang ada dalam sampel biopsi cair sebagai ctDNA TF, dihitung seperti yang dijelaskan sebelumnya [ [ 21 , 22 ] ]. Singkatnya, ctDNA TF dalam sampel diukur dengan mengintegrasikan beberapa sinyal berbeda, termasuk aneuploidi, keberadaan varian pendek, dan metrik fragmen cfDNA dari sampel. Informasi fragmen digunakan untuk membatasi kontribusi hematopoiesis klonal (CH) terhadap estimasi berbasis aneuploidi dan untuk membantu mengidentifikasi varian pendek tumor-somatik. TF ctDNA terendah yang terdeteksi dan diukur dalam penelitian ini adalah 0,2%. Perubahan TF ctDNA tidak diukur ketika TF ctDNA terdeteksi di bawah 2% pada C1D1 dan C3D1. Beban mutasi tumor darah (bTMB) dihitung dari hasil F1LCDx dasar dengan menghitung jumlah varian nukleotida tunggal yang terdeteksi pada frekuensi alel ≥0,5%, setelah penghapusan peristiwa pendorong onkogenik yang diketahui dan mungkin serta polimorfisme nukleotida tunggal germline, dan dibagi dengan ukuran wilayah pengkodean umpan (0,79 Mb) [ [ 16 ] ]. 2.3 Pengurutan dan analisis jaringan Sampel jaringan diurutkan sebagaimana tersedia pada FoundationOne® CDx hingga kedalaman sekuensing median 871X (IQR: 805-969X) [ [ 23 ] ]. TMB dari spesimen jaringan berpasangan (tTMB) dihitung menggunakan FoundationOne® CDx sebagaimana dijelaskan sebelumnya [ [ 24 ] ]. Semua analisis sampel jaringan dan darah dilakukan secara independen, dan bTMB dan tTMB dibandingkan untuk pasangan sampel darah dan jaringan dari pasien yang sama. 2.4 Prediksi asal varian Kami memanfaatkan model pembelajaran mesin prediksi asal varian (VOP) yang, untuk semua varian pendek (substitusi, penyisipan kecil, dan penghapusan) yang terdeteksi dalam uji F1LCDx, menghasilkan probabilitas 3 arah untuk apakah varian tersebut berasal sebagai: (1) germline, (2) CH, atau (3) tumor somatik. Model ini dilatih menggunakan kumpulan hasil F1LCDx 1977 yang dihasilkan dari plasma yang DNA buffy coat-nya yang cocok juga diurutkan hingga kedalaman yang sama. Model ini menggunakan berbagai fitur, termasuk fragmentomik (ukuran dan posisi genomik fragmen cfDNA yang mendukung setiap varian pendek) dan fitur terkait frekuensi alel varian dalam konteks ekspektasi somatik/germline yang diberikan model nomor salinan untuk sampel, tetapi tidak termasuk demografi pasien apa pun, yang digabungkan dan digunakan untuk melatih model klasifikasi pembelajaran mesin. 2.5 Analisis Statistik Respon tumor dinilai menurut pedoman RECIST 1.1 [ [ 25 ] ]. Tingkat respons keseluruhan (ORR) didefinisikan sebagai proporsi pasien dengan respons keseluruhan terbaik berupa respons lengkap atau parsial; tingkat pengendalian penyakit (DCR) didefinisikan sama tetapi mencakup pasien dengan respons keseluruhan terbaik berupa penyakit stabil. Perbandingan ORR dan DCR dilakukan menggunakan uji Chi-square. Perbedaan dalam kelangsungan hidup bebas progresi (PFS) dan kelangsungan hidup keseluruhan (OS) dinilai dengan uji log-rank dan rasio bahaya (HR) dari model bahaya proporsional Cox, dan nilai median diestimasi dengan analisis Kaplan–Meier. Berdasarkan penelitian sebelumnya yang dilakukan oleh Friends of Cancer Research, yang mengidentifikasi 50% sebagai batas optimal untuk membedakan respons dari non-respons pada pasien dengan kanker paru non-sel kecil (NSCLC) yang diobati dengan inhibitor titik pemeriksaan imun, batas pra-spesifikasi sebesar 50% digunakan untuk menentukan respons molekuler untuk semua analisis primer [ [ 26 ] ]. Karena penelitian tersebut terbatas pada NSCLC dan ini adalah kohort pan-tumor, batas pengurangan 90% dan pengurangan 100% (pembersihan lengkap) dinilai dalam analisis eksploratori. Pengurangan 100% selaras dengan beberapa penelitian sebelumnya, sementara 90% dipilih untuk memilih pasien dengan pengurangan ctDNA yang signifikan sementara kurang ketat dibandingkan dengan pengurangan 100% [ [ 27 , 28 ] ]. Untuk analisis apa pun yang memanfaatkan pengukuran ctDNA dari titik waktu C3D1, analisis PFS dan OS ditandai dari C3D1, dan pasien dengan perkembangan/kematian sebelum tanggal penanda dikecualikan. Korelasi antara ctDNA TF dan SLD oleh RECIST 1.1, serta ctDNA TF dan maxVAF dari varian somatik dan CH yang diprediksi, dinilai dengan koefisien korelasi Pearson ( R ) dan korelasi antara bTMB dan tTMB dinilai dengan koefisien korelasi konkordansi Lin (CCC). Statistik, komputasi, dan plot dilakukan menggunakan paket R 4.2.1 (Posit, RRID:SCR_001905) ggplot2 (RRID:SCR_014601), survminer (RRID:SCR_021094), survival (RRID:SCR_021137), epiR (RRID:SCR_021673),[ dan rapiverse (RRID:SCR_019186). 3 Hasil 3.1 Karakteristik kelompok studi Secara total, 153 pasien yang memiliki hasil profil ctDNA yang berhasil di awal dimasukkan dalam penelitian ini (Gbr. 1A ). Kanker kolorektal (CRC, 22%) dan kanker payudara (22%) adalah jenis tumor yang paling umum dan dianalisis secara terpisah, sementara semua jenis tumor lainnya dikategorikan sebagai gastrointestinal/hepatobilier (18%), ginekologi (14%), prostat (5%), atau lainnya (19%) (Gbr. 1B ). Seperti yang diharapkan, karakteristik klinis dan genomik bervariasi di antara jenis tumor. Secara keseluruhan, kohort ini diperkaya untuk tumor tTMB tinggi, konsisten dengan kriteria kelayakan uji coba, dengan prostat dan jenis tumor lainnya memiliki median tTMB yang jauh lebih tinggi daripada penyakit lain (Tabel S1 ). Selain itu, kadar ctDNA pada C1D1 bervariasi menurut penyakitnya, dengan ginekologi dan prostat keduanya memiliki kadar rata-rata ctDNA TF >10% (masing-masing 15,0% dan 18,0%; Gambar S1A ). Perubahan genomik yang berasal dari tumor yang diprediksi terdeteksi dalam biopsi cair pada C1D1 berbeda di antara berbagai jenis tumor dan konsisten dengan penelitian sebelumnya (Gambar S1B ).
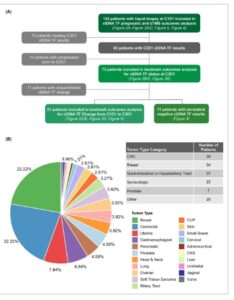
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
Kelompok Studi: Pasien yang diobati dalam kelompok atezolizumab dari uji coba MyPathway basket (NCT02091141) memenuhi syarat untuk diikutsertakan dalam studi ini. (A) 153 pasien dengan profil genomik ctDNA pada C1D1 diikutsertakan dalam analisis hasil ctDNA TF dan bTMB pra-perawatan. Pasien yang tidak memiliki hasil ctDNA pada C3D1 atau yang mengalami perkembangan sebelum C3D1 dikeluarkan dari analisis hasil menggunakan kadar ctDNA selama perawatan; 22 pasien tambahan dikeluarkan dari analisis hasil yang difokuskan pada perubahan ctDNA karena kadar perubahan yang tidak dapat diukur (11 dengan ctDNA TF yang terdeteksi pada kedua titik waktu dengan estimasi <2% dan 11 pasien dengan ctDNA yang tidak terdeteksi pada kedua titik waktu). (B) MyPathway mendaftarkan pasien dengan sekumpulan tumor padat yang heterogen. Untuk subanalisis, pasien dikelompokkan menjadi 5 kelompok jenis tumor primer dengan semua pasien lainnya diklasifikasikan sebagai “lainnya”. ctDNA, DNA tumor yang bersirkulasi; TF, fraksi tumor; bTMB, beban mutasi tumor darah; C1D1, siklus 1 hari 1; C3D1, siklus 3 hari 1; CRC, kanker kolorektal; CUP, kanker primer tidak diketahui; CNS, sistem saraf pusat.
3.2 Fraksi tumor ctDNA dan hasil pasien
Sejalan dengan penelitian sebelumnya, ctDNA TF pada C1D1 sangat prognostik. Pasien dengan ctDNA TF rendah (<1%; n = 39) memiliki OS yang lebih lama sejak awal pengobatan (median 23,3 bulan) dibandingkan dengan mereka yang memiliki ctDNA TF tinggi (≥1%; 11,8 bulan; HR 0,57 [0,35–0,93]; Gambar 2A ). Tidak ada perbedaan dalam ORR yang dikonfirmasi yang diamati (<1%: 18% vs 1%: 17%) yang menegaskan ctDNA TF awal sebagai penanda prognostik (Tabel S2 ).
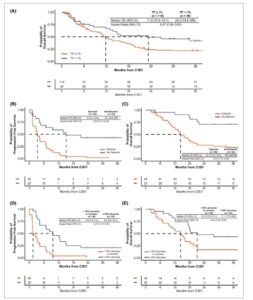
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Korelasi antara hasil dan deteksi serta penurunan ctDNA. (A) ctDNA TF rendah (<1%) pada awal pengobatan dikaitkan dengan median OS yang lebih panjang. Tidak adanya deteksi ctDNA pada C3D1, terlepas dari kadar ctDNA awal, dikaitkan dengan (B) PFS dan (C) OS yang memanjang dari C3D1. Mirip dengan deteksi ctDNA, MR pada C3D1 (didefinisikan sebagai penurunan ≥50% dari C1D1) dikaitkan dengan (D) PFS dan (E) OS yang memanjang dari C3D1. ctDNA, DNA tumor yang bersirkulasi; TF, fraksi tumor; C1D1, siklus 1 hari 1; C3D1, siklus 3 hari 1; PFS, kelangsungan hidup bebas progresi; OS, kelangsungan hidup keseluruhan; CI, interval kepercayaan; NR, tidak tercapai.
Selanjutnya kami menilai hubungan antara deteksi ctDNA selama pengobatan dan hasil pasien terlepas dari kadar ctDNA yang terdeteksi di awal. Tujuh puluh pasien yang tidak memiliki hasil ctDNA pada C3D1 dikeluarkan dan 10 tambahan dikeluarkan yang memiliki perkembangan yang terdokumentasi sebelum C3D1 (Gbr. 1A ). Dari mereka yang tidak memiliki hasil ctDNA, 48/70 telah menghentikan pengobatan sebelum C3D1 karena perkembangan atau kematian, sementara 14/70 lainnya tidak lagi menerima pengobatan (Tabel S3 ). Pada pasien dengan perkembangan sebelum C3D1, ctDNA terdeteksi pada 97% (28/29) pasien dengan biopsi cair akhir pengobatan yang tersedia. Bahasa Indonesia: Untuk 73 pasien yang memenuhi syarat yang sampel C3D1-nya tersedia, mereka dengan ctDNA yang tidak terdeteksi pada C3D1 memiliki PFS yang memanjang (15,1 vs 3,4 bulan dari C3D1; HR 0,25 [0,13–0,49]; Gambar 2B ) dan OS (median tidak tercapai vs 14,3 bulan dari C3D1; HR: 0,23 [0,10–0,55]; Gambar 2C ). Untuk mengonfirmasi bahwa temuan ini tidak didorong oleh pasien dengan ctDNA TF <1% pada C1D1, dan oleh karena itu prognosis yang lebih baik, kami melakukan analisis pada subkelompok pasien dengan ctDNA TF ≥1% pada C1D1 ( n = 48); baik PFS median (15,1 vs 3,3 bulan dari C3D1; HR 0,24 [0,10–0,59]; Gambar S2A ) dan OS median (21,1 vs 15,4 bulan dari C3D1; HR 0,40 [0,14–1,14]; Gambar S2B ) secara signifikan lebih lama pada pasien yang ctDNA-nya tidak terdeteksi pada C3D1. Tidak seperti ctDNA TF pada C1D1, deteksi ctDNA TF pada C3D1 dikaitkan dengan ORR yang lebih tinggi (52% vs 20%; Tabel S4 ); namun, DCR yang tinggi masih terlihat pada pasien dengan ctDNA yang terdeteksi pada pengobatan (80%), kemungkinan karena pengecualian pasien yang mengalami perkembangan sebelum C3D1 dari analisis ini.
Berikutnya, kami mengelompokkan pasien berdasarkan respons molekuler (MR), yang didefinisikan sebagai penurunan ≥50% dalam ctDNA dari C1D1 ke C3D1. Pada pasien dengan perkembangan sebelum C3D1, peningkatan ctDNA dalam besaran apa pun diamati pada 66% (21/32) pasien dengan biopsi cair EOT yang dapat dievaluasi dan hanya dua pasien (6%) yang mencapai respons molekuler (Gbr. S3 ). Dua puluh dua pasien tambahan dikeluarkan karena perubahan ctDNA yang tidak dapat diukur (11 di bawah batas kuantifikasi [2% pada C1D1 dan C3D1] dan 11 dengan TF ctDNA negatif yang persisten; Tabel S5 ). Pasien yang mencapai MR (n = 25) memiliki PFS yang memanjang (9,7 vs 1,5 bulan dari C3D1; HR 0,27 [0,15–0,51]; Gbr. 2D ) dan OS (21,1 vs 14,3 bulan dari C3D1; HR: 0,44 [0,22–0,90]; Gbr. 2E ). Mirip dengan deteksi ctDNA, MR dikaitkan dengan ORR, dengan hanya pasien yang mencapai MR juga mencapai respons RECIST 1,1 (68% vs 0%; Tabel S6 ). Saat menggunakan penurunan ≥90% dan penurunan 100% sebagai titik potong untuk MR, hasil serupa diamati untuk PFS dan OS (Gbr. S4 ). Bagi pasien yang memiliki ctDNA tak terdeteksi pada C1D1 dan C3D1 (negatif persisten, n = 11), PFS secara numerik lebih panjang jika dibandingkan dengan pasien dengan MR (13,9 vs 9,7 bulan; HR: 0,79 [0,31–1,97], Gambar S5A ). Median kelangsungan hidup keseluruhan pada pasien ini tidak tercapai, dengan 7/11 pasien bertahan hidup selama lebih dari 2 tahun dan tetap menjalani pengobatan pada saat pemutusan data (Gambar S5B ; Gambar 3 ). Bagi pasien dengan penilaian ctDNA ke-3 dalam 30 hari setelah perkembangan, 12/19 (63%) memiliki peningkatan ctDNA TF dalam besaran apa pun dari penilaian ctDNA C3D1 mereka (Gambar S6 ).
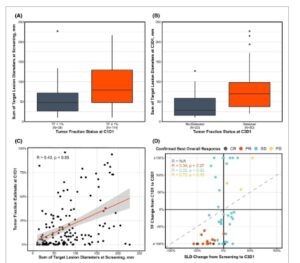
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Deteksi ctDNA dikaitkan dengan SLD. (A) SLD pada awal secara signifikan lebih rendah untuk pasien dengan ctDNA yang tidak terdeteksi pada C1D1 (batang galat mewakili 1,5 kali IQR). (B) SLD pada C3D1 secara signifikan lebih rendah untuk pasien dengan ctDNA yang tidak terdeteksi pada C3D1 (batang galat mewakili 1,5 kali IQR). (C) ctDNA TF dan SLD memiliki korelasi positif yang sederhana. Korelasi dihitung dengan koefisien korelasi Pearson (batang galat mewakili galat baku). (D) Semua pasien dengan PR atau CR mengalami penurunan atau tidak ada perubahan pada SLD dan mengalami penurunan ctDNA TF Korelasi dihitung dengan koefisien korelasi Pearson. SLD, jumlah diameter lesi target; IQR, rentang interkuartil; TF, fraksi tumor; C1D1, siklus 1 hari 1; C3D1, siklus 3 hari 1; CR, respons lengkap; PR, respons parsial; SD, penyakit stabil; PD, penyakit progresif.
3.3 fraksi tumor ctDNA, ukuran lesi target, dan RECIST 1.1
Untuk lebih memahami hubungan antara ctDNA TF dan pencitraan dan RECIST 1.1, kami menganalisis jumlah diameter terpanjang (SLD) lesi (target) sebagai proksi untuk beban tumor pada titik waktu sebelum dan selama perawatan. Mencerminkan analisis kelangsungan hidup keseluruhan prognostik C1D1, kami membandingkan SLD antara pasien dengan ctDNA TF rendah vs tinggi. Pasien dengan ctDNA TF rendah memiliki median SLD yang lebih rendah dibandingkan dengan pasien dengan ctDNA TF tinggi (48,0 mm vs 79,5 mm; Gambar 3A ). Demikian pula, ketika ctDNA TF tidak terdeteksi pada C3D1, median SLD lebih rendah daripada pada pasien dengan ctDNA terdeteksi (28,8 mm vs 70,0 mm; Gambar 3B ). Sementara SLD median lebih rendah pada pasien dengan ctDNA rendah, hanya ada korelasi kontinu yang lemah antara ctDNA TF pada C1D1 dan SLD pada saat skrining (R = 0,43; Gambar 3C ) dan beberapa pasien merupakan outlier. Ketika membandingkan SLD dengan kadar ctDNA TF dalam jenis tumor yang berbeda, tren SLD yang lebih rendah pada pasien dengan ctDNA rendah tetap ada, yang menunjukkan jenis tumor bukanlah alasan yang mendasari perbedaan antara SLD dan ctDNA TF (Gambar S7 ).
Kami menilai perubahan persentase dalam SLD dari skrining ke C3D1 dan membandingkannya dengan perubahan persentase dalam ctDNA TF. Pasien dengan respons keseluruhan terbaik yang dikonfirmasi (cBOR oleh RECIST 1.1, yaitu , hasil radiografi berturut-turut dari respons yang sama atau lebih baik) dari CR atau PR semuanya menunjukkan penurunan ctDNA >50% oleh C3D1 meskipun hanya 2 yang mencapai pengurangan 50% dalam SLD, meskipun tidak ada yang mengalami peningkatan dalam SLD (Gbr. 3D ). Untuk pasien dengan SD atau PD, perubahan ctDNA TF sangat bervariasi dan tidak menunjukkan hubungan dengan perubahan persentase dalam SLD pada C3D1 atau selama pengobatan (Gbr. 3D , 4A ). Namun, analisis tambahan pasien dengan SD oleh RECIST 1.1 menunjukkan bahwa pasien dengan MR atau ctDNA TF negatif persisten memiliki PFS yang memanjang (4,8 vs 2,7 bulan; HR = 0,55 [0,27–1,10]; Gambar 4B ) dan OS (21,9 vs 14,3 bulan; HR = 0,39 [0,16–0,94]; Gambar 4C ) dibandingkan dengan mereka yang mengalami penurunan atau peningkatan ctDNA TF <50%.
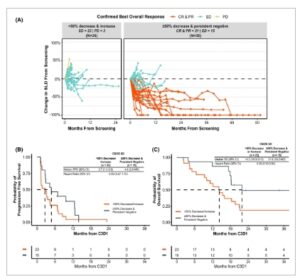
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Perubahan ctDNA memberikan nilai tambahan di luar SLD atau pencitraan radiografi. (A) Di antara 21 pasien dengan cBOR CR atau PR, semuanya mengalami penurunan ctDNA sedikitnya 50% atau secara persisten negatif untuk ctDNA, dan semuanya memiliki tren penurunan SLD dari skrining. Di antara 38 pasien dengan SD sebagai cBOR, tidak ada tren yang jelas muncul di antara respons SLD atau ctDNA. Dalam pasien dengan respons terbaik yang dikonfirmasi dari SD, (B) PFS dan (C) OS keduanya secara numerik lebih panjang pada pasien dengan penurunan ctDNA atau tidak ada perubahan tetapi perbedaannya tidak signifikan secara statistik. SLD, jumlah diameter lesi target; C1D1, siklus 1 hari 1; C3D1, siklus 3 hari 1; PFS, kelangsungan hidup bebas perkembangan; OS, kelangsungan hidup keseluruhan cBOR, respons keseluruhan terbaik yang dikonfirmasi; CR, respons lengkap; PR, respons parsial; SD, penyakit stabil; PD, penyakit progresif.
3.4 Beban mutasi tumor darah dan hasil pasien
Mengingat efikasi atezolizumab dalam kohort ini untuk pasien yang tumornya memiliki tTMB ≥16 mut/Mb, selanjutnya kami mengeksplorasi bTMB dan hasil pasien. bTMB bervariasi menurut jenis tumor (Gbr. 5A ) dan median bTMB dalam kohort penuh adalah 12,6 mut/Mb, mencerminkan populasi yang dipilih untuk pendaftaran berdasarkan peningkatan kadar tTMB. Korelasi kuat diamati antara bTMB dan tTMB pada kadar ctDNA TF yang cukup (keduanya ≥10% dan 1–10%: CCC = 0,95; Gbr. 5B ) tetapi tidak pada pasien dengan ctDNA TF rendah (<1%: CCC = 0,12; Gbr. 5B ) di mana beberapa pasien memiliki perkiraan bTMB 0 mut/Mb meskipun memiliki tTMB yang meningkat. Waktu antara pengumpulan jaringan dan plasma bervariasi (median 284 hari, rentang interkuartil [IQR] 123–561 hari, Gambar S8A ) dan tidak memengaruhi korelasi antara tTMB dan bTMB (Gambar S8B ). Selain itu, konkordansi MSI-H antara jaringan dan cairan tinggi pada pasien dengan ctDNA TF ≥1% (12/14, 86%), sementara hanya satu pasien dengan ctDNA TF <1% yang biopsi jaringannya adalah MSI-H memiliki MSI-H yang terdeteksi dalam biopsi cairan mereka (1/4, 25%).
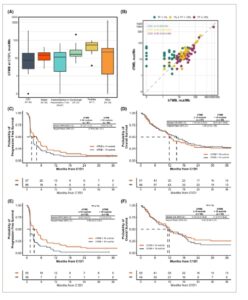
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Distribusi bTMB, ctDNA TF, dan asosiasi dengan hasil. (A) bTMB pada C1D1 menurut kelompok penyakit. (B) Ketika TF 1–10% atau ≥ 10%, terdapat korelasi kuat antara bTMB dan tTMB. Pada TF <1%, tidak terdapat korelasi signifikan antara bTMB dan tTMB, sebagian besar didorong oleh sejumlah kasus di mana bTMB dihitung pada 0 mut/Mb, kemungkinan dalam sampel dengan ctDNA yang tidak terdeteksi. Korelasi dihitung menggunakan koefisien korelasi konkordansi Lin. (C) PFS dan (D) OS tidak dikaitkan dengan peningkatan bTMB menggunakan batas 16 mut/Mb yang ditetapkan untuk tTMB dalam penelitian sebelumnya. (E) Ketika dibatasi pada pasien dengan ctDNA TF ≥1%, bTMB ≥16 mut/Mb dikaitkan dengan penurunan risiko perkembangan. (F) Perbedaan ini tidak terlihat pada OS. C1D1, siklus 1 hari 1; bTMB, beban mutasi tumor darah; mut/Mb, mutasi per megabase; CRC, kanker kolorektal; TF, fraksi tumor; tTMB, beban mutasi tumor jaringan; PFS, kelangsungan hidup bebas perkembangan; OS, kelangsungan hidup keseluruhan; CCC, koefisien korelasi konkordansi Lin.
Dengan menggunakan batas ≥16 mut/Mb, bTMB yang meningkat dikaitkan dengan PFS median yang lebih panjang, tetapi trennya tidak signifikan secara statistik (4,1 vs 1,9 bulan; HR: 0,76 [0,54–1,07]; Gambar 5C ). Tidak ada hubungan dengan kelangsungan hidup keseluruhan yang lebih lama yang diamati (11,9 vs 15,0 bulan; HR: 1,05 [0,72–1,55]; Gambar 5D ). Mengingat korelasi terbatas antara bTMB dan tTMB dalam sampel dengan ctDNA TF rendah, kami kemudian membatasi analisis kami pada pasien dengan ctDNA TF tinggi. PFS yang lebih baik (3,0 vs 1,4 bulan; HR: 0,55 [0,37–0,81], Gambar 5E ) dan ORR yang lebih tinggi (27% v 4%, Tabel S7 ) terlihat pada pasien dengan bTMB yang meningkat tetapi hal ini tidak mengakibatkan OS yang lebih lama secara signifikan (11,9 vs 11,2 bulan; HR: 0,82 [0,54–1,27], Gambar 5F ).
Pada pasien dengan ctDNA TF rendah, tTMB yang meningkat (≥16 mut/Mb) tetap prediktif terhadap PFS yang memanjang (5,8 vs 2,6 bulan; HR: 0,42 [0,19–0,93]; Gambar S9A ) dan OS yang memanjang (median tidak tercapai vs 13,8 bulan; HR: 0,35 [0,13–0,95]; Gambar S9B ). Dengan menggunakan batas yang lebih tinggi sebesar 25 mut/Mb, kami mengamati perbaikan yang bermakna dalam PFS untuk pasien dengan bTMB yang meningkat pada seluruh populasi (4,2 vs 2,5 bulan; HR: 0,68 [0,46–1,00]; Gambar S9C ) tetapi tidak ada hubungan dengan OS yang lebih panjang (11,8 vs 13,8 bulan; HR: 0,96 [0,63–1,49]; Gambar S9D ).
3.5 Hematopoiesis klonal, ctDNA TF, dan bTMB
Karena varian CH dapat mengacaukan kuantifikasi ctDNA dan penilaian bTMB, kami menganalisis hubungan antara deteksi CH dan ctDNA TF dan bTMB. Ketika semua varian, termasuk germline, digunakan untuk menghitung maxVAF, hubungan sedang terlihat antara ctDNA TF dan maxVAF ( R = 0,68; Gambar S10A ), sementara hanya menghilangkan varian germline menghasilkan hubungan yang lebih kuat antara maxVAF dan ctDNA TF ( R = 0,90; Gambar S10B ). Berikutnya, kami membandingkan maxVAF untuk varian yang berasal dari tumor yang diprediksi dan varian CH yang diprediksi dengan ctDNA TF. Seperti yang diharapkan, korelasi positif yang kuat antara maxVAF untuk varian yang berasal dari tumor yang diprediksi ( R = 0,92; Gambar 6A ) diamati, sementara tidak ada hubungan antara maxVAF untuk varian CH yang diprediksi dan ctDNA TF yang terlihat ( R = −0,14 Gambar 6B ). Penelitian telah menunjukkan bahwa CH berhubungan dengan respon yang buruk terhadap ICI [ [ 29 , 30 ] ]. Kami menemukan bahwa pasien tanpa varian CH yang terdeteksi pada C1D1 memiliki tingkat ctDNA TF yang secara signifikan lebih tinggi (median: 17,5% vs 4,6%; Gambar S11 ) sehingga membingungkan kemampuan kami untuk membandingkan hasil antara pasien dengan dan tanpa CH yang terdeteksi.
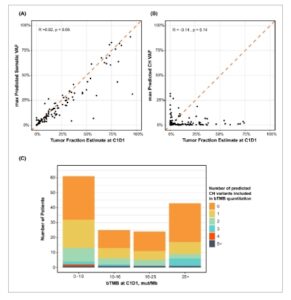
Gbr. 6
Buka di penampil gambar
Presentasi PowerPoint
CH memiliki dampak minimal pada estimasi ctDNA TF dan bTMB. Varian diberi prediksi asal secara algoritmik. (A) Untuk varian turunan tumor yang diprediksi, maxVAF pada C1D1 sangat terkait dengan ctDNA TF sementara (B) tidak terlihat hubungan antara ctDNA TF dan maxVAF untuk varian CH yang diprediksi. Korelasi dihitung dengan koefisien korelasi Pearson (C) Varian CH yang diprediksi memiliki dampak rendah pada estimasi bTMB. Mayoritas kasus tidak mencakup CH, sementara estimasi yang mencakup 2 atau lebih varian CH jarang terjadi. CH, hematopoiesis klonal; bTMB, beban mutasi tumor darah; mut/Mb, mutasi per megabasa; maxVAF, frekuensi alel varian maksimum.
Untuk memahami dampak CH pada penilaian bTMB, kami menerapkan VOP ke semua varian yang disertakan dalam perhitungan bTMB C1D1. Secara keseluruhan, 95% (3629/3814) varian yang memenuhi syarat diprediksi berasal dari tumor, 4% (146/3814) diprediksi sebagai CH, dan 1% (39/3814) diprediksi sebagai germline. Dampak pada tingkat pasien minimal, dengan hanya 32/153 pasien (21%) yang memiliki dua atau lebih varian CH yang disertakan dalam perhitungan bTMB (Gbr. 6C ). Dampak pada nilai bTMB minimal, dengan perubahan median dalam bTMB sebesar 2,53 mut/Mb setelah mengecualikan CH, dan banyak dari perubahan ini terjadi pada sampel dengan bTMB <16 mut/Mb (Gbr. 6C ).
4 Diskusi
ICI telah menerima persetujuan FDA untuk banyak indikasi tumor padat, bersama dengan biomarker pendamping seperti ekspresi PD-L1 dan tTMB. Namun, biomarker ini tidak sempurna dan masih diperlukan peningkatan hasil pasien. Lebih jauh, pencitraan untuk pasien yang diobati dengan ICI dapat bersifat ambigu dan strategi tambahan diperlukan untuk lebih jauh mengelompokkan pasien ini dan meningkatkan pengambilan keputusan pengobatan. Sementara pencitraan tetap menjadi standar emas baik dalam praktik klinis rutin maupun dalam uji klinis, dinamika ctDNA telah muncul sebagai biomarker yang menjanjikan dengan semakin banyaknya bukti yang mendukung kegunaannya untuk menilai pengobatan.
Di sini, kami mempelajari kegunaan biomarker berbasis plasma, termasuk ctDNA TF, pada pasien tumor padat yang diobati dengan atezolizumab sebagai bagian dari uji coba MyPathway. Seperti yang dijelaskan sebelumnya [ [ 31 – 34 ] ], kami mengonfirmasi validitas kuantifikasi ctDNA sebagai penanda prognostik yang kuat; pasien dengan ctDNA TF rendah (<1%) memiliki OS yang jauh lebih lama dibandingkan dengan pasien dengan ctDNA TF tinggi (Gbr. 2A ). Selain itu, kami menunjukkan validitas deteksi ctDNA TF selama pengobatan dan MR (≥50% penurunan ctDNA TF dari C1D1 ke C3D1) untuk memilih pasien dengan PFS dan OS yang memanjang dan ORR tinggi (Gbr. 2B,C ). Temuan ini sejalan dengan karya yang diterbitkan sebelumnya yang menunjukkan hubungan antara penurunan dan/atau pembersihan ctDNA dan peningkatan PFS dan OS untuk pasien yang diobati dengan imunoterapi [ [ 35 – 38 ] ]. Kami mengakui bahwa titik waktu lain tidak diuji dan mungkin memiliki hubungan yang lebih unggul atau serupa dengan hasil, dan investigasi titik waktu lain untuk penilaian ctDNA diperlukan [ [ 39 ] ]. Selain itu, sebagian besar pasien dalam penelitian ini mengalami perkembangan sebelum C3D1, yang menunjukkan penilaian ctDNA mungkin perlu dilakukan lebih awal ( misalnya , siklus 2 hari 1) untuk menambah nilai pada pencitraan rutin dan membantu dalam keputusan pengobatan. Dimasukkannya berbagai jenis tumor padat dalam penelitian ini menunjukkan penerapan potensial yang luas, meskipun penilaian setiap jenis tumor individu dengan kohort besar yang berdedikasi dapat memberikan berbagai titik waktu optimal dan definisi MR spesifik situasi.
Khususnya, 63% pasien yang diobati setelah C3D1 dengan hasil ctDNA yang tersedia menunjukkan peningkatan ctDNA TF dari C3D1 ke EOT (Gbr. S6 ) dan 66% pasien yang mengalami perkembangan sebelum C3D1 mengalami peningkatan ctDNA TF dalam biopsi cair akhir pengobatan mereka (Gbr. S3 ). Banyak penelitian kanker stadium awal telah berupaya untuk memprediksi kekambuhan kanker sebelum pencitraan radiografi dengan mendeteksi ctDNA dengan berbagai metode yang sangat sensitif [ [ 40 , 41 ] ]. Temuan kami menunjukkan peningkatan ctDNA TF dapat digunakan untuk mengidentifikasi pasien dengan kemungkinan perkembangan yang tinggi, tetapi penelitian tambahan diperlukan untuk memahami waktu peningkatan ctDNA dalam kaitannya dengan perkembangan radiografi.
Respons RECIST 1.1 sangat terkait dengan deteksi ctDNA pada pengobatan dan MR. Sementara ORR secara signifikan lebih tinggi untuk pasien dengan ctDNA TF tidak terdeteksi dan MR, DCR pada ctDNA TF terdeteksi dan pasien non-MR masih lebih tinggi daripada yang dilaporkan sebelumnya, mungkin karena pasien dengan perkembangan cepat tidak menerima pengujian ctDNA pada C3D1 atau penggunaan RECIST 1.1 daripada iRECIST [ [ 42 ] ]. Semua pasien dengan cBOR CR atau PR mencapai MR, tetapi dinamika ctDNA bervariasi untuk pasien dengan SD atau PD (Gbr. 3 dan 4 ). Mungkin penggunaan kriteria iRECIST, yang tidak menunjukkan PD pada deteksi pertama peningkatan ≥20% dari SLD pada lesi non-target (dan memerlukan konfirmasi PD minimal 4 minggu) atau pada munculnya lesi baru, dapat berkorelasi lebih baik dengan perubahan ctDNA pada pasien yang tidak mencapai respons dengan kriteria RECIST 1.1.
bTMB merupakan biomarker plasma potensial lain untuk memprediksi respons terhadap ICI. Pada seluruh populasi pengobatan, bTMB bukan merupakan biomarker yang efektif untuk memprediksi hasil pasien, konsisten dengan beberapa penelitian lain yang telah menunjukkan utilitas bTMB yang terbatas [ [ 43 , 44 ] ]. Namun, konkordansi antara tTMB dan bTMB secara langsung dikaitkan dengan kadar ctDNA TF, yang menunjukkan bahwa kadar ctDNA yang rendah pada beberapa pasien kemungkinan mempengaruhi hasil ini. Pada pasien dengan ctDNA TF yang tinggi, PFS yang memanjang dan ORR yang membaik diamati pada pasien dengan bTMB yang meningkat (≥16 mut/Mb; Gambar S9 dan Tabel S7 ). Hubungan antara bTMB yang tinggi dengan OS yang lebih panjang tidak diamati, mungkin karena prognosis yang lebih buruk secara keseluruhan pada pasien dengan ctDNA TF yang tinggi. Penelitian lain yang telah menunjukkan validitas bTMB juga telah mengamati utilitas pada sebagian kecil pasien dengan kadar ctDNA yang meningkat [ [ 15 – 17 ] ].
Hubungan antara ctDNA TF dan bTMB menciptakan tantangan dalam memanfaatkan bTMB untuk perawatan klinis. bTMB mungkin paling cocok untuk pendaftaran dan analisis biomarker eksploratif dalam uji klinis fase awal. Di sini, titik akhir seperti respons dan PFS dapat membantu menginformasikan desain uji coba untuk studi acak fase III di mana OS tetap menjadi standar emas. Bagi dokter yang menerima hasil bTMB dengan profil biopsi cair, hasil saat ctDNA TF rendah sebagian besar tidak dapat diandalkan. Ketika kadar ctDNA TF mencukupi (≥1%), peningkatan bTMB sangat berkorelasi dengan tTMB dan dapat memprediksi respons terhadap ICI, tetapi mengingat implikasi prognostik dari ctDNA yang tinggi, terapi kombinasi dan/atau tindak lanjut yang lebih sering diperlukan.
Studi ini memiliki beberapa keterbatasan. Pertama, uji coba ini melibatkan pasien yang telah menjalani perawatan awal yang berat dan memiliki kelompok jenis tumor yang heterogen. Sementara ORR dalam subkelompok secara umum serupa dengan tren yang diamati dalam kelompok penuh, subanalisis kurang bertenaga, dan studi lebih lanjut mungkin diperlukan untuk menetapkan kegunaan dinamika ctDNA dan bTMB pada beberapa jenis tumor ini. Selain itu, penggunaan pemantauan ctDNA dan bTMB bergantung pada jumlah minimum ctDNA pada awal pengobatan. Pasien lini awal mungkin memiliki perbedaan kadar ctDNA, dan studi tambahan diperlukan untuk memahami deteksi ctDNA di seluruh lini terapi. Kedua, pasien dengan perkembangan cepat (<6 minggu) tidak dimasukkan dalam analisis waktu ke kejadian. Sementara kami menunjukkan bahwa ctDNA meningkat pada sebagian besar pasien dengan biopsi cair yang dapat dievaluasi mendekati waktu perkembangan, apakah lebih banyak waktu menjalani terapi atau siklus tambahan atezolizumab mungkin mengakibatkan penurunan ctDNA masih belum jelas. Titik waktu ctDNA tambahan akan membantu memperjelas perubahan selanjutnya. Akhirnya, meskipun algoritma VOP tidak secara langsung dimasukkan ke dalam algoritma TF, beberapa masukan, seperti sinyal fragmentomik, adalah sama. Oleh karena itu, penilaian dampak CH pada ctDNA TF mungkin bias oleh hubungan antara kedua algoritma ini. Studi yang mencakup pengurutan buffy coat sebagai kebenaran sedang berlangsung dan akan dipublikasikan di masa mendatang.
5 Kesimpulan
Pemantauan ctDNA agnostik jaringan merupakan alat yang layak untuk melacak respons pasien terhadap ICI seperti atezolizumab. Deteksi ctDNA TF selama pengobatan dan MR sangat terkait dengan hasil pasien. Sementara tTMB merupakan biomarker yang efektif untuk stratifikasi pasien dalam penelitian ini, ketergantungan bTMB pada kadar minimum ctDNA TF (≥1%) membatasi kegunaan bTMB.
