Abstrak
Keluarga kotransporter kation-klorida (CCC) mencakup simporter ion yang ikut mengangkut kation monovalen dan Cl − , yang memainkan peran penting dalam mengendalikan kandungan ion sitoplasma. Kotransporter K + -Cl − (KCC) memfasilitasi simport ion melintasi membran plasma. CCC berpartisipasi dalam berbagai proses fisiologis, seperti transportasi ion transepitel dan pengaturan volume sel. Di antara KCC, KCC2 memiliki fungsi unik dan penting dalam sistem saraf pusat. KCC dari Drosophila melanogaster ( Dm KCC) adalah ortolog dari KCC mamalia. Peran pentingnya dalam transmisi neuronal telah dibuktikan. Selain itu, cnidaria Hydra vulgaris memiliki KCC fungsional ( Hv KCC). Analisis komparatif transporter ini dengan rekan vertebrata dapat memberikan wawasan tentang mekanisme transportasi ion KCC, regulasi, dan evolusi. Dengan demikian, di sini kami memurnikan Dm KCC dan Hv KCC dan mengkarakterisasi sifat biofisiknya menggunakan fluorimetri pemindaian diferensial dan hamburan cahaya. Kami mengevaluasi fungsionalitasnya dalam sel dan mengembangkan metode untuk mempelajari transpor ion dengan fotometri nyala. Lebih lanjut, uji berbasis fluoresensi untuk Dm KCC yang direkonstitusi ke dalam proteoliposom dikembangkan. Aktivitas Dm KCC ditemukan bergantung pada Ca 2+ , yang mengingatkan pada beberapa keluarga protein transpor klorida lainnya dan berpotensi penting bagi keluarga protein KCC secara keseluruhan.
Singkatan
4.1N
protein saraf 4.1
AE1
penukar anion 1
CCC
kotransporter kation-klorida
CFP
protein fluoresensi sian
Bahasa Inggris: CHS
kolesterol hemisuksinat
kriogenik-EM
mikroskopi kriogenik elektron
CTD
Domain terminal C
DDM
n -dodesil-β- d- maltosida
DIDS
Asam 4,4′-diisothiocyano-2,2′-stilbenedisulfonat
Bahasa Indonesia: DMEM
Dulbecco yang dimodifikasi Eagle’s medium
GABA A
asam gamma-aminobutyric tipe A
Bahasa Inggris
ginjal embrio manusia
KCC
K + -Cl − kotransporter
Saya sendiri
multiplisitas infeksi
nanoDSF
fluorimetri pemindaian diferensial nano
Ni-NTA
asam nikel-nitrilotriasetat
NKCC
Na + -K + -Cl − kotransporter
NMDA
N -metil- d- aspartat
Bahasa Indonesia: Bahasa Indonesia Timur
Domain terminal N
PACSIN1
protein kinase C dan substrat kasein kinase pada neuron 1
PAM
protein yang terkait dengan Myc
Mal SEC
kromatografi pengecualian ukuran-kopel hamburan cahaya laser statis multi-sudut
Waktu Standar
transmembran
YFP
protein fluoresensi kuning
β-PIX
kinase p21 yang diaktifkan oleh faktor pertukaran beta
Anggota dari keluarga kotransporter kation-klorida (CCC) adalah pengangkut ion aktif sekunder, yang mengangkut kation (Na + dan/atau K + ) dan Cl − [ [ 1 , 2 ] ]. CCC memiliki peran penting dalam membentuk sinyal penghambatan yang tepat dan konektivitas neuronal di otak vertebrata [ [ 3 ] ]. Kotransporter K + -Cl − (KCC) adalah subfamili CCC yang melakukan pengangkutan ion K + dan Cl − melintasi membran plasma, sedangkan kotransporter Na + -K + -Cl − (NKCC), subfamili CCC lainnya, berfungsi sebagai pengangkut ion Na + , K + , dan Cl − . Protein KCC terlibat dalam berbagai proses fisiologis, seperti pengaturan volume sel, transportasi ion transepitel, pensinyalan neuroendokrin, pembentukan sinaps, transmisi sinyal, dan pengaturan tekanan darah [ [ 1 ] ].
Di antara KCC, yang mencakup KCC1-4 pada sebagian besar vertebrata [ [ 4 ] ], khususnya KCC2 telah menarik perhatian karena fungsinya yang unik dan krusial dalam jaringan saraf pusat [ [ 5 , 6 ] ]. Protein KCC2 diketahui bertanggung jawab untuk menjaga konsentrasi Cl − intraseluler yang rendah pada membran postsinaptik, yang sangat diperlukan untuk pensinyalan penghambatan oleh reseptor GABA A [ [ 7 ] ]. Ia juga terlibat dalam pengembangan duri dendritik pada sinapsis glutamatergik rangsang melalui domain regulasi [ [ 8 ] ]. Keterlibatan KCC2 baik dalam sinapsis rangsang maupun penghambatan menunjukkan pentingnya sebagai salah satu molekul kunci untuk transmisi sinyal yang tepat di otak. Hilangnya aktivitas transporter ini telah dikaitkan dengan beberapa gangguan neurologis termasuk skizofrenia [ [ 9 ] ], epilepsi [ [ 10 ] ], cedera otak traumatis [ [ 11 ] ], dan nyeri kronis [ [ 12 ] ]. KCC2 dianggap sebagai salah satu target obat menuju pengobatan penyakit ini [ [ 13 , 14 ] ].
Protein KCC terdiri dari domain α-helix (TM) 12-transmembran dan domain sitoplasma N- dan C-terminal (NTD dan CTD). Domain TM adalah domain transpor ion yang sebenarnya, sementara NTD dan CTD terlibat dalam regulasi aktivitas transpor, misalnya, melalui fosforilasi/defosforilasi beberapa residu dalam domain [ [ 6 , 15 ] ]. CTD juga diketahui bertindak sebagai perancah pengikatan ke protein lain. Interaksi KCC2 CTD dengan protein yang terkait dengan Myc (PAM) [ [ 16 ] ] dan PACSIN1 [ [ 17 ] ] mengatur ekspresi KCC2 secara positif dan negatif, masing-masing, dan memengaruhi fluks ion yang dimediasi KCC2, sementara interaksinya dengan 4.1N [ [ 8 ] ] dan β-PIX [ [ 18 ] ] sangat penting untuk pembentukan duri dendritik yang tepat. Baru-baru ini, struktur cryo-EM dari berbagai KCC telah dipecahkan, menunjukkan konformasi domain TM yang terbuka ke dalam di setiap struktur [ [ 19 – 24 ] ], dan dalam satu kasus keadaan terbuka ke luar karena pengikatan inhibitor [ [ 25 ] ]. Struktur ini juga mengungkapkan situs pengikatan untuk K + dan Cl − dengan residu yang sangat terkonservasi yang dikoordinasikan dengan ion-ion tersebut.
Aktivitas KCC telah dianalisis dengan mengukur perubahan konsentrasi ion intra atau ekstraseluler [ [ 6 ] ]. Pekerjaan awal pada aktivitas transporter CCC dilakukan dengan fotometri nyala [ [ 26 ] ]. Baru-baru ini, ion Tl + dan 86 Rb + sering digunakan sebagai pengganti K + untuk mendeteksi aktivitas KCC. Ini dilakukan dengan mengukur fluoresensi pewarna sensitif Tl + yang dimuat ke dalam sel [ [ 27 ] ] atau radioaktivitas 86 Rb + yang diangkut ke dalam sel [ [ 28 , 29 ] ], masing-masing, sementara NH 4 + juga telah digunakan sebagai pengganti K + untuk mengukur aktivitas KCC [ [ 30 ] ]. Di sisi lain, pengukuran konsentrasi Cl− intraseluler sebagai respons terhadap aktivitas KCC juga telah dilakukan dengan berbagai metode termasuk perekaman gramicidin perforated patch clamp [ [ 31 ] ], perekaman saluran GABA A tunggal dan saluran NMDA [ [ 32 ] ], gradien Cl− soma-ke-dendrit [ [ 33 ] ], indikator peka halida quinolinium [ [ 34 , 35 ] ], dan indikator peka Cl− yang dikodekan secara genetik [ [ 36 , 37 ] ] . Masing-masing metode untuk mengukur aktivitas transpor ion KCC ini memiliki kelebihan dan keterbatasannya sendiri, dan oleh karena itu, akan tetap sangat bermanfaat untuk mengembangkan metode alternatif untuk mendeteksi aktivitas KCC.
Sampai saat ini, hanya sejumlah kecil studi tentang KCC invertebrata yang telah dilakukan. Di antara protein invertebrata, Drosophila melanogaster KCC ( Dm KCC) telah dipelajari paling banyak dan disarankan untuk menjadi penting untuk transmisi neuronal yang tepat di Drosophila [ [ 38 , 39 ] ]. Berdasarkan analisis evolusi KCC, KCC berdiferensiasi menjadi isoform yang berbeda di dasar vertebrata [ [ 4 ] ], dan oleh karena itu, Dm KCC secara filogenetik tidak secara spesifik homolog dengan isoform KCC mamalia apa pun, meskipun dapat dihambat oleh inhibitor spesifik KCC2 mamalia, VU0463271 [ [ 40 , 41 ] ]. Cnidaria Hydra vulgaris adalah spesies lain yang terbukti memiliki protein yang memediasi transpor K + (Tl + ) dan Cl− yang tidak bergantung Na + ( Hv KCC) [ [ 42 ] ]. Meskipun aktivitas transpor ion dari Hv KCC tampaknya secara signifikan lebih rendah dibandingkan dengan Rattus norvegicus KCC2 (rat-KCC2), analisis fungsional, biofisik, dan struktural komparatif dari protein ini dan protein Dm KCC dengan KCC dari spesies lain akan menjadi hal yang penting untuk memahami mekanisme transpor ion dan pengaturannya oleh famili transporter KCC.
Dalam penelitian ini, kami mempertimbangkan Dm KCC dan Hv KCC sebagai sistem model dan mempelajari sifat struktural dan fungsionalnya. Data biokimia dan biofisika yang diperoleh dari KCC yang dimurnikan, bersama dengan pemodelan molekuler, menunjukkan fitur umum antara KCC invertebrata dan mamalia. Dengan menggunakan Dm KCC dan Hv KCC rekombinan, kami menguji aktivitas protein ini dalam sel dengan mengikuti transpor Cl− dengan probe fluoresensi peka Cl− rasiometrik dan transpor K + dengan fotometri nyala. Selain itu, Dm KCC yang dimurnikan dari sel serangga Sf9 direkonstitusi, dan transpor K + ke dalam proteoliposom dipelajari menggunakan probe fluoresensi peka K + .
Bahan dan metode
Konstruksi plasmid
Untuk ekspresi sel serangga, cDNA yang mengkode D. melanogaster KCC ( Dm KCC) varian B (Urutan Referensi NCBI: NM_166632.2 ), H. vulgaris KCC ( Hv KCC; Urutan Referensi NCBI: XP_012555566.1 ), dan Hv KCC domain-terpotong C-terminal ( Hv KCC-ΔCTD) diamplifikasi PCR dengan primer yang mengandung tag His 8 × dan FLAG N-terminal dan dimasukkan ke dalam vektor pFastBac1, secara terpisah. Untuk ekspresi sel mamalia, cDNA yang mengkode Dm KCC, Hv KCC, dan rat-KCC2b diamplifikasi PCR dengan primer yang mengandung tag FLAG N-terminal dan dimasukkan ke dalam vektor pcDNA3.1(−), secara terpisah. Konstruksi dikonfirmasi dengan sekuensing DNA.
Generasi Baculovirus dan ekspresi protein
Vektor pFastBac1 yang mengandung gen Dm KCC, Hv KCC, atau Hv KCC-ΔCTD ditransformasikan ke dalam sel Escherichia coli DH10Bac, dan bacmid serta baculovirus diproduksi menggunakan sistem Bac-to-Bac (Thermo Fisher Scientific, Waltham, MA, AS). Secara singkat, sel Sf9 pada pelat enam sumur ditransfeksi dengan DNA bacmid menggunakan TransIT LT1 (Mirus Bio LLC, Madison, WI, AS). Setelah inkubasi pada suhu 27 °C selama 5–6 hari, stok virus dengan titer rendah diperoleh. Stok virus dengan titer tinggi diperoleh dengan menginfeksi sel Sf9 dengan stok dengan titer rendah dan mengocoknya pada suhu 27 °C hingga viabilitas sel turun di bawah 50%. Untuk uji aktivitas transpor kalium, sel Sf9 pada 1,6 × 106 sel ·mL −1 diinfeksi dengan stok virus titer tinggi dengan multiplisitas infeksi (MOI) 2. Pada 60 jam pasca infeksi, sel diencerkan dengan media kultur segar hingga 2,0 × 106 sel ·mL −1 dan digunakan untuk uji. Untuk penyaringan pelarutan deterjen dan pemurnian protein, sel Sf9 pada 1,5–2,0 × 106 sel ·mL −1 diinfeksi dengan stok virus titer tinggi dengan MOI 2. Pada 60 jam pasca infeksi, sel dipanen dengan sentrifugasi pada 7000 g selama 10 menit.
Pemeriksaan pelarutan deterjen
Pelet sel dari sel Sf9 yang terinfeksi disuspensikan kembali dalam 10 mm Tris –HCl pH 7,5, yang berisi Pierce Protease Inhibitor Mini Tablet (Thermo Fisher). Sel-sel dihomogenisasi menggunakan homogenizer dounce dengan 40 gerakan. Lisat sel disentrifugasi pada 6000 g selama 10 menit pada suhu 4 °C untuk menghasilkan pelet inti dan sel yang tidak rusak. Supernatan disentrifugasi pada 150.000 g selama 0,5 jam pada suhu 4 °C. Pelet yang dihasilkan disuspensikan kembali dalam PBS ditambah 100 mm NaCl yang berisi Pierce Protease Inhibitor Mini Tablet (Thermo Fisher). Suspensi ini kemudian dibagi menjadi beberapa bagian, dan setiap larutan deterjen stok ditambahkan pada rasio 1 : 10 v/v ke setiap bagian sehingga setiap sampel mengandung konsentrasi akhir yang diinginkan dari setiap deterjen. Untuk kontrol positif, milliQ ditambahkan sebagai ganti larutan deterjen ke dalam alikuot (fraksi membran total). Sampel yang dibagi kemudian dikocok pada suhu 4 °C selama 16 jam. Sampel kemudian disentrifugasi pada 150.000 g selama 0,5 jam pada suhu 4 °C. Supernatan yang dihasilkan, fraksi yang larut dalam deterjen, dimuat pada gel SDS/PAGE. Untuk kontrol positif (fraksi membran total), langkah sentrifugasi dilewati, dan suspensi dimuat pada gel. Protein selanjutnya dipindahkan ke membran PVDF, diblokir dengan larutan susu 5%, dan diuji dengan antibodi anti-FLAG tikus diikuti oleh antibodi konjugasi IgG-HRP (horseradish peroxidase) anti-tikus. Membran diinkubasi dengan ECL Prime Western Blotting Detection Reagent (GE Healthcare, Marlborough, MA, AS), dan kemudian pita protein dideteksi menggunakan ChemiDoc XRS+ (Bio-Rad, Hercules, CA, AS).
Pemurnian protein
Pemurnian protein untuk analisis keadaan oligomerisasi dan termostabilitas
Pelet sel yang mengekspresikan KCC disuspensikan kembali dalam buffer Lysis (10 m m Tris–HCl pH 7,5, 5 m m MgCl 2 , 10 m m KCl, 0,001 mg·mL −1 DNase I, Pierce Protease Inhibitor Mini Tablet; Thermo Fisher) lalu disentrifugasi pada 200.000 g selama 20 menit. Pelet disuspensikan kembali dalam buffer Lysis, dihomogenkan dounce, lalu disentrifugasi pada 200.000 g selama 20 menit. Langkah ini diulangi sekali lagi. Pelet kemudian disuspensikan kembali dalam buffer High-salt (10 m m Tris–HCl pH 7,5, 5 m m MgCl 2 , 10 m m KCl, dan 1 m NaCl), dihomogenkan dounce, dan disentrifugasi pada 200.000 g selama 20 menit. Langkah ini diulang tiga kali lagi. Pelet yang dihasilkan disuspensikan kembali dalam buffer Solubilisasi (50 m m Na fosfat pH 7,5, 150 m m NaCl, 50 m m KCl, 10% gliserol) dan dihomogenkan dengan dounce, dan larutan stok n- dodecyl-β- d- maltoside (DDM)/cholesteryl hemisuccinate (CHS) 10%/2% ditambahkan ke sampel sehingga konsentrasi akhir adalah 1%/0,2% DDM/CHS. Sampel dikocok selama 16 jam pada suhu 4 °C dan disentrifugasi pada 170.000 g selama 15 menit. Supernatan diinkubasi dengan resin Ni-NTA selama 3 jam pada suhu 4 °C dengan adanya 10 m m imidazol. Resin dimasukkan ke dalam kolom dan dicuci dengan Buffer pencuci (50 m m Na fosfat pH 7,5, 150 m m NaCl, 50 m m KCl, 10% gliserol, 0,02% DDM, 0,004% CHS, dan 30 m m imidazol). Protein KCC dielusi dengan Buffer elusi (50 m m Na fosfat pH 7,5, 150 m m NaCl, 50 m m KCl, 10% gliserol, 0,02% DDM, 0,004% CHS, 250 m m imidazol). Eluat dipekatkan hingga 0,4–0,5 mL menggunakan konsentrator putar Amicon Ultra, batas 100 kDa (Merck Millipore, Darmstadt, Jerman), dan dijalankan melalui kolom Superdex 200 10/300 (GE Healthcare) dengan buffer berjalan (20 mm HEPES pH 7,4, 150 mm NaCl , 50 mm KCl , 0,015% DDM, 0,003% CHS, 5% gliserol). Fraksi puncak digabungkan dan dipekatkan hingga 1,0 mg·mL −1 .
Pemurnian Dm KCC untuk rekonstitusi menjadi proteoliposom
Sel Sf9 dari kultur 0,5 L dipeletkan dan disuspensikan dalam 0,5 L buffer pencuci yang mengandung 10 m m MES/NaOH pH 6,2, 100 m m NaNO3 , 40 m m KCl, dan 1 m m MgSO4 dan diinkubasi dengan agitasi pada suhu kamar selama 30 menit. Sel yang telah dicuci dipeletkan dan disuspensikan kembali dalam 18 mL buffer lisis yang mengandung 5 m m Tris pH 7,5, 0,5 m m EDTA, Pierce Protease Inhibitor Mini Tablet (Thermo Fisher, 1 tablet per 50 mL). Tepat sebelum memecah sel, 0,5 m m PMSF ditambahkan. Sel-sel diganggu dengan sonikasi. Lisat sel disentrifugasi pada 2000 g selama 10 menit, supernatan dikumpulkan, dan pelet disuspensikan kembali, dihomogenisasi lagi menggunakan homogenizer dounce, dan disentrifugasi pada 2000 g selama 10 menit. Supernatan digabungkan dan disentrifugasi pada 100.000 g selama 30 menit. Supernatan dibuang, dan pelet membran disuspensikan dalam 20 mL buffer yang mengandung 20 m m HEPES/BTP pH 7,0 dan 2 m m MgCl2 , dipeletkan lagi pada 150.000 g selama 30 menit dan akhirnya disuspensikan kembali dalam buffer yang sama. Membran yang diperoleh dibekukan dengan cepat dan disimpan pada suhu -75 °C. Membran dalam volume 2-4 mL disuspensikan dalam 14-16 mL buffer basa (BB) yang mengandung 50 m m HEPES/BTP pH 7,5, 150 m m NaCl dan 10% gliserol. Untuk pelarutan, DDM dan CHS ditambahkan hingga konsentrasi akhir masing-masing 1% dan 0,005%. Suspensi diaduk pada suhu 4 °C selama 30 menit dan kemudian dijernihkan dengan sentrifugasi pada 145.000 g selama 30 menit. Imidazol ditambahkan ke supernatan pada konsentrasi akhir 10 m m , dan sampel dicampur dengan 1 mL resin Ni-NTA dan diinkubasi menggunakan agitasi lembut pada suhu 4 °C selama 1 jam. Resin dengan KCC terikat dicuci dengan 15 mL BB yang mengandung 30 m m imidazol, 0,025% DDM, dan 0,005% CHS. Kemudian KCC dielusi dengan 5,5–6,0 mL BB yang mengandung 250 m m imidazole, 0,025% DDM, dan 0,005% CHS. Protein yang dielusi dipekatkan menggunakan konsentrator cutoff Vivaspin 100KDa (Sartorius, Göttigen, Jerman) hingga 100 μL (6–8 mg·mL −1 ), dibekukan dengan cepat, dan disimpan pada suhu −75 °C dalam 2–3 bagian.
Kromatografi pengecualian ukuran analitis
Kromatografi pengecualian ukuran-kopel hamburan cahaya laser statis multi-sudut (SEC-MALLS) digunakan untuk mengkarakterisasi keadaan oligomerisasi protein yang dimurnikan. Sampel protein pada 1,0 mg·mL −1 dijalankan melalui kolom Superdex 200 10/300 (GE Healthcare) dengan buffer berjalan (20 mm HEPES pH 7,4, 150 mm NaCl , 50 mm KCl , 0,015% DDM, 0,003% CHS, 5% gliserol) pada laju alir 0,3 mL·min −1 dengan sistem HPLC (Shimadzu, Kyoto, Jepang), detektor hamburan cahaya MiniDAWN TREOS, dan detektor indeks bias Optilab rEX (Wyatt Technology Corp.). Data kemudian dianalisis dengan program konjugat protein dalam perangkat lunak astra 6 (Wyatt Technology Corp., Goleta, CA, AS).
Analisis Termostabilitas
Termostabilitas protein dianalisis dengan fluorimetri pemindaian diferensial nano bebas label (nanoDSF, Prometheus, Nanotemper). Kapiler diisi dengan 15 μL 0,5 mg·mL −1 Dm KCC atau Hv KCC dalam 15 m m HEPES pH 7,4, 75 m m NaCl, 100 m m KCl, 0,015% DDM, 0,003% CHS, 5% gliserol, dan ditempatkan pada tempat sampel. Gradien suhu 0,5 °C·min −1 dari 15 °C hingga 80 °C diterapkan, dan fluoresensi protein intrinsik pada 330 dan 350 nm direkam.
Pemodelan struktur protein
Model untuk Dm KCC dihasilkan menggunakan server SwissModel [ [ 43 ] ]. Beberapa model dihasilkan dengan berbagai templat struktur KCC. Model yang dihasilkan dengan struktur dimer KCC3 (PDB ID: 6M1Y ) sebagai templat dipilih karena KCC3 memiliki identitas sekuens tertinggi dengan Dm KCC (60% identitas pada bagian yang dimodelkan). Struktur templat memiliki ion K + dan Cl − terikat dalam strukturnya, dan tidak ada inhibitor, ligan, atau mutasi lain yang berpotensi memengaruhi konformasi. Struktur templat lain juga dapat digunakan, karena perbedaan dengan templat lain agak kecil. Skor GMQE dan QMEAN untuk model tersebut masing-masing adalah 0,64 dan −4,07.
Kultur dan transfeksi sel HEK 293
Sel ginjal embrionik manusia (HEK) 293 dipelihara dalam medium Eagle yang dimodifikasi Dulbecco (DMEM), yang dilengkapi dengan 10% serum sapi fetal dan 50 IU·mL −1 penisilin–streptomisin. Sel ditransfeksi dengan pcDNA yang sesuai menggunakan reagen Lipofectamine 2000 (Life Technologies, Carlsbad, CA, AS) dan digunakan 40–44 jam setelah transfeksi. Secara singkat, sel ditempatkan dalam suspensi dalam media Opti-MEM (6 × 105 sel ·mL −1 ) dan dicampur dengan 150 μL kompleks Lipofectamine/DNA. Kompleks Lipofectamine/DNA diperoleh dengan menginkubasi 75 μL media Opti-MEM dengan 3,5 μL reagen Lipofectamine 2000 (campuran A yang mengandung Lipofectamine 2000). Campuran 75 μL Opti-MEM dan 0,75 μg DNA yang mengkodekan konstruksi yang diinginkan (misalnya, 0,5 μg rat-KCC2 sebagai kontrol positif, mock-KCC2 (vektor kosong) sebagai kontrol negatif, Dm KCC, atau Hv KCC dan 0,25 μg SuperClomeleon; campuran B yang mengandung DNA) disiapkan lebih lanjut. Campuran A dan B dicampur, diinkubasi selama 20 menit pada suhu ruangan, lalu diinkubasi dengan suspensi sel HEK 293 yang baru disiapkan. Sel-sel didistribusikan ke dalam pelat 96-sumur dan diinkubasi pada suhu 37 °C, 5% CO2 . Lalu, setelah 12 jam, transfeksi dihentikan dengan substitusi 90% media Opti-MEM dengan media DMEM baru. Sel-sel digunakan dalam percobaan 40–44 jam setelah transfeksi.
Uji aktivitas transpor klorida KCC dalam sel HEK 293
Untuk menentukan aktivitas rat-KCC2, Dm KCC, dan Hv KCC, perubahan fluoresensi yang dipancarkan oleh probe SuperClomeleon yang sensitif terhadap Cl − [ [ 44 ] ] sebagai respons terhadap perubahan konsentrasi [Cl − ] i dicatat. Sel HEK 293 yang mengekspresikan rat-KCC2, Dm KCC, Hv KCC, atau vektor mock-KCC2 dimuat dengan [Cl − ] i dengan menginkubasinya dalam larutan yang mengandung [K + ] o dan [Cl − ] o yang tinggi . Larutan ini, dinamakan “larutan 75 K + ” (mengandung 148 mm Cl- dan 140 mm K + ( dalam mm ) : 140 KCl, 10 HEPES, 20 d -glukosa, 2 CaCl2 , 2 MgCl2 , pH 7,4, osmolalitas disesuaikan menjadi 300 mOsm dengan menambahkan Na-glukonat), diencerkan dalam larutan penyangga HEPES (HBS) (dalam mm ) (140 NaCl, 2,5 KCl, 10 HEPES, 20 d -glukosa, 2,0 CaCl2 , 2,0 MgCl2 , pH 7,4, osmolalitas 300 mOsm, disesuaikan menggunakan NaCl). Setelah 10 menit pemuatan, larutan bebas K + (mengandung 148 mm Cl − dan 0 mm K + (dalam mm ) : 140 NaCl, 10 HEPES, 20 d -glukosa, 2 CaCl 2 , 2 MgCl 2 , pH 7,4, osmolaritas disesuaikan menjadi 300 mOsm dengan menambahkan Na-glukonat) ditambahkan ke media ekstraseluler. Penambahan larutan bebas K + mengubah jumlah gradien elektrokimia dan memicu ekstrusi Cl − yang bergantung pada KCC dan perubahan [Cl − ] i . Hal ini memicu modifikasi fluoresensi SuperClomeleon dan penurunan rasio sinyal CFP/YFP (R CFP/YFP ), yang mencerminkan fungsionalitas KCC yang dipelajari. Fluoresensi diukur menggunakan pembaca mikroplat (FluostarOptima; BMG Labtech, Ortenberg, Jerman) dengan dua set filter yang diaktifkan secara berurutan. Pengukuran pertama dilakukan menggunakan set filter yang mendeteksi fluoresensi sensitif Cl − dari bagian YFP dari probe SuperClomeleon (eksitasi 500 nm, emisi 560 nm), dan pengukuran kedua dilakukan menggunakan set filter yang mendeteksi Cl −fluoresensi tak peka dari bagian CFP dari probe SuperClomeleon (eksitasi 450 nm, emisi 480 nm). Interval antara pengukuran adalah 90 detik. Sel yang tidak ditransfeksi digunakan sebagai kontrol untuk tingkat fluoresensi latar belakang. Setiap percobaan dilakukan dalam rangkap tiga. Hasilnya dianalisis menggunakan Excel dan prisma graphpad (GraphPad, Boston, MA, AS).
Uji aktivitas transpor kalium Dm KCC pada sel Sf9
Sel Sf9 yang terinfeksi dengan baculovirus yang mengekspresikan Dm KCC dan Hv KCC-ΔCTD digunakan. Satu mililiter suspensi sel (2,0 × 106 sel·mL −1 ) disentrifugasi pada 500 g selama 3,5 menit, dan kemudian sel disuspensikan kembali dalam 1 mL buffer pengujian (200 m m MES/Bistris propana (BTP) pH 6,2, 2 m m MgSO 4 ). Reaksi dimulai dengan penambahan RbCl atau RbNO 3 seperti yang ditunjukkan, dan setelah inkubasi untuk waktu yang berbeda pada 20 °C, dihentikan dengan sentrifugasi pada 4 °C. Kemudian sel dicuci dengan 1 mL manitol dingin 500 m m dan disentrifugasi pada 700 g selama 3,5 menit. Pelet sel disuspensikan kembali dalam 2 mL larutan uji Li (Standar internal Li 3000 mmol; Laboratorium Instrumentasi, Bedford, MA, AS) yang diencerkan 200 kali dengan air, dan kandungan K + segera diukur dengan fotometer nyala (PFM 234; Laboratorium Instrumentasi). Untuk mempelajari ketergantungan [Cl − ], medium tersebut dilengkapi dengan garam N -metil- d -glukamina klorida pada berbagai konsentrasi.
Rekonstitusi Dm KCC menjadi proteoliposom
Misel biner lipid/deterjen disiapkan dengan sonikasi 18 mg·mL −1 azolektin dalam 50 m m HEPES/BTP pH 7,0, 0,5% DDM, dan 0,005% CHS. Sekitar 0,15 mg KCC ditambahkan ke 250 mikroL dan dibiarkan dalam pengadukan lembut selama 20 menit untuk pembentukan misel terner. Proteoliposom terbentuk setelah penambahan 170 μL BioBeads (Bio-Rad) per 250 μL misel terner dan pengadukan lembut pada suhu kamar selama 2 jam. Liposom bebas protein disiapkan dengan cara yang sama. Deskripsi terperinci tentang persiapan protein diberikan dalam Informasi Pendukung .
Pemantauan transportasi kalium dalam proteoliposom
Proteoliposom yang telah disiapkan diisi dengan 0,3 mm ION Potassium Green-2 TMA+ Salt, indikator K + (#ab142807; Abcam, Waltham, MA, AS) (FKG), probe hijau fluoresensi yang sensitif terhadap K + , dengan sonikasi ringan. Probe ini memiliki afinitas rendah untuk K + (Gbr. S2 ), yang mengharuskannya digunakan pada konsentrasi garam kalium yang agak tinggi. Probe di luar liposom dihilangkan dengan dua kali pengujian berurutan melalui Kolom Gel Mikro Bio-Spin P-6 (Bio-Rad) yang diekuilibriumkan dengan 50 mm HEPES /BTP pH 7,0. Masuknya K + ke dalam proteoliposom dalam buffer yang sama dimulai dengan penambahan garam K + , dan perubahan fluoresensi diikuti menggunakan spektrofotometer fluoresensi Hitachi F-7000 (Hitachi, Tokyo, Jepang) pada λ ex = 526 nm dan λ em = 546 nm. Sensitivitas masuknya K + ke asam 4,4′-diisothiocyano-2,2′-stilbenedisulfonic (DIDS) diuji dengan mengukur tingkat fluoresensi FKG pada 300 detik setelah penambahan 75 mm KCl ke proteoliposom yang dinormalisasi ke tingkat fluoresensi tanpa adanya DIDS.
Hasil
Pemurnian dan karakterisasi biofisik Hv KCC dan Dm KCC
Baik konstruksi Hv KCC maupun Dm KCC diekspresikan dengan sistem baculovirus dari sel Spodoptera frugiperda Sf9. Berdasarkan penyaringan deterjen, DDM dipilih untuk melarutkan protein untuk pemurnian (Gbr. S1A,B ). Kedua protein dimurnikan dengan kromatografi afinitas Ni diikuti oleh kromatografi pengecualian ukuran, dan fraksi-fraksi digabungkan untuk puncak yang mewakili dimer yang diduga (Gbr. 1A,B ). Kemurnian fraksi-fraksi yang digabungkan diverifikasi oleh SDS/PAGE. Data SEC-MALLS menunjukkan bahwa Hv KCC yang dimurnikan dengan DDM dalam kombinasi dengan CHS berada dalam keadaan dimerik dengan berat molekul protein 236 kDa dan massa kompleks total protein/DDM/CHS sebesar 456 kDa (Gbr. 1C ), yang dianggap sebagai bentuk fungsional untuk KCC mamalia [ [ 3 ] ], sedangkan untuk Dm KCC, tidak mungkin untuk mendapatkan pengukuran yang akurat karena adanya akumulasi carryover dalam sinyal hamburan cahaya. Namun, berdasarkan profil elusi untuk kedua protein pada Gbr. 1A,B , puncak utama yang dimurnikan untuk Dm KCC sesuai dengan dimer seperti yang diverifikasi untuk Hv KCC. Termostabilitas protein dianalisis dengan nanoDSF bebas label. Hv KCC kurang stabil, sedangkan Dm KCC memiliki transisi yang jelas dan juga lebih stabil dengan Tm sekitar 52 °C dibandingkan dengan 44 °C untuk Hv KCC seperti yang diukur dari data (Gbr. 1D ).
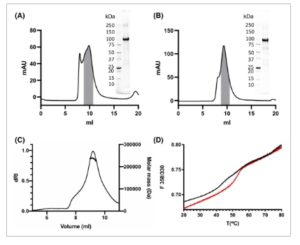
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Pemurnian dan karakterisasi biofisik KCC. (A) Profil kromatografi filtrasi gel Dm KCC dan (B) Hv KCC dengan fraksi terkumpul yang ditandai dengan warna abu-abu; sisipan memperlihatkan analisis SDS/PAGE dari material yang dimurnikan. (C) Analisis SEC-MALLS dari Hv KCC yang memperlihatkan spesies dimerik yang nyata sebagai keadaan oligomerisasi yang menonjol dengan massa molekul protein sekitar 236 kDa (pengukuran tunggal, dengan kontrol bovine serum albumin pada 1 mg·mL −1 ). (D) Analisis fluorimetri pemindaian diferensial dari termostabilitas Dm KCC (merah) dan Hv KCC (hitam) yang diukur sebagai fungsi emisi fluoresensi triptofan intrinsik ( n = 1).
Perbandingan struktur dan urutan dengan struktur KCC yang diketahui dan implikasinya terhadap pengikatan ion dan spesifisitas
Berdasarkan penyelarasan sekuens, Hv KCC memiliki 51–53% identitas sekuens dengan KCC1-4 manusia dan Dm KCC, sementara Dm KCC memiliki 55–58% identitas dengan KCC1-4 manusia dan 52% identitas sekuens dengan Hv KCC. Model Dm KCC diselaraskan dengan struktur KCC4 manusia yang dipecahkan pada resolusi 2,9 Å [ [ 22 ] ] (PDB: 7D99 ), yang merupakan struktur tipe liar dimerik resolusi tertinggi tanpa inhibitor atau mutasi dan dengan ion yang ada. Perbandingan model menunjukkan, seperti yang diharapkan, bahwa lipatan keseluruhan sangat mirip dengan struktur yang diketahui (Gbr. 2A ). Kelima residu koordinasi K + , tiga koordinasi Cl1, dan empat koordinasi Cl2 sangat terkonservasi di seluruh spesies, termasuk dalam Dm KCC dan Hv KCC (Gbr. 2B,C ). Residu koordinasi ion setara dengan Tyr216 dan Thr432 yang mengoordinasikan K + (penomoran KCC4) dan karbonil tulang punggung Asn131 dan Thr132. Dalam kasus koordinasi Cl, amida tulang punggung Gly134, Val135, dan Ile136 (Cl1); dan Gly433, Ile434, dan Met345 (Cl2), dan hidroksil rantai samping Tyr589 (Cl2) mengoordinasikan pengikatan ion; Cl1 juga dikoordinasikan secara langsung oleh K + yang terikat . Untuk kejelasan, hanya residu terpilih yang ditunjukkan pada Gambar 2B . Residu pengikat Na + , seperti yang terlihat dalam struktur NKCC1 (TM1 Leu297 dan Trp300, dan TM8 Ala610, Ser613, dan Ser614 dalam penomoran NKCC1 manusia) [ [ 45 ] ] tidak ditemukan dalam model atau sekuens Dm KCC maupun Hv KCC (Gbr. 2B,C ). Secara keseluruhan, pemodelan struktural, seperti yang ditunjukkan dalam Gbr. 2 untuk Dm KCC, menunjukkan bahwa protein tersebut sangat terkonservasi secara struktural, dan protein yang dipelajari memiliki situs fungsional yang sama dengan KCC mamalia.
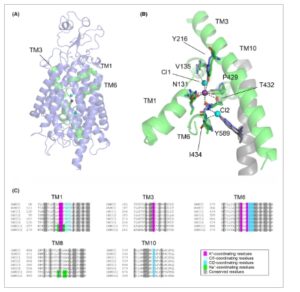
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Model struktural Dm KCC. (A) Struktur daerah transmembran (TM) keseluruhan dari Dm KCC (biru) berdasarkan pemodelan homologi dibandingkan dengan heliks pengikat ion KCC4 (PDB: 7D99 ) (berwarna hijau) dengan ion Cl − (cyan) dan K + (magenta) terikat yang ditunjukkan sebagai bola. Swiss-Model ( https://swissmodel.expasy.org/ ) dengan pengaturan default digunakan untuk membangun model homologi. (B) Situs pengikatan ion dan residu kunci dalam heliks TM 1, 3, dan 6 (biru), dilapisi dengan residu KCC4 analog (hijau) (penomoran residu KCC4 ditunjukkan, lihat teks). Heliks TM KCC4 10 ditunjukkan untuk konteks (abu-abu) dan dengan satu kontribusi Tyr589 dan residu ekuivalen Dm KCC yang dilestarikan (biru), situs pengikatan ion Cl- “Cl1” dan “Cl2” ditunjukkan secara terpisah. (C) Penjajaran sekuens Hv KCC dan Dm KCC dengan manusia KCC1-4 (hKCC1-4) dan manusia NKCC1-2 (hKNCC1-2), dengan residu yang dilestarikan dalam heliks TM 1, 3, 6, 8, dan 10 diwarnai seperti yang ditunjukkan. clustal omega ( https://www.ebi.ac.uk/jdispatcher/msa/clustalo ) dengan parameter default digunakan untuk menghasilkan penjajaran sekuens.
Pengukuran aktivitas pada sel yang mengekspresikan KCC
Hv KCC dikarakterisasi secara fungsional sebelumnya [ [ 42 ] ], dan kami menggunakannya di sini sebagai referensi menuju karakterisasi lebih lanjut dari Dm KCC. Kami menilai aktivitas kedua protein menggunakan uji ekstrusi klorida dalam kultur sel. Temuan kami mengungkapkan bahwa Dm KCC menunjukkan aktivitas yang jauh lebih tinggi, sebanding dengan protein kontrol rat-KCC2 yang menjadi dasar pengembangan uji tersebut. Sebaliknya, Hv KCC menunjukkan aktivitas yang relatif rendah dalam uji kultur sel HEK 293, sesuai dengan pengukuran sebelumnya oleh Hartmann et al . [ [ 42 ] ] (Gbr. 3A,B ). Khususnya, laju ekstrusi awal untuk protein Drosophila secara signifikan lebih besar, yang menunjukkan perbedaan potensial dalam fungsionalitas antara kedua protein tersebut. Atau, aktivitas Hv KCC yang berkurang dapat dikaitkan dengan mekanisme pengaturan yang berbeda, seperti fosforilasi atau faktor lain, yang terkait dengan lingkungan kultur sel mamalia.
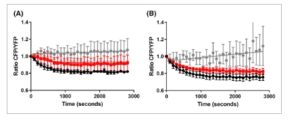
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Uji ekstrusi klorida berbasis sel untuk aktivitas KCC. Sel dimuat dengan [Cl − ] i dengan menginkubasinya dalam larutan yang mengandung [K + ] o dan [Cl − ] o yang tinggi . Penambahan larutan bebas K + mengubah jumlah gradien elektrokimia dan memicu ekstrusi Cl − yang bergantung pada KCC dan perubahan [Cl − ] i . Hal ini memicu modifikasi fluoresensi SuperClomeleon dan penurunan rasio sinyal CFP/YFP (RCFP/YFP), yang mencerminkan fungsionalitas KCC yang dipelajari. Data diplot untuk (A) KCC Hv (kotak merah) dan (B) KCC Dm (kotak merah). KCC2 tikus tipe liar digunakan sebagai kontrol positif dalam A dan B (lingkaran hitam). Sel yang ditransfeksi dengan vektor kosong (lingkaran abu-abu) digunakan sebagai kontrol negatif dalam kedua pengukuran. Untuk tiap kondisi, hasil dinyatakan sebagai rata-rata dari tiga percobaan independen dalam rangkap tiga, batang kesalahan menunjukkan kesalahan standar rata-rata.
Uji aktivitas transpor kalium dilakukan dalam sel Sf9 untuk memverifikasi aktivitas Dm KCC dalam sistem ekspresi (Gbr. 4 ). Untuk tujuan ini, RbCl atau RbNO3 ditambahkan ke sel yang disuspensikan dalam medium bebas K + dan Cl− atau NO3− dan penurunan kandungan K + intraseluler akibat masuknya Rb + diikuti. Keluarnya K + yang diamati sangat bergantung pada Cl− ( tetapi tidak pada NO3− ) dan dihambat oleh bumetanida (Gbr. 4A ) . Gambar 4B menunjukkan kinetika transpor pada berbagai konsentrasi Cl− , yang menunjukkan bahwa laju keluarnya meningkat seiring dengan peningkatan konsentrasi Cl− .
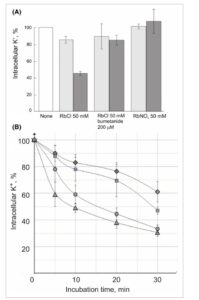
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Rb + -dependent K + efflux oleh KCC dari sel Sf9. (A) Bagan batang yang menunjukkan Hv KCC-ΔCTD (kontrol negatif) dalam warna abu-abu muda dan Dm KCC dalam warna abu-abu gelap. Kandungan K + dalam 20 menit setelah penambahan garam Rb + dinormalisasi terhadap nilainya sebelum penambahan, “tidak ada”. Simpangan baku (SD) untuk empat pengulangan ditunjukkan. (B) Kinetika effluks K + pada [Cl − ] yang berbeda: belah ketupat 10 mm , persegi 20 mm , lingkaran 40 mm , segitiga 80 mm . Pada menit ke-nol, 50 mm RbNO 3 ditambahkan . Kesalahan dilaporkan sebagai SD untuk tiga pengulangan.
Afinitas Dm KCC yang agak rendah terhadap klorida sejalan dengan data pada KCC mamalia: Km = 67,3 mm untuk KCC2 manusia [ [ 27 ] ], Km > 50 mm untuk KCC2 tikus [ [ 29 ] ]. Masuknya Rb + dikaitkan dengan ekspresi Dm KCC aktif, karena tidak ditemukan kehilangan K + yang diaktifkan oleh Rb + pada sel Sf9 yang mengekspresikan KCC Hv yang terpotong CTD yang tidak aktif . Oleh karena itu, uji berbasis sel baru untuk aktivitas KCC rekombinan yang diekspresikan dalam sel serangga telah dibangun, yang dapat berguna untuk penelitian masa depan pada transporter ion.
Pengukuran aktivitas KCC yang terisolasi dalam sistem yang direkonstitusi
Berikutnya, masuknya kalium ke dalam proteoliposom dengan Dm KCC yang direkonstitusi diukur. Anehnya, diamati bahwa aktivitas meningkat dengan adanya Ca 2+ , yang belum pernah diamati sebelumnya dengan KCC mana pun. Transpor kalium terdiri dari dua komponen: bergantung Ca 2+ dan tidak bergantung Ca 2+ (Gbr. 5A–C ). Rasio antara komponen-komponen ini bervariasi dari satu pemurnian Dm KCC ke pemurnian lainnya. Komponen yang bergantung Ca 2+ memiliki amplitudo berbeda yang ditentukan oleh anion yang ada: Cl − ≥ NO 3 − > SCN − ≫ SO 4 2− (Gbr. 5B ), sedangkan anion tidak berpengaruh pada komponen yang tidak bergantung Ca 2+ (Gbr. 5C ). Tidak ada ketergantungan pada Ca 2+ atau anion pada masuknya K + pasif ke dalam liposom bebas protein yang diamati, kecuali SCN − , yang terkenal karena permeabilitasnya yang lebih tinggi melintasi membran. Komponen independen Ca 2+ mencakup transpor kalium pasif melalui lapisan lipid dan memiliki sifat yang sama. Tidak ada atau efek yang dapat diabaikan pada masuknya K + ke dalam proteoliposom yang diamati dengan penambahan inhibitor KCC konvensional, bumetanide dan furosemide (Gbr. S3 ). Sebaliknya, inhibitor transporter dan saluran anion, DIDS, yang juga dilaporkan sebagai inhibitor KCC [ [ 46 ] ], secara efisien menekan komponen yang bergantung pada Ca 2+ dari masuknya K + pada konsentrasi rendah (IC50 = 25 nm ) (Gbr. 5D ). Komponen independen Ca 2+ tidak sensitif terhadap DIDS.
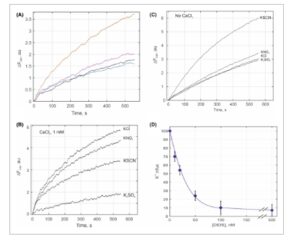
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Masuknya K + ke dalam proteoliposom dimediasi oleh Dm KCC yang direkonstitusi. Garam K + ditambahkan ke proteoliposom pada waktu nol pada konsentrasi yang setara dengan 75 mm K + . (A) Aktivasi masuknya K + yang diinisiasi oleh KCl dengan adanya garam yang berbeda: 1 mm CaCl2 ( oranye ) , 1 mm MgSO4 ( ungu), 1 mm EDTA (hitam), tanpa penambahan (biru); (B) Ketergantungan masuknya K + pada anion lawan dengan adanya 1 mm CaCl2 . (C) Ketergantungan masuknya K + pada anion lawan tanpa adanya CaCl2 . (D) Penghambatan masuknya K + oleh DIDS. Hanya komponen yang bergantung pada Ca2 + yang sensitif terhadap DIDS. Data dari tiga rekonstitusi yang berbeda dirata-ratakan (D), kesalahan dihitung sebagai SD, dan data representatif ditunjukkan dalam A–C.
Diskusi
Studi tentang KCC invertebrata mengungkapkan bahwa setidaknya Dm KCC jelas memiliki sifat dasar yang sama dengan kotransporter K + -Cl − mamalia. Dm KCC yang dimurnikan cenderung mempertahankan keadaan dimerik seperti KCC mamalia, dan kami menunjukkan bahwa residu pengikat ion dilestarikan berdasarkan prediksi struktur dari struktur KCC yang terkait erat yang baru-baru ini dipecahkan secara eksperimental. Dm KCC yang diisolasi agak termostabil, yang membuat protein tersebut cocok untuk penelitian lebih lanjut. Sementara Hv KCC rekombinan memiliki aktivitas Cl − -efflux yang relatif lebih lemah (Gbr. 3A ), yang sejalan dengan data yang dilaporkan sebelumnya [ [ 42 ] ], Dm KCC rekombinan bersifat fungsional, seperti yang diamati Cl − efflux dari sel HEK 293 sebanding dengan efluks yang dimediasi oleh rat-KCC2 dalam penelitian kami (Gbr. 3B ) Kami menggunakan Rb + sebagai penanda untuk transpor kalium seperti pada [ [ 47 ] ], tetapi kami mengikuti perubahan dalam konsentrasi kalium intraseluler karena penyerapan Rb + (Gbr. 4 ). Kami menunjukkan bahwa penyerapan Rb + ini dihambat oleh bumetanida dan bergantung pada klorida. Diketahui bahwa bumetanide adalah inhibitor spesifik untuk NKCC pada konsentrasi yang lebih rendah tetapi juga digunakan untuk menghambat KCC pada konsentrasi yang lebih tinggi, misalnya, dengan setengah penghambatan maksimal ( K 0,5 ) = 180 μ m untuk KCC1 kelinci dan K 0,5 ~ 900 μ m untuk KCC4 tikus [ [ 47 ] ]. Perlu dipertimbangkan bahwa ekspresi protein pengangkut ion rekombinan asing dapat menyebabkan serangkaian kejadian di dalam sel, termasuk modifikasi pascatranslasi, regulasi protein ini, dan/atau aktivasi sistem transpor asli intrinsik. Mempelajari proses transpor karena ekspresi KCC rumit karena sel-sel dari jaringan yang berbeda, masing-masing dengan set sistem pengangkut ion yang unik, dapat merespons dengan cara yang beragam. Oleh karena itu, sangat penting untuk menjelaskan mekanisme spesifik fungsi KCC, yang dapat didekati dengan mengisolasi protein dan menyusunnya kembali menjadi liposom. Sebelumnya, Zhao et al . [ [ 25 ] ] menunjukkan bahwa masuknya Tl + ke dalam proteoliposom dengan KCC1 manusia yang direkonstitusi dihambat oleh VU0463271, penghambat KCC yang diuji pada sel, tetapi ketergantungan transpor pada Cl − tidak diselidiki. Studi kami tentang Dm yang direkonstitusiKCC mengungkapkan sifat-sifat protein yang tidak terduga: masuknya kalium yang dimediasi oleh Dm KCC merupakan kombinasi dari dua komponen, bergantung Ca 2+ dan tidak bergantung Ca 2+ , yang menunjukkan dua populasi protein. Hal ini mungkin disebabkan oleh ekspresi fungsional parsial dan/atau regulasi Dm KCC dalam sel Sf9. Kemungkinan komponen yang bergantung Ca 2+ mencerminkan aktivitas intrinsik Dm KCC, karena ia membedakan anion lawan dan dihambat oleh penghambat pengangkut dan saluran anion, DIDS. Komponen lainnya, yang tidak sensitif terhadap DIDS, bumetanida, dan furosemid dan tidak menentu terhadap anion, dapat mencerminkan permeabilitas K + buatan karena lapisan lipid yang terganggu oleh adanya protein yang sebagian terlipat dan/atau teragregasi secara tidak tepat dalam sediaan.
Ketergantungan Ca 2+ pada KCC belum pernah diuji sebelumnya, karena semua percobaan dilakukan pada sel dalam larutan yang mengandung Ca 2+ . Dalam penelitian kami, kami menunjukkan dalam proteoliposom yang direkonstitusi bahwa masuknya K + oleh Dm KCC difasilitasi oleh Ca 2+ (Gbr. 5 ). Apakah efek Ca 2+ ini umum di antara spesies yang berbeda dan CCC yang berbeda masih harus dipelajari lebih lanjut. Data tentang penghambatan KCC oleh DIDS langka dalam literatur. Pada kisaran μ m , ditemukan menghambat KCC1 kelinci rekombinan dan KCC4 tikus dalam oosit [ [ 47 ] ] dan efluks K + yang bergantung Cl − dalam eritrosit domba, yang diduga karena KCC [ [ 48 ] ]. DIDS adalah inhibitor konvensional terkenal dari transporter dan saluran anion termasuk beberapa protein dari keluarga SLC4 (transporter bikarbonat) [ [ 49 ] ], keluarga SLC16 (transporter monokarboksilat) [ [ 50 ] ], keluarga SLC26 (transporter anion kecil) [ [ 51 ] ], keluarga ClC (saluran dan transporter klorida) [ [ 52 ] ], dan keluarga CaCC (saluran klorida yang bergantung pada Ca 2+ ) [ [ 53 ] ]. Mempertimbangkan spesifisitas luas dari inhibitor ini, ada kemungkinan bahwa DIDS menghambat protein tersebut termasuk KCC dengan mengenali dan mengikat residu bermuatan positif di sekitar situs pengikatan anion. Struktur cryo-EM terbaru dari AE1, protein keluarga SLC4 , yang terikat pada DIDS menunjukkan bahwa inhibitor tersebut mungkin tumpang tindih dengan situs pengikatan anion [ [ 54 ] ]. Perlu disebutkan bahwa aktivitas CaCCs [ [ 55 ] ] dan beberapa protein ClC [ [ 56 , 57 ] ] juga diatur oleh Ca 2+ , meskipun apakah hal ini dapat dikaitkan dengan aktivasi Dm KCC oleh Ca 2+ masih belum jelas.
Beberapa kontradiksi yang diamati antara masuknya Rb + yang dimediasi Dm KCC ke dalam sel dan masuknya K + ke dalam proteoliposom sulit dijelaskan. Dalam penelitian ini, bumetanida merupakan penghambat yang efisien di dalam sel tetapi tidak di dalam sistem yang direkonstitusi, dan nitrat mencegah keluarnya K + ke dalam sel tetapi menstimulasinya di dalam proteoliposom. Hal ini dapat disebabkan oleh keadaan Dm KCC yang berbeda di dalam sel dan bentuk yang terisolasi dan/atau aktivasi KCC intrinsik atau NKCC di dalam sel Sf9, yang mengangkut K + keluar dari sel sebagai respons terhadap masuknya Rb + yang dimediasi oleh Dm KCC.
Singkatnya, kami telah mengkarakterisasi KCC murni dari D. melanogaster dan H. vulgaris yang diekspresikan dari kultur sel mamalia dan sel serangga, menunjukkan bahwa Dm KCC, berbeda dengan Hv KCC, memiliki aktivitas transpor K + -Cl − yang dapat dideteksi dengan baik . Kami menetapkan uji protein berbasis sel dan yang direkonstitusi untuk memantau aktivitas protein rekombinan, yang berharga untuk pengendalian kualitas protein transpor ion. Kami juga menunjukkan bahwa Dm KCC memiliki sifat yang sama dengan KCC mamalia, seperti kesamaan residu pengikat ion, keadaan dimerik dari protein murni, dan kemampuan untuk mengangkut Cl − dan K + . Selain itu, aktivitas Dm KCC yang diisolasi ditemukan bergantung pada Ca 2+ dan dihambat oleh penghambat transporter/saluran anion DIDS, yang mengingatkan pada beberapa protein pengangkut klorida, CaCC, dan beberapa ClC.
