Abstrak
Bahasa Indonesia: Meskipun hasil yang menjanjikan dari perangkat plasma non-termal (NTP) untuk terapi kanker, potensi efek samping dari iradiasi NTP masih belum dieksplorasi, termasuk efek pada transisi epitel-mesenkimal (EMT) dan metastasis kanker berikutnya. Dalam studi ini, kami menyelidiki inisiasi dan perkembangan EMT yang diinduksi NTP. Perangkat plasma pelepasan penghalang dielektrik berdenyut mikrodetik digunakan untuk pengobatan NTP, dan membran korioalantoik ayam (CAM) dan spheroid digunakan sebagai model tumor 3D. Pengobatan NTP mengurangi volume tumor dalam model CAM, tetapi pergeseran ke arah fenotipe seperti mesenkimal juga diukur pada tumor melanoma melalui analisis enam biomarker EMT, meskipun perubahan dalam migrasi sel kanker ke organ lain tidak signifikan. Dalam model spheroid, analisis molekuler juga menunjukkan respons EMT setelah pengobatan NTP, dan peningkatan migrasi sel diukur dalam satu lini sel. Induksi EMT dengan NTP bergantung pada dosis dan sementara; pengobatan NTP yang tinggi menyebabkan respons EMT yang signifikan dan peningkatan migrasi, tetapi dosis NTP yang rendah tidak demikian. Temuan kami menyoroti peran penting parameter NTP untuk pengobatan kanker dan respons EMT yang diakibatkannya. Wawasan yang diperoleh di sini selanjutnya membangun fondasi untuk pengoptimalan klinis, memanfaatkan potensi NTP untuk membunuh kanker sekaligus melindungi dari hasil yang tidak diinginkan terkait EMT.
Singkatan
Kamera
membran korioalantoik ayam
EDI
perkembangan embrio
Petugas medis
transisi epitel-mesenkim
FBS
serum janin sapi
FE-DBD
pelepasan penghalang dielektrik elektroda mengambang
GFR
faktor pertumbuhan-dikurangi
NTP
plasma non-termal
PFA
paraformaldehida
Bahasa Inggris
spesies oksigen dan nitrogen reaktif
SEJARAH
kesalahan standar rata-rata
TBS
Penyangga tris salin
1 Pendahuluan
Plasma non-termal (NTP) adalah gas terionisasi sebagian yang dihasilkan pada kondisi atmosfer dan terdiri dari berbagai spesies oksigen dan nitrogen reaktif (RONS) [ [ 1 , 2 ] ]. Karena kapasitas untuk secara lokal menghasilkan dan mengendalikan pengiriman RONS berumur pendek (misalnya, · OH, · NO, O) ke substrat biologis, NTP telah mendapatkan banyak minat untuk beberapa aplikasi biomedis, dengan minat yang meningkat sebagai terapi alternatif atau tambahan untuk kanker [ [ 1 – 4 ] ]. Selama tiga dekade terakhir, penelitian telah menunjukkan hasil yang sangat menjanjikan dalam membunuh sel kanker dengan NTP, menggunakan model in vitro , di mana kemanjuran ditunjukkan pada berbagai jenis kanker. Dalam model hewan, NTP mengurangi beban tumor dan meningkatkan kelangsungan hidup pada tikus, dan dalam studi klinis percontohan, tidak ada efek samping yang merugikan yang signifikan yang didokumentasikan [ [ 5 – 14 ] ].
Meskipun NTP memaparkan target biologis pada berbagai komponen fisik (misalnya, UV, medan listrik/magnetik tinggi), banyak penelitian telah menunjukkan bahwa efek anti-kanker sebagian besar disebabkan oleh pembentukan RONS yang sangat reaktif, terutama H 2 O 2 ,mathematical equationBahasa Indonesia:mathematical equation, · OH, 1 O 2 , O/O 3 , dan · NO, yang dapat menimbulkan respon stres oksidatif [ [ 15 , 16 ] ].
Meskipun potensi anti-kanker NTP melalui induksi stres oksidatif tampak menjanjikan, penelitian ekstensif di bidang biologi redoks, baik dari studi eksperimental maupun klinis, menunjukkan bahwa RONS juga dapat memainkan peran penting dalam mendorong berbagai tahap pembentukan dan perkembangan tumor. Fenomena ini bergantung pada potensi mutagenik dan kemampuan mereka untuk berinteraksi dengan jalur pensinyalan yang mengatur proliferasi sel, motilitas, invasi, dan kelangsungan hidup [ [ 17 , 18 ] ]. Bukti yang meningkat menunjukkan bahwa stres oksidatif memainkan peran penting dalam mendorong invasi dan metastasis sel melalui aktivasi rangsangan yang terkait dengan transisi epitel-mesenkimal (EMT) [ [ 17 ] ], suatu proses morfogenesis yang pertama kali dijelaskan oleh para peneliti yang mempelajari perkembangan embrio dan organ [ [ 19 ] ]. Dualitas EMT ini untuk memainkan peran penting dalam regenerasi jaringan dan metastasis kanker menyebabkan lonjakan terus-menerus dalam perhatian penelitian [ [ 19 ] ]. Dalam konteks kanker, EMT merupakan transisi dari fenotip epitel menuju fenotip mesenkimal di mana sel kanker kehilangan polaritas apikal-basal dan memperoleh sifat yang lebih migrasi dan invasif [ [ 19 , 20 ] ]. Seperti yang tersirat dari namanya, EMT adalah proses transisi di mana sel melewati berbagai keadaan sepanjang spektrum EM sebelum mencapai fenotip mesenkimal penuh, yang juga disebut plastisitas EMT [ [ 21 – 23 ] ]. Akibatnya, hal ini menghasilkan heterogenitas fenotipik yang luas dalam tumor, yang menghasilkan peningkatan kemampuan beradaptasi dan resistensi terhadap terapi, dan memberikan sel kanker keuntungan bertahan hidup [ [ 24 , 25 ] ].
Mengingat hubungan yang mapan antara stres oksidatif dan EMT, kami bertujuan untuk menyelidiki apakah NTP akan memulai transisi ini. Untuk lebih mengisi kesenjangan ini dalam pemahaman mendasar, kami melakukan penyaringan komprehensif dari enam biomarker EMT utama dan mengevaluasi perubahan yang dihasilkan dalam kapasitas migrasi sel pasca-pengobatan NTP. Kami berhipotesis bahwa mengubah parameter pengobatan NTP untuk mengendalikan pengiriman RONS akan memodulasi stres oksidatif yang diinduksi dan respons EMT berikutnya. Dalam penelitian ini, kami menyelidiki efek NTP pada EMT dalam sel melanoma (A375, SK-MEL-28, dan Malme-3M), karena melanoma adalah kanker yang paling mudah diakses untuk pengobatan klinis langsung dengan perangkat NTP medis [ [ 26 – 28 ] ]. Lebih jauh lagi, kami mengevaluasi respons EMT menggunakan dua model kanker 3D: model spheroid in vitro 3D dan model membran korioalantois (CAM) ayam in ovo . Lapisan sel monolapis 2D tradisional sangat terbatas dalam merepresentasikan lingkungan tumor, sedangkan model 3D yang digunakan di sini lebih baik merangkum fenotip tumorigenik esensial termasuk interaksi seluler multidimensi, gradien difusi oksigen dan nutrisi, perkembangan spontan daerah hipoksia, angiogenesis, dan bahkan kapasitas invasif dan metastasis [ [ 29 – 32 ] ]. Hasil kami pada model tumor yang lebih representatif ini menjelaskan sifat respons EMT yang diinduksi NTP. Dalam model CAM, pengobatan NTP 700 Hz menginduksi efek antikanker yang signifikan, sebagaimana dibuktikan dengan berkurangnya berat tumor. Pada pengobatan ini, biomarker EMT dalam tumor menunjukkan ekspresi epitel yang berkurang dan lebih banyak ekspresi mesenkimal. Baik pengobatan NTP dosis rendah (3,52 J) dan tinggi (12,3 J) mengurangi ukuran sferoid, tetapi hanya pengobatan dosis tinggi yang menginduksi pergeseran dinamis menuju ekspresi penanda mesenkimal. Sementara pengobatan NTP tinggi dengan jelas memulai EMT, pengobatan NTP rendah tidak memicu respons seperti itu. Oleh karena itu, studi ini tidak hanya memberikan wawasan penting mengenai kesenjangan mendasar dalam pengetahuan mengenai interaksi NTP-sel, tetapi temuan kami juga menyoroti pentingnya mengoptimalkan parameter pengobatan NTP sebagai keseimbangan antara efek antikanker yang ditimbulkan dan respons EMT. Seiring dengan penerapan klinis teknologi NTP yang terus maju, penting untuk mempertimbangkan dualitas stres oksidatif yang ditimbulkan NTP, dan studi ini mendefinisikan batasan potensial untuk penyempurnaan klinis lebih lanjut.
2 Bahan dan Metode
2.1 Kultur sel
Untuk penelitian ini, tiga lini sel melanoma manusia digunakan: A375 (ATCC, CRL-1619TM; RRID: CVCL_0132), SK-MEL-28 (ATCC, HTB-72; RRID: CVCL_0526) dan Malme-3M (ATCC, HTB-64; RRID: CVCL_1438). Semua lini sel dikultur dalam Dulbecco’s Modified Eagle Medium (DMEM) (Gibco™, Life Technologies, Waltham, MA, AS, 10938-025) yang dilengkapi dengan 10% Fetal Bovine Serum (FBS) (Gibco™, Life Technologies, 10270-106), 100 unit·mL −1 penisilin/streptomisin (Gibco™, Life Technologies, 15140-122) dan 4 m ml -glutamin (Gibco™, Life Technologies, 25030-024). Sel-sel dipertahankan pada suhu 37 °C dalam atmosfer yang dilembabkan dengan 5% CO 2 . Semua lini sel telah diautentikasi menggunakan profil STR setiap tahun, dan semua eksperimen dilakukan dengan sel-sel yang bebas mikoplasma.
2.2 Model bola 3D
Untuk pembuatan spheroid 3D, sel-sel disemai dalam pelat 96-well dengan perlekatan sangat rendah (Corning BV Life Sciences, Amsterdam, NL, 7007). Spheroid dibuat dengan 5000 sel per well untuk SK-MEL-28 dan 7000 sel per well untuk Malme-3M dan ditambah dengan 2% GFR Matrigel (Corning BV Life Sciences, 354-230). Konsentrasi penyemaian yang berbeda digunakan untuk lini sel yang berbeda untuk mendapatkan spheroid dengan diameter sekitar 500 μm pada awal percobaan. Untuk lini sel A375, tidak ada spheroid yang dapat dihasilkan karena ketidakmampuan lini sel ini untuk membentuk bola-bola kompak. Setelah penyemaian, spheroid disentrifugasi pada 200 g selama 10 menit pada suhu 4 °C. Selanjutnya, mereka diinkubasi selama 3 hari pada suhu 37 °C dalam inkubator yang dilembabkan dengan 5% CO2 sebelum digunakan dalam percobaan. Untuk setiap percobaan independen, lima spheroid dibuat dan dialokasikan per kondisi percobaan. Kelima spheroid ini digunakan untuk mengkompensasi potensi hilangnya spheroid selama penanganan dan pemindahan sehingga minimal tiga spheroid per kondisi percobaan dianalisis.
2.3 3D CAM dalam model ovo
Telur ayam leghorn yang dibuahi (Kwekerij Wyverkens, Halle, BE) (hari ke-4 perkembangan embrio (ED)) diinkubasi dalam posisi horizontal pada suhu 37 °C dan kelembapan 65% dalam inkubator telur dengan fungsi putar otomatis (Ova-Easy 100, Brinsea, Veenendaal, NL). Pada hari ke-5 ED, kutub atas telur didisinfeksi dan ditusuk dengan jarum steril 20G (BD, Franklin Lakes, NJ, AS) setelah itu ditutup dengan selotip medis (Leukosilk S, Covamed Farma BVBA, Marke, BE). Setelah ditusuk, telur diletakkan dalam posisi vertikal dalam inkubator telur (fungsi mati) untuk mempercepat relokasi ruang udara ke kutub atas. Pada hari ke-7 ED, kutub atas telur dipotong untuk mengekspos CAM, dan kertas saring 1 × 1 mm yang direndam dalam dietil eter dioleskan sebentar pada daerah vaskular di CAM. Pada daerah ini, cincin silikon steril (ID = 5 mm, OD = 6 mm) dipasang pada CAM dan 2 × 106 sel untuk A375 dan SK-MEL-28 atau 6 × 106 sel untuk Malme-3M, dicampur dengan 15 μL Matrigel yang direduksi faktor pertumbuhan (GFR), dimasukkan ke dalam cincin. Telur disegel dengan Tegaderm (3D) dan ditempatkan kembali dalam inkubator selama 4 hari. Pada hari ke-11 ED, Tegaderm dipotong dan tumor diobati dengan NTP langsung atau induser EMT. Untuk induser EMT, cincin plastik steril kedua (ID = 7 mm, OD = 8,5 mm) ditempatkan di sekitar cincin pertama dan 20 μL Suplemen Media Induksi EMT StemXVivo (100×) (Biotechne, Minneapolis, MN, AS, CCM017) dimasukkan ke dalam cincin tersebut. Suplemen EMT ini mengandung protein berkualitas premium berikut dan antibodi penetral berkinerja tinggi untuk menginduksi EMT: Wnt-5a Manusia Rekombinan, TGF-β1 Manusia Rekombinan, Anti-E-kadherin Manusia, Anti-sFRP-1 Manusia, dan Anti-Dkk-1 Manusia. Telur disegel dengan Tegaderm dan diinkubasi hingga akhir percobaan. Pada hari ke-14 ED, tumor diangkat dan ditimbang pada neraca presisi (Mettler Toledo, Fischer, Merelbeke, BE) setelah itu embrio ayam dibedah lebih lanjut untuk mengumpulkan hati, paru-paru, dan bagian bawah CAM untuk analisis lebih lanjut. Semua langkah di luar inkubator dilakukan menggunakan blok panas (diatur pada 37 °C) dengan adaptor aluminium berbentuk telur yang dibuat khusus. Untuk setiap percobaan independen, tujuh telur dialokasikan per kondisi percobaan. Tidak setiap telur berhasil mengembangkan tumor, dan secara umum, lima tumor dikumpulkan per kondisi untuk analisis di akhir percobaan. Percobaan yang disajikan di sini dihentikan pada hari ke-14 perkembangan embrio ayam, dan dengan demikian tinjauan dan persetujuan etika diabaikan untuk penelitian ini, karena menurut peraturan Eropa, hanya percobaan pada embrio ayam yang dihentikan setelah hari ke-15 perkembangan yang perlu dideklarasikan.
2.4 Pengobatan NTP
Kami menggunakan sistem plasma dielectric barrier discharge (FE-DBD) elektroda mengambang berdenyut mikrodetik, yang dijelaskan sebelumnya secara rinci [ [ 33 , 34 ] ], untuk menghasilkan NTP dengan pulsa 30 kV, waktu kenaikan 1–1,5 μs, dan lebar pulsa 2 μs. Untuk perawatan spheroid, setiap spheroid ditransfer ke pelat 96-sumur kosong dalam 3 μL media sebelum perawatan (Gbr. 1 ). Celah antara elektroda dan spheroid ditetapkan pada jarak 1 mm menggunakan z-positioner, setelah itu NTP dilepaskan langsung pada sel selama 10 detik pada berbagai frekuensi, berkisar antara 100 dan 700 Hz. Energi per denyut dari setiap pelepasan NTP sebelumnya diukur dan dilaporkan (1,76 ± 1,15 mJ per denyut) [ [ 33 , 34 ] ], dan oleh karena itu, total dosis energi perawatan berkisar antara 1,76 hingga 12,3 J. Karena frekuensi perawatan NTP adalah satu-satunya parameter variabel dan kami bertujuan untuk menjaga semua parameter lain tetap konstan, kami menampilkan dosis perawatan NTP sebagai frekuensi. Selain itu, perlu juga dicatat bahwa sementara kami bertujuan untuk menjaga jarak aplikasi tetap konstan, ini jauh lebih sulit untuk spheroid 3D dan model CAM dibandingkan dengan lapisan sel tunggal 2D, yang dapat memengaruhi total dosis energi perawatan. Jadi kami yakin representasi paling akurat dari dosis perawatan NTP kami adalah dengan menyediakan, secara rinci, parameter yang digunakan untuk perawatan, meskipun untuk ringkas, itu dilaporkan sebagai frekuensi perawatan di bagian Hasil.
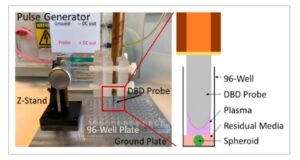
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
Sistem plasma debit penghalang dielektrik elektroda mengambang berdenyut mikrodetik (FE-DBD) digunakan dalam penelitian ini untuk perawatan plasma nontermal (NTP). Sferoid dipindahkan ke pelat 96-sumur kosong dalam 3 μL media untuk perawatan NTP.
Segera setelah perawatan, 100 μL medium kultur sel segar diisi ulang ke dalam sumur. Untuk perawatan tumor in ovo , celah antara elektroda dan tumor ditetapkan pada jarak sekitar 2–4 mm. Pemasangan pada jarak yang tepat tidak memungkinkan untuk model ini karena ukuran telur yang bervariasi dan gerakan embrio yang sesekali terjadi. NTP dilepaskan langsung ke tumor selama 10 detik pada 700 Hz, setelah itu telur ditutup kembali. Sebagai kontrol positif untuk induksi EMT, Suplemen Media Induksi EMT StemXVivo, yang kemudian disebut sebagai suplemen EMT, digunakan.
2.5 Imunofluoresensi pada spheroid 3D dan tumor in ovo
Untuk menilai beberapa biomarker EMT kunci, pewarnaan imunofluoresens dilakukan pada spheroid 3D dan tumor yang dikumpulkan dari model in ovo . Spheroid dikumpulkan 1, 4, dan 7 hari setelah pengobatan NTP dan difiksasi semalam dalam 4% paraformaldehida (PFA) pada 4 °C. Spheroid yang difiksasi dipindahkan ke cetakan multiarray dari 4% agarosa, setelah itu mereka didehidrasi dan ditanamkan dalam parafin semalam. Tumor in ovo dikumpulkan 3 hari setelah pengobatan NTP dan difiksasi dengan 4% PFA pada suhu kamar sebelum dehidrasi dan penanaman parafin. Untuk spheroid yang tertanam dan tumor in ovo , potongan berukuran 5 μm dipotong. Slide dideparafinisasi dan dihidrasi ulang, setelah itu pengambilan antigen dilakukan menggunakan buffer sitrat (10 mm , pH 6) selama 20 menit pada 96 °C. Setelah pendinginan selama 30 menit, slide dicuci dua kali dalam larutan penyangga Tris dengan 2,5% Triton X-100 (TBS) selama 5 menit. Selanjutnya, slide diblokir selama 2 jam dengan TBS yang mengandung 10% serum kambing (Abcam, Cambridge, Inggris, ab7481) untuk pewarnaan vimentin dan ZEB1, atau dengan 10% serum keledai (Abcam, ab7475) untuk pewarnaan E-kadherin, N-kadherin, SNA1, dan Twist. Setelah pemblokiran, antibodi primer diaplikasikan, diencerkan dalam TBS yang mengandung 1% serum kambing atau keledai, tergantung pada antibodinya, dan diinkubasi semalaman pada suhu 4 °C. Antibodi primer berikut digunakan: E-kadherin (Abcam, ab76055, 1 : 200), N-kadherin (Thermo Fisher, Waltham, MA, AS, MA5-15633, 1 : 200), Vimentin (Abcam, ab92547, 1 : 500), SNAI1 (Santa Cruz Biotechnology, Dallas, TX, AS, sc-271977, 1 : 100), ZEB1 (Abcam, ab203829, 1 : 250) dan Twist (Abcam, ab175430, 1 : 200). Keesokan harinya, slide dicuci dua kali dalam TBS dan diinkubasi dengan antibodi sekunder dalam gelap selama 1 jam pada suhu kamar. Antibodi sekunder berikut digunakan: Goat Anti-Rabbit IgG (H + L) Alexa Fluor 488 (Abcam, ab150077) dan Donkey Anti-Mouse IgG (H + L) Highly Cross-adsorbed Alexa Fluor 594 (Thermo Fisher, A21203). Slide untuk vimentin dan ZEB1 juga diputihkan secara kimia dengan Sudan Black B dalam etanol 70% selama 30 menit untuk mengurangi autofluoresensi, setelah itu slide dicuci tiga kali dalam TBS. Semua slide dipasang dengan media pemasangan antifade VECTASHIELD HardSet dengan DAPI (Vectorlabs, Burlingame, CA, AS). Intensitas fluoresensi rata-rata dianalisis menggunakan perangkat lunak imagej (National Institute of Health, Bethesda, MD, AS). Baik DAPI dan Alexa Fluor 488 atau Alexa Fluor 594 diukur, tergantung pada antibodi sekunder yang digunakan. Pewarnaan DAPI digunakan untuk menormalkan intensitas fluoresensi untuk setiap slide. Mengenai in ovobagian, perbedaan dibuat antara sel ayam dan sel manusia, dan analisis hanya dilakukan pada sel manusia. Mengenai spheroid, beberapa spheroid dikumpulkan dan dipotong dalam satu blok parafin tunggal, dan seluruh bagian spheroid dianalisis. Karena setiap spheroid hanya berdiameter 500 μm, tidak mungkin untuk memotong pada kedalaman yang sama. Sebaliknya, 20 bagian spheroid dikumpulkan dari blok parafin, dan bagian spheroid terbesar digunakan untuk pewarnaan untuk juga mencakup daerah spheroid yang lebih dalam [ [ 35 ] ].
2.6 Migrasi Sferoid
Bahasa Indonesia: Untuk mengevaluasi migrasi sel dengan cara yang lebih fungsional, uji migrasi spheroid dilakukan. Dalam uji ini, spheroid yang diobati segera dipindahkan ke pelat 96-well berlapis kolagen dalam medium 300 μL yang dikurangi faktor pertumbuhan (2% FBS, bukan 10% FBS). Spheroid diinkubasi selama 30 menit agar dapat menempel pada permukaan yang dilapisi sebelum memulai pencitraan. Untuk menyelidiki migrasi sel keluar dari spheroid, gambar dikumpulkan setiap 4 jam selama 3 hari menggunakan Tecan Spark Cyto 600 (Tecan, Männedorf, Swiss). Gambar-gambar ini kemudian dianalisis menggunakan perangkat lunak orbits oncology (Orbits Oncology Inc, Palo Alto, CA, AS) [ [ 35 , 36 ] ].
2.7 Isolasi RNA dan konversi cDNA
Untuk mengisolasi RNA dari hati, paru-paru, dan CAM bagian bawah embrio ayam, RNeasy Plus Mini Kit (Qiagen, Hilden, DE, Jerman, 74034) digunakan sesuai dengan petunjuk pabrik pembuatnya. RNA kemudian diukur menggunakan Qubit 4 Fluorometer, kemudian konversi cDNA dilakukan menggunakan Superscript II Reverse Transcriptase (Thermo Fisher, 18061-022) sesuai dengan petunjuk pabrik pembuatnya.
2.8 PCR waktu nyata
Amplifikasi cDNA dilakukan menggunakan uji GoTaq Flexi DNA Polymerase (Promega, Madison, WI, AS, M829B) dengan Techne Prime Thermal Cycler. Kondisi berikut digunakan selama PCR: 95 °C selama 2 menit, 35 siklus: 95 °C selama 0,5 menit, 60 °C selama 0,5 menit, dan 72 °C selama 1 menit; 72 °C selama 5 menit. Gen referensi kandidat berikut dinilai: B2M, HMBS, ALTB, TBP, SDHA, YQHAZ, dan UBC. Gen referensi β-2 microglobulin (B2M, GeneID: 567) digunakan untuk melakukan priming cDNA manusia secara selektif. Kuantifikasi relatif dilakukan menggunakan perangkat lunak imagej .
2.9 Analisis statistik
Untuk setiap pengujian, tiga eksperimen independen dilakukan dengan sedikitnya 3–7 replikasi independen, tergantung pada komplikasi model atau penanganan. Semua perbedaan statistik dianalisis menggunakan model campuran linier dengan jmp pro 13 (Perangkat Lunak SAS, Cary, NC, AS) untuk menguji efek tetap sambil memperhitungkan efek acak dan interaksi karena variabilitas biologis dan eksperimental. Ketika perbedaan signifikan terdeteksi, uji Dunnett post hoc dilakukan untuk menghitung nilai P yang disesuaikan dibandingkan dengan kontrol. Nilai P < 0,05 dianggap signifikan secara statistik. Data dalam semua grafik direpresentasikan sebagai mean ± standard error of the mean (SEM); jumlah eksperimen independen dan replikasi ditunjukkan dalam legenda, dan semua gambar disiapkan dalam graphpad prism (GraphPad Prism 10.0.1, GraphPad Prism Software, Inc., Boston, MA, AS).
3 Hasil
3.1 Investigasi biomarker EMT utama setelah pengobatan NTP dalam model 3D CAM in ovo
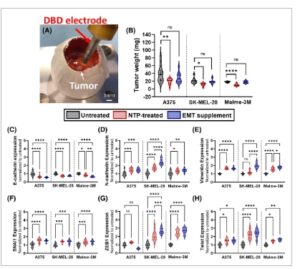
EMT adalah proses seluler multifaset yang kompleks yang melibatkan perubahan dalam ekspresi dan fisiologi protein seluler, yang mengakibatkan hilangnya karakteristik epitel dan perolehan sifat mesenkimal [ [ 17 ] ]. Untuk mengevaluasi dampak awal NTP pada perkembangan EMT, kami menilai ekspresi biomarker EMT utama setelah pengobatan NTP dalam model 3D chicken CAM in ovo . Model ini menyediakan lingkungan seperti in vivo yang sangat menyerupai kondisi fisiologis (misalnya, matriks ekstraseluler, interaksi sel 3D, angiogenesis, daerah hipoksia). Fitur-fitur ini menjadikannya model praklinis yang sangat baik untuk mempelajari metastasis kanker dalam waktu yang jauh lebih singkat dibandingkan dengan model murine (14 hari, bukan 4–10 minggu) [ [ 37 ] ]. Tumor padat tumbuh di atas CAM (Gbr. 2A ), setelah itu diobati dengan NTP (700 Hz, 10 detik). Tiga hari setelah pengobatan, tumor dikumpulkan, ditimbang, difiksasi, dan ditanamkan dalam parafin untuk dipotong. Perawatan NTP 700 Hz menginduksi respons sitotoksik pada ketiga lini sel melanoma, sebagaimana dibuktikan oleh pengurangan signifikan pada berat tumor jika dibandingkan dengan tumor yang tidak diobati (Gbr. 2B ). Pewarnaan imunofluoresensi pada irisan tumor digunakan untuk memeriksa ekspresi biomarker EMT. Salah satu ciri terpenting EMT adalah apa yang disebut ‘saklar kadherin’, yang diwakili oleh penurunan regulasi E-kadherin dan peningkatan regulasi N-kadherin pada permukaan membran sel [ [ 22 , 38 ] ]. E-kadherin adalah salah satu molekul terpenting yang mengatur adhesi sel-ke-sel dalam jaringan epitel, dan N-kadherin memberi sel tumor kapasitas migrasi dan invasif yang ditingkatkan. Hasil kami menunjukkan bahwa pengobatan NTP menurunkan ekspresi E-kadherin di ketiga lini sel: A375 (perubahan 0,64 ± 0,04 kali lipat, P ≤ 0,0001), SK-MEL-28 (perubahan 0,72 ± 0,02 kali lipat, P ≤ 0,0001) dan Malme-3M (0,83 ± 0,03, P = 0,0121) (Gbr. 2C ). Sebaliknya, ekspresi N-kadherin meningkat di ketiga lini sel: A375 (perubahan 1,46 ± 0,06 kali lipat, P = 0,0002), SK-MEL-28 (perubahan 1,71 ± 0,06 kali lipat, P ≤ 0,0001) dan Malme-3M (perubahan 1,32 ± 0,05 kali lipat, P = 0,0250) (Gbr. 2D ). Transisi dinamis ini sejalan dengan kontrol positif, suplemen pemicu EMT, yang menunjukkan bahwa NTP memang mendorong EMT.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Respons transisi epitel-mesenkimal (EMT) yang diinduksi plasma non-termal (NTP) pada tumor yang dikumpulkan dari membran korioalantois (CAM) ayam dalam model ovo. (A) Gambar yang menunjukkan pengobatan NTP pada tumor yang dicangkok di atas CAM. Skala batang adalah 3 mm. (B) Pengobatan NTP pada 700 Hz menginduksi respons antikanker seperti yang terlihat pada pengurangan berat tumor. (C–H) Hasil dari pewarnaan imunofluoresensi dari enam biomarker EMT utama ((C) E-kadherin, (D) N-kadherin, (E) Vimentin, (F) SNAI1, (G) Twist, dan (H) ZEB1) pada potongan tumor yang dikumpulkan dari CAM dalam model ovo. Suplemen yang menginduksi EMT digunakan sebagai kontrol positif. Hasilnya dinormalisasi ke sampel yang tidak diobati dari setiap lini sel melanoma. Data direpresentasikan sebagai mean ± SEM dari tiga eksperimen independen dengan 3–5 replikasi per eksperimen, sebagaimana direpresentasikan oleh setiap titik data individual dalam grafik. (C–H) Data pada semua grafik dinormalisasi ke kontrol yang tidak diobati ( sumbu y ). DBD, pelepasan penghalang dielektrik; EMT, transisi epitel-mesenkimal; NTP, plasma nontermal. Signifikansi statistik dihitung menggunakan model campuran linier umum. * P ≤ 0,05, ** P ≤ 0,01, *** P ≤ 0,001, **** P ≤ 0,0001.
Meskipun peralihan kadherin merupakan ciri penting EMT, hal ini saja tidak cukup untuk memicu perubahan terkait EMT dalam motilitas sel, dan modulasi penanda lain diperlukan. Vimentin, filamen intermediet tipe III yang sebagian besar ditemukan dalam sel mesenkimal, juga terbukti menjadi indikator yang sangat baik untuk EMT, karena diketahui dapat menjaga integritas sel dan memberikan ketahanan terhadap stres mekanis melalui kerangka viskoelastis [ [ 20 , 22 ] ]. Oleh karena itu, peningkatan ekspresi vimentin mendorong migrasi sel kanker [ [ 20 ] ]. Analisis ekspresi vimentin menunjukkan peningkatan regulasi untuk A375 (perubahan 1,68 ± 0,04 kali lipat, P ≤ 0,0001) dan Malme-3M (perubahan 1,56 ± 0,05 kali lipat, P ≤ 0,0001), tetapi tidak untuk SK-MEL-28, meskipun tren peningkatan telah dicatat (Gbr. 2E ). Perilaku ini juga sejalan dengan hasil yang diperoleh dengan menggunakan suplemen EMT, yang selanjutnya mendukung hipotesis bahwa NTP meningkatkan EMT.
Terakhir, kami menyelidiki beberapa faktor transkripsi yang mengatur EMT, yaitu dari keluarga Snail, ZEB, dan Twist [ [ 39 ] ]. Secara keseluruhan mereka bertindak untuk menekan ekspresi penanda epitel seperti E-kadherin, serta mengaktifkan penanda mesenkimal di antaranya adalah N-kadherin dan vimentin. Secara umum, Snail, juga dikenal sebagai SNAI1, terutama dikenal sebagai penginduksi utama EMT dengan secara langsung mengatur ekspresi E-kadherin dan vimentin dan juga merangsang aktivasi Twist dan ZEB1, yang terlibat dalam menegakkan fenotip mesenkimal [ [ 19 ] ]. Mengenai SNAI1, kami mengamati peningkatan ekspresi untuk ketiga lini sel: A375 (perubahan 1,53 ± 0,07 kali lipat, P ≤ 0,0001), SK-MEL-28 (perubahan 1,40 ± 0,04 kali lipat, P = 0,0007), dan Malme-3M (perubahan 1,35 ± 0,05 kali lipat, P = 0,0002). Ekspresi ini sebanding dengan suplemen penginduksi EMT (Gbr. 2F ). Lebih jauh lagi, sementara tumor A375 hanya menunjukkan peningkatan regulasi untuk ekspresi Twist (perubahan 1,47 ± 0,08 kali lipat, P = 0,0254), baik ekspresi Twist maupun ZEB meningkat regulasinya untuk tumor SK-MEL-28 (Twist: perubahan 2,3 ± 0,1 kali lipat, P ≤ 0,0001; ZEB1: perubahan 2,0 ± 0,1 kali lipat, P ≤ 0,0001) dan tumor Malme-3M (Twist: perubahan 1,40 ± 0,05 kali lipat, P = 0,0144; ZEB1: perubahan 2,4 ± 0,1 kali lipat, P ≤ 0,0001) (Gbr. 2G,H ). Karena faktor transkripsi ini sering ditemukan diekspresikan bersamaan dalam kombinasi yang berbeda selama EMT, tidak adanya salah satu dari faktor-faktor ini tidak selalu berarti bahwa EMT tidak terjadi [ [ 22 , 40 ] ].
Secara keseluruhan, temuan-temuan ini menunjukkan bahwa pengobatan NTP memicu respons EMT, sebagaimana dibuktikan oleh aktivasi sakelar kadherin, peningkatan regulasi vimentin, dan aktivasi tiga faktor transkripsi EMT utama. Meskipun demikian, perlu dicatat bahwa temuan-temuan ini hanya mewakili satu titik waktu setelah pengobatan NTP, sedangkan EMT adalah proses dinamis yang bertransisi melalui berbagai fase hibrida sebelum mencapai fenotipe mesenkimal sepenuhnya. Selama fase-fase hibrida ini, sel-sel juga dapat pulih dan kembali ke keadaan epitel awal sebelum menjadi mesenkimal sepenuhnya [ [ 21 ] ]. Untuk menyelidiki lebih lanjut perkembangan proses EMT, kami melihat titik-titik waktu selanjutnya menggunakan model sferoid 3D, karena model CAM dibatasi hingga batas 14 hari karena pertimbangan etika.
3.2 Investigasi perkembangan EMT dan ketergantungan dosis NTP dalam model spheroid 3D
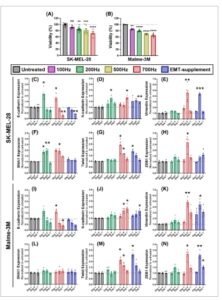
Untuk memeriksa perkembangan EMT lebih lanjut, kami mengevaluasi ekspresi enam biomarker pada hari ke-1, ke-4, dan ke-7 setelah pengobatan NTP pada spheroid melanoma. Untuk percobaan ini, hanya lini sel SK-MEL-28 dan Malme-3M yang digunakan, karena sel A375 tidak membentuk spheroid yang rapat. Pengobatan NTP mampu mengurangi viabilitas spheroid secara signifikan, baik pada pengobatan NTP dosis rendah (200 Hz, 3,52 J) maupun pengobatan NTP dosis tinggi (700 Hz, 12,3 J) (Gbr. 3A,B ).
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Respons transisi epitel-mesenkimal (EMT) yang diinduksi plasma non-termal (NTP) pada spheroid melanoma 3D. (A) Respons sitotoksik dari berbagai dosis NTP pada spheroid SK-MEL-28 yang berkisar dari 100 Hz (1,76 J) hingga 700 Hz (12,3 J). (B) Respons sitotoksik dari berbagai dosis NTP pada spheroid Malme-3M. (C–H) Hasil pewarnaan imunofluoresensi dari enam biomarker EMT utama ((C) E-kadherin, (D) N-kadherin, (E) Vimentin, (F) SNAI1, (G) Twist, dan (H) ZEB1) pada spheroid SK-MEL-28 yang membandingkan pengobatan NTP dosis rendah (200 Hz) dan dosis tinggi (700 Hz). Sebagai kontrol positif, suplemen penginduksi EMT digunakan. (I–N) Hasil dari pewarnaan imunofluoresensi enam biomarker EMT utama ((I) E-kadherin, (J) N-kadherin, (K) Vimentin, (L) SNAI1, (M) Twist, dan (N) ZEB1) dalam sferoid Malme-3M. Hasil dari (C–N) dinormalisasi ke sampel yang tidak diobati pada titik waktu yang sama, dan perubahan dalam ekspresi dinilai dengan menghitung signifikansi statistik antara sampel yang diobati dan sampel yang tidak diobati dari titik waktu yang sama. Sampel yang tidak diobati digunakan untuk menunjukkan ekspresi dasar pada setiap titik waktu. Data direpresentasikan sebagai mean ± SEM dari tiga eksperimen independen dengan 3–5 replikasi per eksperimen. (C–N) Data pada semua grafik dinormalisasi ke kontrol yang tidak diobati (sumbu y ) untuk hari ke-1, ke-4, dan ke-7 ( sumbu x ). EMT, transisi epitel-mesenkimal. Signifikansi statistik antara sampel yang diberi perlakuan dan sampel yang tidak diberi perlakuan dari titik waktu yang sama dihitung menggunakan model campuran linier umum. * P ≤ 0,05, ** P ≤ 0,01, *** P ≤ 0,001.
Berdasarkan analisis kadherin, yang menarik, terdapat lonjakan awal dalam ekspresi E-kadherin pada hari ke-1 untuk kedua perlakuan NTP pada sferoid SK-MEL-28 (perlakuan 200 Hz: perubahan 2,2 ± 0,2 kali lipat, P = 0,0481; perlakuan 700 Hz: perubahan 1,8 ± 0,2 kali lipat, P = 0,0469) (Gbr. 3C ), dan untuk perlakuan 700 Hz pada sferoid Malme-3M (perubahan 1,6 ± 0,1 kali lipat, P = 0,0193) (Gbr. 3I ), yang menunjukkan peningkatan dalam adhesi sel. Namun, pada hari ke-4, ekspresi tersebut menurun dan selaras dengan sampel yang tidak diobati. Pada hari ke-7, penurunan regulasi E-kadherin yang kuat diamati pada kedua lini sel untuk pengobatan NTP dosis tinggi (0,31 ± 0,07 untuk SK-MEL-28, P = 0,0013, dan 0,4 ± 0,1 untuk Malme-3M, P = 0,0241); sedangkan, meskipun ada tren menurun, tidak ada penurunan regulasi E-kadherin yang signifikan yang diamati untuk dosis NTP rendah.
Ekspresi N-kadherin meningkat untuk pengobatan NTP dosis tinggi pada hari ke-7 untuk sferoid SK-MEL-28 (perubahan 1,8 ± 0,1 kali lipat, P = 0,0156) (Gbr. 3D ) dan untuk sferoid Malme-3M (perubahan 1,8 ± 0,2 kali lipat, P = 0,0440) (Gbr. 3J ). Namun, pengobatan NTP dosis rendah tidak mengubah ekspresi N-kadherin secara signifikan.
Hanya pengobatan NTP dosis tinggi yang menginduksi peningkatan ekspresi vimentin pada hari ke-4 untuk kedua lini sel (perubahan 4,6 ± 0,5 kali lipat untuk SK-MEL-28, P = 0,0029; perubahan 4,9 ± 0,4 kali lipat untuk Malme-3M, P = 0,0059) (Gbr. 3E,K ). Menariknya, ekspresi menurun lagi pada hari ke-7 dan, untuk SK-MEL-28, bahkan sepenuhnya kembali ke tingkat dasar. Mirip dengan pergantian kadherin, pengobatan NTP dosis rendah memiliki dampak yang dapat diabaikan pada ekspresi vimentin.
Terakhir, kami memeriksa ekspresi dari tiga faktor transkripsi EMT. Ekspresi SNAI1 sudah meningkat 1 hari pasca-perlakuan NTP untuk spheroid SK-MEL-28, baik pada perlakuan NTP dosis rendah (perubahan 1,85 ± 0,08 kali lipat, P = 0,0127) dan perlakuan NTP dosis tinggi (2,00 ± 0,07, P = 0,0061), yang sedikit menurun lagi pada hari ke-7 (Gbr. 3F ). Namun, tidak ada perlakuan NTP yang berdampak pada ekspresi SNAI1 dalam spheroid Malme-3M (Gbr. 3L ). Untuk Twist dan ZEB1, kedua lini sel merespons perlakuan NTP dengan cara yang sama. Lebih khusus lagi, hanya pengobatan NTP dosis tinggi yang memengaruhi ekspresi Twist, dengan peningkatan regulasi tertinggi pada hari ke-1 (perubahan 2,4 ± 0,3 kali lipat untuk SK-MEL-28, P = 0,0481 dan 2,1 ± 0,2 untuk Malme-3M, P = 0,0373), diikuti oleh pengembalian bertahap ke tingkat dasar pada hari ke-7 (Gbr. 3G,M ). Lebih jauh lagi, ekspresi ZEB1 meningkat pada hari ke-4 setelah pengobatan NTP dosis tinggi pada kedua spheroid (perubahan 2,7 ± 0,3 kali lipat untuk SK-MEL-28, P = 0,0478, dan perubahan 2,7 ± 0,2 kali lipat untuk Malme-3M, P = 0,0159) (Gbr. 3H,N ). Mirip dengan Twist, efek ini berkurang kembali ke tingkat dasar pada hari ke-7.
Secara keseluruhan, hasil ini menunjukkan bahwa pengobatan NTP dosis tinggi memicu respons EMT, sebagaimana dibuktikan oleh aktivasi sakelar kadherin, peningkatan regulasi vimentin, dan aktivasi tiga faktor transkripsi EMT utama. Namun, respons ini tampaknya bersifat sementara, dan sebagian besar biomarker yang kami selidiki kembali ke tingkat dasar pada hari ke-7, yang menunjukkan EMT parsial alih-alih mencapai fenotipe mesenkimal sepenuhnya. Sebaliknya, sementara pengobatan NTP dosis rendah menginduksi respons sitotoksik, pengobatan tersebut tidak memicu respons untuk sebagian besar biomarker EMT, yang menunjukkan bahwa penggunaan dosis pengobatan NTP yang lebih rendah dapat menghindari masalah ini dan lebih menarik dari perspektif klinis.
3.3 Evaluasi fungsional sifat EMT pasca pengobatan NTP pada kedua model melanoma 3D
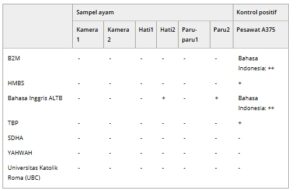
Padahal ekspresi biomarker EMT kunci adalah indikator berharga dari perkembangan EMT, mendefinisikan EMT secara eksklusif berdasarkan penanda molekuler kurang menggambarkan kompleksitas dan plastisitas EMT yang sangat besar [ [ 22 ] ]. Untuk melengkapi data ini, kami melakukan uji fungsional untuk menyelidiki apakah EMT yang diinduksi NTP dapat meningkatkan kapasitas migrasi sel kanker. Dalam model CAM in ovo , kami mengumpulkan beberapa organ dari embrio ayam untuk memeriksa metastasis tumor dari CAM setelah perawatan. Hati, paru-paru, dan bagian terendah CAM (terjauh dari lokasi tumor) dikumpulkan segera setelah pengangkatan tumor, dan RNA diisolasi. Menggunakan RT-PCR, keberadaan RNA manusia dalam organ embrio ayam diselidiki untuk mengidentifikasi apakah sel melanoma manusia memiliki metastasis dari tumor primer. Organ dari telur tanpa tumor digunakan untuk menguji delapan primer untuk reaktivitas silang dengan sel ayam, yaitu B2M, HMBS, ALTB, TBP, SDHA, YWHAZ, dan UBC. Dari semuanya, hanya B2M, TBP, dan HMBS yang memberikan hasil positif untuk sampel kontrol manusia tanpa menunjukkan reaktivitas terhadap sampel ayam (Tabel 1 ). Karena B2M memberikan sinyal paling terang, kami melanjutkan dengan primer ini.
Tabel 1. Uji reaktivitas silang primer PCR.
Secara total, kami mengumpulkan sampel dari enam telur per kondisi untuk setiap lini sel. Hasil kami menunjukkan bahwa bahkan untuk tumor yang tidak diobati, RNA manusia hadir di sebagian besar sampel (Gbr. 4A ), yang menunjukkan kapasitas migrasi sel melanoma yang tinggi. Karena variasi besar dalam replikasi, tidak ada perbedaan statistik yang ditemukan; meskipun berdasarkan peta panas (Gbr. 4A ), beberapa tren di ketiga lini sel diamati. Misalnya, dalam sampel dari paru-paru dan CAM yang lebih rendah, lebih banyak RNA manusia tampaknya terdeteksi dalam sampel yang diobati dengan NTP dibandingkan dengan sampel yang tidak diobati. Tampaknya juga sampel hati mengandung lebih sedikit RNA manusia dibandingkan dengan sampel paru-paru dan CAM yang lebih rendah untuk ketiga lini sel. Secara keseluruhan, data ini menggambarkan bahwa sel-sel melanoma dapat bermigrasi menjauh dari tumor primer di atas CAM dan ke dalam embrio ayam. Lebih jauh, meskipun tidak signifikan secara statistik, tampaknya tumor melanoma yang diobati dengan NTP menunjukkan peningkatan kapasitas migrasi, yang mendukung temuan molekuler kami (Gbr. 2 ).
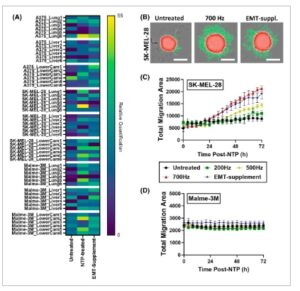
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Uji fungsional untuk menyelidiki peningkatan migrasi pasca perawatan plasma nontermal (NTP). (A) Peta panas yang menunjukkan keberadaan RNA manusia di berbagai organ embrio ayam, yang menunjukkan metastasis dari lokasi tumor primer. Model campuran linier umum digunakan dan tidak mengungkapkan perbedaan statistik dalam RNA manusia antara berbagai kondisi. (B) Representasi analisis untuk perangkat lunak migrasi sferoid 3D, dianalisis oleh perangkat lunak analisis orbit . Masking merah mewakili sferoid dan masking hijau mewakili area migrasi keluar dari sferoid. Gambar diambil pada 4x pada Tecan Spark Cyto 600. Skala batang mewakili 500 μm. (C, D) Hasil dari uji migrasi sferoid 3D untuk (C) SK-MEL-28 dan (D) Malme-3M. Sebagai kontrol positif, suplemen penginduksi transisi epitel-mesenkimal (EMT) digunakan. Tidak ada uji statistik yang dilakukan untuk eksperimen kinetik ini, karena perbedaannya dapat diabaikan. EMT, transisi epitel-mesenkimal; NTP, plasma nontermal. Data direpresentasikan sebagai rerata ± SEM dari tiga eksperimen independen dengan 3–5 replikasi per eksperimen.
Untuk memeriksa kapasitas migrasi dalam model spheroid 3D, kami melakukan uji migrasi 3D dengan mentransfer spheroid ke pelat berlapis kolagen segera setelah perawatan NTP, setelah itu spheroid dipantau dengan pencitraan sel hidup setiap 4 jam selama 3 hari. Analisis dilakukan menggunakan perangkat lunak analisis Orbits Oncology, yang mengenali dan menghitung area sel tumor yang bermigrasi (Gbr. 4B ) [ [ 36 ] ]. Untuk spheroid SK-MEL-28, peningkatan substansial dalam migrasi diamati untuk perawatan NTP dosis tinggi, sebanding dengan kontrol positif, suplemen EMT (Gbr. 4C ). Menariknya, spheroid yang dirawat NTP dosis rendah tidak menunjukkan peningkatan migrasi, yang sejalan dengan temuan molekuler kami (Gbr. 3 ). Baik perawatan NTP maupun kontrol positif tidak menginduksi perubahan dalam migrasi spheroid Malme-3M (Gbr. 4D ). Mengingat bahwa uji migrasi 3D memerlukan beberapa langkah transfer, masuk akal bahwa percobaan tersebut menyebabkan tekanan substansial pada spheroid Malme-3M, yang relatif kurang padat dibandingkan dengan spheroid SK-MEL-28. Oleh karena itu, kami berhati-hati dalam penilaian kami terhadap induksi EMT pada spheroid ini.
Secara keseluruhan, temuan fungsional ini mendukung sebagian evaluasi molekuler respons EMT yang diinduksi NTP. Lebih jauh, efek NTP yang bergantung pada dosis juga didukung, karena pengobatan NTP dosis tinggi meningkatkan kemampuan migrasi spheroid SK-MEL-28, sedangkan pengobatan NTP dosis rendah tidak.
4 Diskusi
Meskipun terapi pemicu stres oksidatif, seperti NTP, memiliki potensi signifikan sebagai terapi kanker, sifat ganda stres oksidatif sering diabaikan. Memang, mayoritas penelitian yang mengeksplorasi NTP sebagai terapi baru untuk kanker melaporkan hasil penting dalam hal sitotoksisitas, selektivitas, dan kemanjuran imunostimulasi, sedangkan hampir tidak ada penelitian yang menyelidiki potensinya untuk menginduksi EMT dan, akibatnya, pengaruhnya terhadap sifat migrasi sel tumor. Dalam penelitian ini, kami mengevaluasi ekspresi enam biomarker EMT utama dalam sel kanker melanoma, menggunakan model CAM in ovo dan model spheroid 3D. Untuk mengevaluasi lebih lanjut temuan kami, uji fungsional dilakukan untuk kedua model 3D, menilai peningkatan kemampuan migrasi sel kanker pasca pengobatan NTP. Secara keseluruhan, penelitian kami menunjukkan bahwa NTP memicu respons pemicu EMT untuk pengobatan NTP dosis tinggi, sedangkan NTP dosis rendah tidak memengaruhi status EMT atau kemampuan migrasi sel, namun tetap memicu respons antikanker.
Model CAM sangat berguna sebagai pendekatan yang relatif sederhana dan hemat biaya untuk mempelajari angiogenesis dan metastasis. Karena sifat CAM yang sangat vaskularisasi, pencangkokan tumor relatif mudah dengan reproduktifitas tinggi dan, lebih lagi, meniru lingkungan sel kanker fisiologis karena adanya protein matriks ekstraseluler seperti fibronektin, laminin, kolagen tipe I, dan integrin α V β 3 [ [ 41 , 42 ] ]. Sementara penggunaan model ini berasal dari penelitian dari tahun 1949, kemunculannya kembali sebagai alternatif inventif untuk model murine telah memicu perhatian baru dalam komunitas penelitian kanker [ [ 37 ] ]. Kami menggunakan model ini untuk pembentukan tumor untuk tiga lini sel melanoma, A375, SK-MEL-28, dan Malme-3M, dan menilai biomarker EMT utama, serta keberadaan metastasis pada embrio ayam. Hasil kami menunjukkan bahwa EMT dimulai setelah pengobatan NTP, sebagaimana dibuktikan oleh aktivasi sakelar kadherin, peningkatan regulasi vimentin, dan peningkatan regulasi tiga faktor transkripsi EMT utama (Gbr. 1 ). Hasil ini selanjutnya didukung oleh tren peningkatan metastasis di paru-paru dan CAM yang lebih rendah pada embrio ayam (Gbr. 3 ). Sementara hasil dari model ini tidak dapat disangkal menetapkan inisiasi EMT, penarikan kesimpulan tentang perkembangan proses ini masih terbatas karena temuan ini hanya mewakili satu titik waktu tertentu setelah pengobatan NTP.
Pemeriksaan pada titik waktu yang berbeda di luar hari ke-14 dengan model CAM diperlukan tetapi akan memerlukan persetujuan peraturan lebih lanjut, sehingga membatasi keuntungan dari model ini. Oleh karena itu, untuk melihat efek selanjutnya mengenai perkembangan EMT yang diinduksi NTP, kami menggunakan model spheroid 3D, yang tidak memiliki batasan peraturan apa pun. Dalam model ini, kami membandingkan dua dosis NTP (200 Hz vs. 700 Hz) dan memeriksa respons pada titik waktu yang berbeda setelah pengobatan NTP (hari ke-1, hari ke-4, dan hari ke-7). Kami menunjukkan bahwa pengobatan NTP rendah (pada 200 Hz, 3,52 J) memiliki dampak yang dapat diabaikan pada inisiasi EMT. Hal ini diamati tidak hanya melalui evaluasi biomarker EMT tetapi juga dalam penilaian migrasi setelah pengobatan (Gbr. 2 dan 3 ). Sebaliknya, pengobatan dosis yang lebih tinggi 700 Hz (12,3 J) memicu respons EMT, sebagaimana dibuktikan oleh aktivasi keenam biomarker kunci di kedua lini sel, serta karakteristik migrasi yang ditingkatkan setelah pengobatan, tetapi hanya untuk SK-MEL-28 (Gbr. 2 dan 3 ). Hal ini berpotensi dijelaskan oleh ketidakstabilan relatif spheroid Malme-3M dibandingkan dengan spheroid SK-MEL-28. Mengingat bahwa uji migrasi 3D memerlukan cukup banyak pemindahan spheroid, masuk akal bahwa percobaan itu sendiri menyebabkan stres substansial pada spheroid. Oleh karena itu, kami berhati-hati dengan klaim apa pun tentang induksi EMT dalam spheroid ini.
Perubahan pada biomarker EMT tampaknya bersifat sementara dan sebagian besar biomarker kembali ke ekspresi dasar mereka pada hari ke-7, menyiratkan bahwa sel-sel mungkin hanya melalui EMT parsial alih-alih mencapai fenotipe mesenkimal sepenuhnya. Meskipun demikian, perlu dicatat bahwa ini adalah hasil dari satu perawatan. Efek dari menundukkan sel dan tumor pada perawatan NTP berulang harus dievaluasi, karena kemungkinan stimulasi EMT yang lebih berkelanjutan dapat mendorong sel untuk bertransisi lebih jauh dan mencapai fenotipe mesenkimal sepenuhnya. Oleh karena itu, jelas bahwa memilih kondisi perawatan NTP yang paling optimal sangat penting, terutama saat menerjemahkan teknologi ini ke klinik. Sementara dosis perawatan NTP yang lebih tinggi menyebabkan lebih banyak kematian sel, potensi untuk secara bersamaan memicu efek samping, seperti peningkatan potensi metastasis, tidak dapat diabaikan. Sebaliknya, menggunakan dosis NTP yang lebih rendah dapat menyebabkan lebih sedikit efek samping, meskipun toksisitas yang lebih rendah mungkin memerlukan perawatan berulang. Meskipun hal ini bukan merupakan masalah yang signifikan untuk tumor superfisial, seperti melanoma, kanker kulit lainnya, atau kanker kepala dan leher, hal ini mungkin menjadi batasan penting untuk perawatan tumor di dalam tubuh, yang memerlukan pembedahan untuk mengakses lokasi tumor.
Mengingat bahwa induksi EMT adalah efek samping yang relatif umum dalam terapi konvensional seperti kemoterapi dan radioterapi, semakin banyak upaya yang dilakukan untuk mencari peluang untuk mengganggu jalur EMT dan mengembangkan terapi adjuvan anti-EMT [ [ 17 , 43 ] ]. Namun, ini sangat menantang karena plastisitas dan heterogenitas yang tinggi dari berbagai jalur yang terlibat [ [ 23 ] ]. Sebagian besar obat anti-EMT yang tersedia saat ini difokuskan pada pemblokiran penginduksi EMT hulu seperti TGF-β [ [ 20 , 44 ] ]. Mayoritas penghambat ini adalah penghambat spektrum luas, yang tidak spesifik untuk sel kanker, dan karena itu sering menyebabkan efek samping [ [ 20 ] ]. Pendekatan anti-EMT alternatif menargetkan faktor transkripsi EMT [ [ 20 , 44 ] ]. Sebuah studi menunjukkan bahwa membungkam faktor transkripsi secara genetik dapat mengurangi beban metastasis dan resistensi terhadap kemoterapi pada model tikus kanker pankreas, menunjukkan potensi mereka sebagai target yang berharga [ [ 39 , 45 ] ]. Namun, beberapa kontroversi muncul karena klasifikasi tradisional faktor transkripsi sebagai ‘tidak dapat diobati’ karena merupakan peristiwa nuklir yang tidak mudah diakses oleh obat [ [ 44 , 46 ] ]. Strategi lain adalah menargetkan biomarker aktif EMT [ [ 44 , 46 ] ]. Misalnya, senyawa aktif biologis terhadap vimentin, fibronektin, dan N-kadherin dapat digunakan untuk mendorong transisi kembali ke fenotipe epitel. Meskipun ini tampak sangat menjanjikan, mendefinisikan jendela terapi yang tepat untuk jenis obat ini sangat penting karena dapat mempercepat metastasis sel yang disebarluaskan [ [ 44 ] ]. Meskipun banyak tantangan dalam mengembangkan terapi anti-EMT, saat ini ada beberapa obat yang menjanjikan pada berbagai tahap uji klinis, yang mampu menargetkan penanda EMT. Trabedersen, terapi antisense yang mampu memblokir translasi protein mRNA TGF-β, menunjukkan hasil awal yang menggembirakan pada pasien dengan kanker pankreas stadium IV, melanoma maligna, kanker kolorektal, dan kanker otak [ [ 46 , 47 ] ]. Salinomycin, antibiotik ionophore, juga menunjukkan hasil yang menjanjikan, karena menurunkan vimentin, meningkatkan E-cadherin pada sel kanker kolorektal, membalikkan EMT yang diinduksi doxorubicin, dan memulihkan chemosensitivitas in vitro dan in vivo.[ [ 48 ] ]. Selain itu, beberapa kasus klinis menunjukkan penurunan metastasis tumor pada pasien dengan kanker payudara metastatik, kanker ovarium metastatik, dan karsinoma sel skuamosa kepala dan leher metastatik [ [ 49 ] ].
Singkatnya, meskipun ada kemajuan yang signifikan, penargetan atau penekanan EMT tetap sangat menantang. Oleh karena itu, mengembangkan terapi antikanker yang tidak mengubah status EMT sel kanker menawarkan manfaat besar. Seperti yang ditunjukkan oleh hasil kami, mengoptimalkan parameter pengobatan terapi NTP dapat berdampak besar pada responsnya terhadap induksi EMT, sehingga menyoroti potensi klinis penggunaan dosis pengobatan NTP yang lebih rendah.
5 Kesimpulan
Sementara NTP memiliki potensi luar biasa sebagai terapi antikanker, potensi untuk menimbulkan efek samping juga harus dievaluasi dan tidak boleh dihindari. Ada kesenjangan besar dalam pengetahuan tentang kapasitas pengobatan NTP untuk menginduksi EMT dan, selanjutnya, memengaruhi migrasi sel. Studi ini memberikan gambaran molekuler dan fungsional tentang inisiasi dan perkembangan EMT yang diinduksi NTP pada melanoma dengan mengevaluasi ekspresi enam biomarker EMT utama bersama dengan perubahan dalam migrasi. Kami mengungkapkan bahwa pengobatan NTP dosis tinggi memicu respons EMT yang signifikan dan meningkatkan migrasi setelah pengobatan, sedangkan NTP dosis rendah tidak mengubah status EMT sel. Secara keseluruhan, temuan kami memberikan wawasan lebih jauh tentang interaksi NTP-sel yang kritis dan menyoroti bahwa optimalisasi dosis NTP adalah kunci untuk meningkatkan potensi terapeutik untuk penerapan klinis NTP.
