Abstrak
FEM1B dikenal karena fungsi pro-apoptotiknya yang signifikan pada kanker kolorektal; namun, pengaruhnya dan mekanismenya terkait apoptosis pada sel imun masih belum dijelaskan secara memadai. Dalam penelitian ini, kami menunjukkan bahwa FEM1B meningkatkan apoptosis yang diinduksi TRAIL pada lini sel Molt-4, Jurkat, THP-1, dan U937. Khususnya, penurunan FEM1B pada sel yang ditransfeksi mengakibatkan pembalikan peningkatan apoptosis sel yang diamati. Temuan kami menunjukkan bahwa FEM1B mengaktifkan caspase-3 dan caspase-8, tetapi tidak caspase-9, sebagai respons terhadap stimulasi TRAIL, yang menunjukkan keterlibatannya dalam jalur apoptosis yang bergantung pada caspase ekstrinsik. Lebih jauh, kami menemukan bahwa FEM1B berinteraksi dengan TRAF2 dan menurunkan ekspresinya pada sel Molt-4 dan Jurkat, sehingga mengurangi efek penghambatan TRAF2 pada caspase-8. Pada sel THP-1 dan U937, FEM1B ditemukan meningkatkan regulasi TRAIL-R2, sehingga mendorong apoptosis yang diinduksi TRAIL. Studi knockout pada model murine semakin menguatkan bahwa FEM1B memfasilitasi apoptosis yang diinduksi TRAIL. Hasil ini menunjukkan bahwa FEM1B meningkatkan apoptosis yang diinduksi TRAIL pada limfosit T dan monosit melalui mekanisme yang bergantung pada kaspase yang melibatkan reseptor TRAF2 atau TRAIL.
Singkatan
Analisis Varians
analisis varians
APAF1
faktor aktivasi protease apoptosis 1
ATCC
Koleksi Budaya Tipe Amerika
BAK
Antagonis pembunuh homolog Bcl-2
BANK
Bcl-2 terkait X
PENAWARAN
Agonis kematian domain yang berinteraksi dengan BH3
Bahasa Inggris: CRL2
ligase ubikuitin cincin cullin2
FADD
Domain kematian terkait Fas
FEM1B
Homolog fem-1 B
FNIP1
protein yang berinteraksi dengan folikulin 1
GAPDH
gliseraldehida-3-fosfat dehidrogenase
Bahasa Indonesia: PBS
garam penyangga fosfat
qPCR
PCR kuantitatif
ROS
spesies oksigen reaktif
SEJARAH
kesalahan standar rata-rata
TNF
faktor nekrosis tumor
TRAF2
Faktor 2 yang terkait dengan reseptor TNF
JEJAK
Ligand penginduksi apoptosis terkait TNF
Apoptosis adalah proses fisiologis mendasar yang ditandai dengan kematian sel terprogram, yang sangat penting untuk menjaga homeostasis dan memfasilitasi perkembangan jaringan pada orang dewasa [ [ 1 – 3 ] ]. Disregulasi dalam apoptosis, baik melalui penghambatan atau aktivasi berlebihan, berkontribusi pada patogenesis tumor, gangguan neurodegeneratif, dan disregulasi imun [ [ 4 – 8 ] ]. Apoptosis dapat dipicu oleh reseptor pro-apoptotik pada membran sel atau melalui mekanisme intraseluler yang melibatkan mitokondria. Aktivasi kaskade protease mirip ICE/Ced-3, yang umumnya disebut kaspase, merupakan jalur umum yang mengintegrasikan berbagai sinyal apoptotik [ [ 9 , 10 ] ].
Tumor necrosis factor apoptosis-inducing ligand (TRAIL) diklasifikasikan dalam keluarga ligan tumor necrosis factor (TNF) tipe II [ [ 11 , 12 ] ]. Setelah TRAIL mengikat reseptornya (TRAIL-R1 atau TRAIL-R2), Fas-associated death domain (FADD) akan direkrut ke reseptor tersebut, yang mengarah pada aktivasi caspase-8 melalui dimerisasi yang diinduksi oleh kedekatan dan pembelahan proteolitik [ [ 13 , 14 ] ]. Caspase-8 yang teraktivasi dapat langsung mengaktifkan caspase-3 untuk mendorong apoptosis atau menginduksi pembelahan agonis kematian domain yang berinteraksi dengan BH3 (BID) dan menghasilkan bentuk terpotong (tBID), yang berinteraksi dengan B-cell lymphoma 2 (Bcl-2)-associated X (BAX) dan antagonis pembunuh homolog Bcl-2 (BAK) untuk mengeksekusi permeabilisasi membran luar mitokondria dan pelepasan sitokrom C, yang mengarah pada perakitan inisiator caspase-9 intraseluler [ [ 15 , 16 ] ], sehingga memperkuat kaskade pensinyalan apoptosis [ [ 17 , 18 ] ].
Tumor necrosis factor receptor-associated factor 2 (TRAF2) berfungsi sebagai adaptor intraseluler yang memainkan peran penting dalam regulasi negatif apoptosis. TRAF2 mampu berpartisipasi langsung dalam ubikuitinasi caspase-8, sehingga berkontribusi pada sifat antiapoptotiknya [ [ 19 ] ]. Selain itu, TRAF2 mengganggu interaksi antara FADD dan caspase-8, yang menyebabkan inaktivasi caspase-8 [ [ 20 , 21 ] ]. Fungsi penting TRAF2 sebagai pengatur negatif apoptosis dibuktikan secara in vivo oleh pengamatan bahwa tikus knockout TRAF2 menunjukkan mortalitas pascanatal dini karena peningkatan kadar serum TNF [ [ 22 , 23 ] ]. Lebih jauh lagi, berbagai penelitian yang menggunakan lini sel yang kekurangan TRAF2 menunjukkan bahwa efek perlindungan TRAF2 terhadap apoptosis yang diinduksi TNF berlaku di berbagai jenis sel [ [ 24 ] ]. FEM1B, protein yang menunjukkan homologi signifikan terhadap FEM-1, yang penting untuk penentuan jenis kelamin pada Caenorhabditis elegans [ [ 25 ] ]. FEM1B diklasifikasikan sebagai anggota keluarga FEM1, juga termasuk FEM1A dan FEM1C, yang dicirikan sebagai keluarga protein pengulangan ankyrin. Keluarga ini dikaitkan dengan protein terkait reseptor kematian dan terlibat dalam regulasi apoptosis [ [ 26 ] ]. FEM1B telah terbukti mendorong apoptosis ketika tingkat ekspresinya meningkat pada berbagai jenis sel kanker, termasuk yang terkait dengan kanker payudara, kanker serviks, neuroblastoma, dan fibrosarkoma [ [ 27 ] ].
Dalam penelitian sebelumnya, telah dilaporkan bahwa FEM1B berinteraksi dengan domain kematian intraseluler dari reseptor permukaan sel yang menginduksi apoptosis, seperti Fas dan reseptor faktor nekrosis tumor 1 (TNFR1), serta dengan faktor pengaktif protease apoptotik-1 (APAF1) [ [ 28 , 29 ] ]. Meskipun demikian, apakah FEM1B berevolusi dalam jalur apoptosis yang dimediasi oleh anggota keluarga reseptor kematian lainnya dan ligannya, dan perannya dalam apoptosis yang dimediasi TRAIL dan mekanisme yang digunakan FEM1B untuk memengaruhi apoptosis pada sel imun masih belum jelas, meskipun ada hubungan dekat antara Fas, TNF, dan TRAIL dalam superfamili TNF. Selain itu, fungsi pro-apoptotik FEM1B belum divalidasi dalam sel imun. Dalam penelitian ini, kami menggunakan lini sel limfosit T dan monosit, bersama dengan model murine knockout FEM1B, untuk menunjukkan bahwa FEM1B dapat meningkatkan apoptosis yang diinduksi TRAIL pada sel imun. Kami juga mengeksplorasi mekanisme potensial di mana FEM1B meningkatkan apoptosis yang diinduksi TRAIL pada limfosit T dan monosit.
Bahan dan metode
Sel dan plasmid
Lini sel Human 293T (ATCC; #CRL-3216) dikulturkan dalam medium Eagle yang dimodifikasi Dulbecco (Gibco, New York, NY, AS). Lini sel Human Molt-4 (ATCC; #CRL-1582), Human Jurkat (klon E6-1; ATCC; #TIB-152), Human THP-1 (ATCC; #TIB-202), dan Human U937 (ATCC; #CRL-1593.2) dikulturkan dalam medium Roswell Park Memorial Institute-1640 (Gibco). Semua medium dilengkapi dengan 10% serum sapi fetal (Gibco), 100 U·mL −1 penisilin, dan 100 mg·mL −1 streptomisin.
Kerangka baca terbuka dari vektor ekspresi yang mengkode FEM1B dan shFEM1B dikloning dalam pLV-3flag-P2A, plasmid pSPAX2, pMD2.G berdasarkan sistem lentivirus diperoleh dari Addgene. Plasmid ditransfeksi dalam sel 293T menggunakan lipoD293 (SignaGen, Frederick, MD, AS).
qPCR
Total RNA diekstraksi menggunakan RNeasy® Mini kit sesuai dengan panduan pabrik (QIAGEN, Hilden, Jerman). Proses transkripsi balik dilakukan menggunakan PrimeScript™ RT Reagent Kit dengan penghapus gRNA (TaKaRa, Beijing, Tiongkok). Penghapus gDNA diaplikasikan pada sampel RNA dan diinkubasi pada suhu 42 °C selama 2 menit. Reaksi transkripsi balik dipertahankan pada suhu 37 °C selama 15 menit, diikuti dengan inkubasi singkat pada suhu 85 °C selama 5 detik. Untuk PCR real-time, primer digunakan, termasuk: 5′-GACACGCAAAGGTGGTACGC-3′ dan 5′-GCTCCAGCTGCACACCAAAG-3′ untuk FEM1B; 5′-AATGACCCCTTCATTGAC-3′ dan 5′-TCCACGACGTACTCAGCGC-3′ untuk GAPDH. Protokol qPCR melibatkan denaturasi awal pada suhu 95 °C selama 30 detik, diikuti oleh 40 siklus denaturasi pada suhu 95 °C selama 5 detik dan annealing/ekstensi pada suhu 62 °C selama 34 detik. Analisis hasil qPCR dilakukan menggunakan metode ΔΔCT yang dinormalisasi ke GAPDH.
Imunoblotting
Imunoblotting dilakukan untuk mendeteksi tingkat protein seluler menggunakan berbagai antibodi, termasuk kelinci anti-FEM1B poliklonal (Thermo Fisher, Waltham, MA, AS, 1: 500), kelinci anti-caspase-3 monoklonal (CST, Boston, MA, AS, 1: 1000), kelinci anti-caspase-3 terbelah (CST, 1: 1000), kelinci anti-caspase-8 monoklonal (CST, 1: 1000), kelinci anti-caspase-8 terbelah (CST, 1: 1000), tikus anti-caspase-9 monoklonal (CST, 1: 1000), tikus anti-caspase-9 terbelah (CST, 1: 1000), kelinci anti-BAK monoklonal (CST, 1: 500), kelinci anti-BAX monoklonal (CST, 1: 500), kelinci anti-sitokrom C monoklonal (CST, 1 : 500), kelinci anti-TRAF2 monoklonal (CST, 1 : 500), kelinci anti-TRAIL-R1 (CST, 1 : 500), kelinci anti-TRAIL-R2 (CST, 1 : 500), kelinci anti-GAPDH (CST, 1 : 3000), HRP anti-IgG kelinci (CST, 1 : 5000), dan HRP anti-IgG tikus (CST, 1 : 5000).
Pengukuran apoptosis sel
Apoptosis sel diukur dengan flow cytometry. Sel-sel dikenakan prosedur pencucian sentrifugasi menggunakan PBS yang didinginkan terlebih dahulu, kemudian sel-sel disuspensikan kembali dalam 1× Binding Buffer (Sino Biological, Beijing, Cina). Lima mikroliter annexin V-PE dan antibodi 7-AAD (Sino Biological) ditambahkan ke suspensi sel, yang kemudian dicampur perlahan dan diinkubasi selama 15 menit pada suhu ruangan. Fluoresensi dipantau oleh BD Accuri™ C6. Data yang dihasilkan dianalisis dan divisualisasikan menggunakan perangkat lunak flowjo (versi 10.0, disediakan oleh BD Biosciences, Franklin Lakes, NJ, AS).
Uji induksi TRAIL dan penghambat caspase
Protein manusia TRAIL (MCE, New Jersey, AS) diaplikasikan pada konsentrasi 100 ng·mL −1 selama 16 jam. Inhibitor caspase-3 Z-DEVD-FMK, inhibitor caspase-8 Z-IETD-FMK, dan inhibitor pan-caspase Z-VAD-FMK (MCE) diaplikasikan pada konsentrasi 50 nm dan digunakan 1 jam sebelum induksi TRAIL.
Ko-imunopresipitasi
Sel 293T manusia dikumpulkan 48 jam pascatransfeksi. Selanjutnya, 5 μg antibodi anti-Flag tikus diinkubasi bersama dengan manik-manik agarosa protein A dan manik-manik agarosa protein G semalaman pada suhu 4 °C. Imunoblotting selanjutnya digunakan untuk mengidentifikasi protein pengikat melalui ko-imunopresipitasi.
Perawatan hewan dan persetujuan studi
Protokol percobaan disetujui oleh Institutional Animal Care and Use Committee (IACUC, nomor persetujuan: XJ23007) di Institute of laboratory animal science (ILAS), CAMS&PUMC. Semua prosedur perawatan hewan mematuhi pedoman untuk perlakuan dan penggunaan hewan yang etis. Tikus FEM1B-KO (C57BL/6) diperoleh dari ILAS. Tikus heterozigot jantan dan betina dikawinkan untuk menghasilkan keturunan. Tikus berusia enam hingga delapan minggu dieutanasia menggunakan metode dislokasi sumsum tulang belakang. Biopsi ekor dilakukan pada tikus yang baru lahir pada Hari ke-7 pascanatal untuk ekstraksi DNA dan analisis PCR menggunakan primer 5′-TCAACCTTCCTAATGCTGCAACT-3′ dan 5′-CATTCCTTTTCATCTTACACCTAATTAG-3′ untuk verifikasi FEM1B KO. Prosedur percobaan dilakukan menggunakan tikus KO homozigot bersama tikus serasah WT mereka.
Penilaian apoptosis sel pada sel limpa tikus
Limpa tikus dibedah dan digiling perlahan menggunakan saringan sel 70 μm untuk memperoleh suspensi sel tunggal. TRAIL tikus (MCE) kemudian diaplikasikan selama 16 jam dalam konsentrasi 100 ng·mL −1 . Antibodi anti-CD3-BV510 dan CD11b-FITC (BD Biosciences) dimasukkan ke dalam suspensi sel, dan diinkubasi selama 30 menit pada suhu 4 °C, antibodi Annexin V dan 7-AAD kemudian ditambahkan dan diinkubasi selama 15 menit pada suhu ruangan untuk menguji apoptosis sel in vitro pada limfosit T dan monosit dengan atau tanpa induksi TRAIL. Fluoresensi dipantau oleh BD FACS Arial™ Fusion II.
Hasil
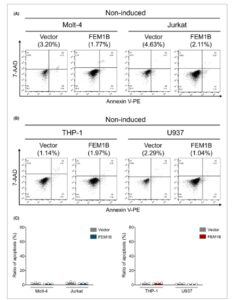
FEM1B tidak mempengaruhi apoptosis sel yang tidak diinduksi
Kami menggunakan lini sel Molt-4 dan Jurkat sebagai model untuk limfosit T, dan lini sel THP-1 dan U937 untuk monosit. FEM1B manusia ditransfeksi ke dalam lini sel ini menggunakan sistem lentivirus, dengan kadar protein dan mRNA selanjutnya dinilai dengan immunoblotting dan PCR kuantitatif (qPCR) (Gbr. 1A,B ). Transfeksi menghasilkan peningkatan signifikan pada kadar protein FEM1B dan ekspresi mRNA dibandingkan dengan sel tiruan, yang mengonfirmasi keberhasilan ekspresi berlebih di seluruh lini sel. Untuk mengetahui apakah transfeksi FEM1B sendiri memengaruhi apoptosis sel, kami membandingkan apoptosis sel yang tidak diinduksi dalam sel yang ditransfeksi FEM1B dengan yang ada dalam sel tiruan. Dalam limfosit T, FEM1B tidak mengubah tingkat apoptosis sel yang tidak diinduksi baik dalam sel Molt-4 (1,80 ± 0,246% vs. 2,56 ± 0,58% dalam sel tiruan) maupun sel Jurkat (2,28 ± 0,17% vs. 3,35 ± 1,13% dalam sel tiruan) (Gbr. 2A,C ). Demikian pula, sel monosit THP-1 dan U937 yang ditransfeksi FEM1B menunjukkan apoptosis sel masing-masing sebesar 2,54 ± 0,51% dan 1,09 ± 0,08% (Gbr. 2B,C ), yang menunjukkan tidak ada dampak signifikan FEM1B pada apoptosis sel yang tidak diinduksi. Hasil ini menunjukkan bahwa FEM1B mungkin tidak memengaruhi apoptosis sel dalam lini sel limfosit T atau monosit tanpa adanya induksi.

Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Ekspresi berlebihan FEM1B pada lini sel yang berasal dari limfosit T dan monosit. (A) Tingkat protein FEM1B pada lini sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi dan tiruan, sebagaimana dinilai melalui imunoblotting. (B) Ekspresi mRNA FEM1B pada lini sel yang ditransfeksi dan tidak ditransfeksi menggunakan reaksi berantai polimerase kuantitatif (qPCR) (panel atas) dan tingkat protein FEM1B dalam representasi statistik (panel bawah), dengan signifikansi statistik ditunjukkan pada * P < 0,05, ** P < 0,01, *** P < 0,001, dianalisis dengan uji- t Welch . Batang Kesalahan menunjukkan rerata ± SEM, n = 3 replikasi teknis.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Terjadinya apoptosis sel yang tidak diinduksi pada garis sel Molt-4 dan Jurkat yang ditransfeksi dan tiruan, (A) garis sel THP-1 dan U937, serta (C) representasi statistik dari data; signifikansi statistik dianalisis dengan uji- t Welch , n = 3 replikasi teknis.
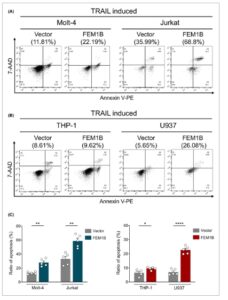
FEM1B meningkatkan apoptosis sel yang diinduksi TRAIL
Untuk lebih menegaskan peran FEM1B dalam apoptosis sel, kami mengukur apoptosis sel yang diinduksi oleh TRAIL, yang bertindak sebagai sekering peledak untuk memicu apoptosis. Pada sel Jurkat, FEM1B secara signifikan meningkatkan apoptosis sel yang diinduksi oleh TRAIL, dengan rasio 58,63 ± 8,98% dibandingkan dengan 32,87 ± 8,21% pada sel tiruan. Demikian pula, pada lini sel Molt-4, apoptosis sel meningkat hingga 27,85 ± 5,30% dengan transfeksi FEM1B, dibandingkan dengan 13,07 ± 1,75% pada sel tiruan (Gbr. 3A,C ). Dalam lini sel yang berasal dari monosit, FEM1B juga meningkatkan apoptosis sel, dengan rasio 9,57 ± 1,05% dalam sel THP-1 versus 6,47 ± 2,13% dalam sel tiruan, dan 22,65 ± 2,68% dalam sel U937 dibandingkan dengan 7,04 ± 2,05% dalam sel tiruan (Gbr. 3B,C ). Meskipun tingkat apoptosis bervariasi di antara lini sel yang berbeda, FEM1B secara signifikan meningkatkan sensitivitasnya terhadap TRAIL, sehingga menghasilkan apoptosis sel yang dipromosikan di berbagai lini sel, khususnya pada limfosit T. Khususnya, sel Jurkat menunjukkan peningkatan apoptosis yang lebih nyata sebagai respons terhadap induksi TRAIL dibandingkan dengan lini sel lainnya, yang mungkin disebabkan oleh sensitivitasnya yang meningkat terhadap induksi TRAIL.
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Apoptosis sel yang diinduksi oleh TRAIL pada sel Molt-4 dan Jurkat yang ditransfeksi dan tiruan (A), (B) sel THP-1 dan U937, serta (C) representasi statistik data. Signifikansi statistik ditunjukkan pada * P < 0,05, ** P < 0,01, **** P < 0,0001, dianalisis dengan uji- t Welch . Batang Kesalahan menunjukkan rerata ± SEM, n = 5 replikasi teknis.
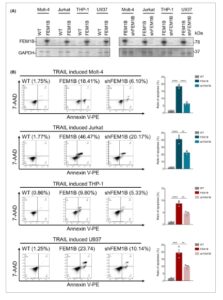
Untuk memastikan peran FEM1B dalam apoptosis sel yang diinduksi TRAIL dan untuk lebih jauh memperkuat hubungan mereka, kami melakukan percobaan penyelamatan. Kami secara selektif mendeplesi FEM1B dalam lini sel yang telah ditransfeksi dengan FEM1B dan selanjutnya membandingkan tingkat apoptosis yang diinduksi TRAIL dalam lini sel yang dimodifikasi ini dengan yang ada pada tipe liar (WT) dan rekan-rekan yang tidak terdeplesi (Gbr. 4A ). Temuan kami menunjukkan bahwa penurunan regulasi FEM1B sebagian dapat membalikkan peningkatan apoptosis yang terkait dengan ekspresinya yang berlebihan. Secara khusus, dalam sel Molt-4 dan Jurkat, rasio apoptosis berkurang menjadi 6,46 ± 1,03% dan 22,64 ± 2,51%, masing-masing. Sebaliknya, sel THP-1 dan U937 menunjukkan tingkat apoptosis sebesar 6,46 ± 1,03% dan 9,90 ± 1,15% (Gbr. 4B ). Hasil-hasil ini mendukung hipotesis bahwa FEM1B memainkan peran penting dalam memediasi apoptosis yang diinduksi TRAIL.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Percobaan penyelamatan ekspresi berlebih FEM1B. (A) Pemeriksaan tingkat protein FEM1B pada lini sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi dan tidak ditransfeksi (panel kiri) dan deplesi FEM1B pada lini sel yang ditransfeksi (panel kanan). (B) Apoptosis sel yang diinduksi TRAIL pada lini sel yang tidak ditransfeksi, ditransfeksi FEM1B, dan deplesi FEM1B pada lini sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi serta representasi statistik data. Signifikansi statistik ditunjukkan pada ** P < 0,01, **** P < 0,0001, dianalisis dengan ANOVA satu arah biasa dan uji perbandingan berganda Dunnett. Batang Kesalahan menunjukkan mean ± SEM, n = 3 replikasi teknis.
Peningkatan apoptosis sel FEM1B berhubungan dengan aktivasi caspase-3 dan caspase-8
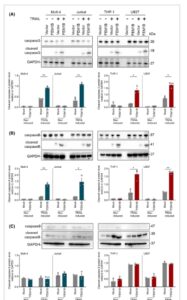
Untuk menyelidiki bagaimana FEM1B memengaruhi apoptosis sel yang diinduksi oleh TRAIL, kami meneliti jalur yang bergantung pada kaspase, yang mewakili pensinyalan hilir klasik yang dipicu oleh TRAIL dan reseptornya. Dengan tidak adanya TRAIL, kaspase-3, kaspase-8, dan kaspase-9 tetap dalam bentuk yang tidak terbelah pada sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi FEM1B dan tiruan. Namun, setelah induksi TRAIL, tingkat pembelahan kaspase meningkat secara signifikan. Kami mengamati bahwa setelah induksi TRAIL, bentuk pembelahan kaspase-3 dan kaspase-8 meningkat secara signifikan pada sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi FEM1B, sementara kaspase-9 juga terbelah setelah induksi tetapi tidak menunjukkan signifikansi antara sel yang ditransfeksi dan tiruan (Gbr. 5A–C ). Kami selanjutnya mengonfirmasi bahwa Z-DEVD-FMK (penghambat caspase-3), Z-IETD-FMK (penghambat caspase-8), dan Z-VAD-FMK (penghambat pan-caspase) mampu memblokir apoptosis yang diinduksi TRAIL (Gbr. 6A,B ). Selain itu, kami mendeteksi ekspresi FEM1B dalam sel Molt-4, Jurkat, THP-1, dan U937 dengan atau tanpa induksi TRAIL (Gbr. 6C ); temuan kami menunjukkan bahwa FEM1B menunjukkan peningkatan tingkat ekspresi sebagai respons terhadap induksi TRAIL. Akibatnya, kami berhipotesis bahwa FEM1B dapat berfungsi dalam jalur yang bergantung pada caspase dan memiliki kapasitas untuk merespons TRAIL, yang mengarah pada peningkatan regulasinya.
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Tingkat protein molekul kaspase dan bentuk terbelahnya dalam jalur yang bergantung pada kaspase pada garis sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi FEM1B dan tiruan. (A) Tingkat protein kaspase-3 beserta bentuk terbelahnya dan representasi statistik kaspase-3 yang terbelah. (B) Tingkat protein kaspase-8 beserta bentuk terbelahnya dan representasi statistik kaspase-8 yang terbelah. (C) Tingkat protein kaspase-9 beserta bentuk terbelahnya dan representasi statistik kaspase-9 yang terbelah. Signifikansi statistik ditunjukkan pada * P < 0,05, ** P < 0,01, dianalisis dengan uji- t Welch . Batang Kesalahan menunjukkan rerata ± SEM, n = 3 replikasi teknis.

Gbr. 6
Buka di penampil gambar
Kekuatan Gambar
Efek penghambat caspase pada pengurangan apoptosis yang diinduksi oleh transfeksi FEM1B dan ekspresi FEM1B terkait dengan apoptosis pada lini sel Molt-4, Jurkat, THP-1, dan U937. (A) Data dari lini sel Molt-4 dan Jurkat yang ditransfeksi dengan FEM1B, yang mengalami perlakuan dengan saline, Z-DEVD, Z-IETD, dan Z-VAD, menghasilkan hasil signifikan secara statistik **** P < 0,0001. (B) Temuan dari lini sel THP-1 dan U937 yang ditransfeksi yang diperlakukan dengan saline, Z-DEVD, Z-IETD, dan Z-VAD, mengungkapkan perbedaan signifikan dengan * P < 0,05, *** P < 0,001, dan **** P < 0,0001. ANOVA satu arah biasa dan uji perbandingan berganda Dunnett digunakan untuk analisis statistik. Batang Kesalahan menunjukkan mean ± SEM, n = 6 replikasi teknis. (C) Ekspresi mRNA FEM1B pada lini sel Molt-4, Jurkat, THP-1, dan U937 yang tidak diinduksi atau diinduksi TRAIL. Signifikansi statistik ditunjukkan pada * P < 0,05, dianalisis dengan uji- t Welch . Batang Kesalahan menunjukkan rerata ± SEM, n = 3 replikasi teknis.
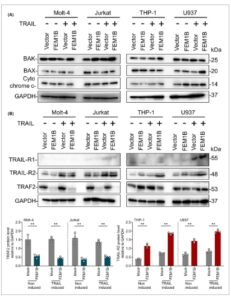
Selanjutnya, kami menilai tingkat protein molekul apoptosis intrinsik, termasuk BAK, BAX, dan sitokrom C, tetapi kami tidak mengamati perubahan signifikan apa pun pada molekul-molekul ini (Gbr. 7A ).
Gbr. 7
Buka di penampil gambar
Kekuatan Gambar
Tingkat protein molekul terkait apoptosis pada lini sel Molt-4, Jurkat, THP-1, dan U937. (A) Tingkat protein BAK, BAX, dan sitokrom C. (B) Tingkat protein TRAIL-R1, TRAIL-R2, dan TRAF2, dan penyajian statistik tingkat protein TRAF2 pada lini sel Molt-4 dan Jurkat, serta tingkat protein TRAIL-R1 pada lini sel THP-1 dan U937. Signifikansi statistik ditunjukkan pada ** P < 0,05, dianalisis dengan uji- t Welch . Batang Kesalahan menunjukkan rerata ± SEM, n = 3 replikasi teknis.
FEM1B menggunakan TRAF2 dan TRAIL-R2 untuk memediasi apoptosis
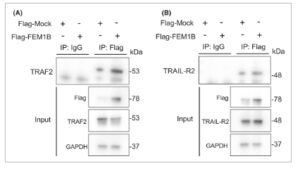
Untuk mengeksplorasi fungsi spesifik FEM1B dalam apoptosis seluler yang bergantung pada kaspase, kami melakukan analisis kadar protein reseptor TRAIL, khususnya TRAIL-R1, TRAIL-R2, dan faktor terkait reseptor TRAF2. Temuan kami menunjukkan bahwa profil ekspresi TRAIL-R1, TRAIL-R2, dan TRAF2 bervariasi sebagai respons terhadap transfeksi FEM1B. Dalam lini sel Molt-4 dan Jurkat, TRAIL-R1 tidak terdeteksi, dan tingkat ekspresi TRAIL-R2 tidak menunjukkan perbedaan signifikan antara sel yang ditransfeksi dan sel tiruan. Khususnya, kami mengamati penurunan signifikan kadar TRAF2 dalam sel yang ditransfeksi FEM1B, terlepas dari status induksi (Gbr. 7B ). Dalam lini sel THP-1 dan U937, kadar TRAIL-R1 sedikit meningkat dibandingkan dengan kadar dalam sel Molt-4 dan Jurkat. Namun, baik TRAIL-R1 maupun TRAF2 tidak menunjukkan perbedaan signifikan antara sel yang ditransfeksi dan sel tiruan. Khususnya, sel THP-1 dan U937 yang ditransfeksi FEM1B menunjukkan peningkatan kadar protein TRAIL-R2 dibandingkan dengan sel tiruan (Gbr. 7B ). Lebih jauh, kami menetapkan bahwa FEM1B berinteraksi dengan TRAF2 (Gbr. 8A ) tetapi tidak dengan TRAIL-R2 (Gbr. 8B ), yang mengarahkan kami untuk berhipotesis bahwa TRAF2 dapat berfungsi sebagai target untuk FEM1B, khususnya dalam konteks ubikuitinasi. Meskipun demikian, mekanisme pasti yang dengannya FEM1B memengaruhi TRAIL-R2 masih harus diklarifikasi.
Gbr. 8
Buka di penampil gambar
Kekuatan Gambar
Interaksi FEM1B dengan TRAF2 dan TRAIL-R2. (A) Sel-sel 293T yang ditransfeksi dengan plasmid FEM1B-flag mengalami imunopresipitasi anti-Flag untuk menguji interaksi antara FEM1B dan TRAF2. (B) Sel-sel 293T yang ditransfeksi dengan plasmid FEM1B-flag mengalami imunopresipitasi anti-Flag untuk menguji interaksi antara FEM1B dan TRAIL-R2, dianalisis dengan imunoblotting.
Knockout gen FEM1B mengurangi apoptosis yang diinduksi TRAIL pada sel limpa
Untuk menyelidiki dampak knockout FEM1B pada apoptosis sel yang diinduksi TRAIL secara in vivo , kami melakukan knockout FEM1B pada tikus C57BL/6 (Gbr. 9A ). Limpa tikus-tikus ini diproses menjadi suspensi sel tunggal (Gbr. 9B ), dengan beberapa sampel mengalami pengobatan TRAIL Tikus dan yang lainnya tidak diobati. Limfosit T dan monosit dari knockout FEM1B dan tikus WT tidak mengalami apoptosis tanpa adanya stimulasi TRAIL. Namun, ketika terpapar TRAIL, sel-sel dari tikus knockout FEM1B ini menunjukkan pengurangan yang signifikan dalam apoptosis yang diinduksi TRAIL (Gbr. 9C ). Hasil-hasil ini berkontribusi pada pemahaman yang lebih dalam tentang peran penting FEM1B dalam regulasi apoptosis sel dan menunjukkan bahwa FEM1B dapat berfungsi sebagai target terapi yang menjanjikan untuk modulasi jalur apoptosis.

Gbr. 9
Buka di penampil gambar
Kekuatan Gambar
Knockout gen FEM1B mengurangi apoptosis yang diinduksi TRAIL pada limfosit T dan monosit yang dipisahkan dari limpa tikus. (A) Biopsi ekor dari tikus knockout FEM1B (KO) dan littermate tipe liar (WT) dianalisis menggunakan polymerase chain reaction (PCR). (B) Strategi gating yang digunakan untuk mengidentifikasi limfosit T CD3 + dan monosit CD11b + dari sel limpa, bersama dengan analisis apoptosis sel berikutnya, disajikan. (C) Proporsi apoptosis sel yang tidak diinduksi (panel kiri) dan yang diinduksi TRAIL dalam populasi limfosit T CD3 + dan monosit CD11b + dari tikus FEM1B-KO dibandingkan dengan littermate WT digambarkan. Signifikansi statistik ditunjukkan oleh ** P < 0,01, *** P < 0,001, dianalisis oleh uji- t Welch . Batang Kesalahan mewakili mean ± SEM, n = 6 replikasi biologis.
Diskusi
FEM1B adalah gen yang baru ditemukan yang berhubungan dengan berbagai penyakit. Telah ditunjukkan bahwa gen ini memfasilitasi degradasi onkogen Gli1 yang berhubungan dengan glioma, yang terkait dengan perkembangan toleransi terhadap oksaliplatin [ [ 30 ] ]. Dalam sistem ubiquitin-proteasome, FEM1B memainkan peran penting sebagai komponen ligase ubiquitin E3 [ [ 31 ] ]. Studi terbaru menunjukkan bahwa FEM1B membentuk kompleks cullin2-ring ubiquitin ligase (CRL2), yang berpartisipasi dalam degradasi folliculin-interacting protein 1 (FNIP1) dan memainkan peran penting dalam respons seluler terhadap stres reduktif [ [ 32 , 33 ] ]. Selain itu, poliubiquitinasi dan pergantian protein berikutnya yang dimediasi oleh CRL2 FEM1B bergantung pada interaksi antara FEM1B-degron dan keadaan dimerisasi kompleks ligase E3 [ [ 34 ] ]. Penghambatan FEM1B dalam sumbu FEM1B-FNIP1 telah terbukti menurunkan spesies oksigen reaktif (ROS) mitokondria, sehingga mendorong angiogenesis [ [ 35 , 36 ] ]. Keterlibatan FEM1B dalam proses ubikuitinasi telah dijelaskan; namun, perannya dalam apoptosis sel masih belum terdokumentasi dengan baik. Meskipun FEM1B dikenal sebagai protein pro-apoptotik, peran langsungnya dalam mendorong apoptosis sel belum dijelaskan.
Dalam penelitian ini, kami memanfaatkan sel Molt-4, Jurkat, THP-1, dan U937 yang ditransfeksi FEM1B untuk mengeksplorasi hubungan antara FEM1B dan apoptosis sel. Kami menemukan bahwa FEM1B memiliki kemampuan untuk meningkatkan apoptosis yang diinduksi TRAIL. Penelitian tentang TRAIL telah maju secara signifikan, khususnya mengenai jalur antitumor dan potensi terapeutiknya [ [ 37 – 39 ] ]. Namun, di luar pengobatan kanker, sifat pro-apoptosis dan ekspresi luas TRAIL menunjukkan peran yang lebih luas, khususnya dalam regulasi dan homeostasis apoptosis sel [ [ 17 , 40 ] ]. Sebuah penelitian baru-baru ini telah mengidentifikasi mekanisme baru komunikasi sel [ [ 41 ] ], yang mengungkapkan bahwa endotelium berfungsi sebagai sumber TRAIL yang signifikan dalam sirkulasi yang sehat, yang terganggu dalam kasus penyakit arteri perifer. Penghapusan TRAIL ditemukan menghambat neo-angiogenesis, perekrutan perisit, dan stabilisasi pembuluh darah, yang pada akhirnya menyebabkan berkurangnya perfusi darah di tungkai bawah yang terkena iskemia [ [ 42 ] ]. Selain itu, ekspresi TRAIL dalam sel pembantu (Th) CD4 + responsif interferon dan sel pengatur berpotensi menghambat aktivasi sel Th, sehingga menjelaskan fenomena yang terkait dengan respons alergi [ [ 43 ] ]. Selain itu, makrofag terkait tumor yang diperkaya dengan TIM3 dan VISTA diamati menginduksi kematian sel kanker melalui pensinyalan TRAIL [ [ 44 ] ].
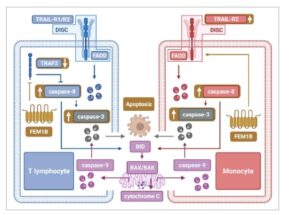
Lebih jauh lagi, kami menetapkan korelasi antara apoptosis yang diinduksi TRAIL dan FEM1B, yang menunjukkan bahwa FEM1B meningkatkan proses apoptosis yang dimediasi TRAIL. Lebih jauh lagi, kami mengonfirmasi bahwa penipisan FEM1B dapat membalikkan peningkatan apoptosis yang terkait dengan ekspresi berlebihan FEM1B, dengan demikian menegaskan peran penting FEM1B dalam mendorong apoptosis seluler. Analisis kami terhadap jalur pensinyalan hilir mengungkapkan aktivasi kaspase, yang merupakan bagian integral dari jalur klasik yang dimediasi TRAIL. Khususnya, transfeksi FEM1B menghasilkan peningkatan signifikan dalam aktivasi kaspase-3 dan kaspase-8, sementara tidak memiliki efek pada aktivasi kaspase-9. Ini menunjukkan bahwa FEM1B dapat secara khusus meningkatkan jalur apoptosis ekstrinsik, karena tidak mengubah kadar protein apoptosis intrinsik, seperti BAK, BAX, dan sitokrom C. Yang penting, ekspresi FEM1B ditemukan meningkat selama apoptosis. Dalam lini sel, seperti Molt-4, Jurkat, THP-1, dan U937, FEM1B biasanya diekspresikan pada tingkat rendah; namun, peningkatan regulasinya sebagai respons terhadap rangsangan apoptosis menyediakan dasar yang kuat untuk keterlibatannya dalam proses apoptosis. Hasil kami lebih lanjut menunjukkan bahwa FEM1B memodulasi apoptosis pada lini sel yang berasal dari limfosit T dan monosit melalui berbagai jalur molekuler. Dalam sel Molt-4 dan Jurkat, FEM1B diamati menurunkan regulasi ekspresi TRAF2, sehingga mengurangi efek penghambatannya pada caspase-8. Sebaliknya, dalam sel THP-1 dan U937, FEM1B tampaknya meningkatkan ekspresi reseptor kematian TRAIL-R2, sehingga meningkatkan efek ligan-reseptor dan memfasilitasi proses apoptosis yang diinduksi TRAIL (Gbr. 10 ). Kami mengonfirmasi hubungan antara TRAF2 dan FEM1B, tetapi tidak dengan TRAIL-R2. Akibatnya, kami mengusulkan bahwa FEM1B mungkin terlibat dalam degradasi TRAF2 karena fungsinya sebagai ligase ubikuitin, meskipun bukti lebih lanjut diperlukan untuk mengonfirmasi hipotesis ini. Meskipun demikian, mekanisme pasti yang dengannya FEM1B memengaruhi apoptosis pada sel THP-1 dan U937 masih harus dijelaskan. In vivo , kami juga menunjukkan bahwa penghapusan FEM1B mampu meredam apoptosis sel limpa murine yang diinduksi oleh TRAIL, yang selanjutnya menunjukkan pentingnya dalam apoptosis sel yang bergantung pada TRAIL. Degradasi TRAF2, yang difasilitasi oleh FEM1B, memainkan peran penting dalam memoderasi respons imun yang berlebihan, sehingga membantu mencegah autoimunitas. Selain itu, melalui interaksinya dengan TRAF2, FEM1B juga dapat memengaruhi jalur pensinyalan NK-κB, yang terlibat dalam berbagai gangguan terkait imun.
Gambar 10
Buka di penampil gambar
Kekuatan Gambar
Ilustrasi bagaimana FEM1B memfasilitasi apoptosis yang diinduksi TRAIL pada limfosit T dan monosit. Pada limfosit T, FEM1B menurunkan ekspresi TRAF2, sehingga mengurangi efek penghambatan pada caspase-8. Pada monosit, FEM1B meningkatkan ekspresi reseptor kematian TRAIL-R2, sehingga mendorong proses apoptosis.
Selama beberapa dekade terakhir, semakin banyak ligan dan reseptor dalam superfamili TNF telah diidentifikasi, memperluas pemahaman tentang kematian sel terprogram di luar apoptosis untuk mencakup mekanisme, seperti nekroptosis, piroptosis, ferroptosis, bencana mitosis, dan kematian sel autofagik [ [ 2 , 45 – 47 ] ]. Secara kolektif, kami mengidentifikasi FEM1B sebagai penambah baru pembelahan caspase-3 dan caspase-8, yang mendorong peningkatan kematian sel sebagai respons terhadap TRAIL. Khususnya, interaksi antara TRAIL dan FEM1B tampaknya memperkuat efek apoptosis TRAIL saja. Penelitian di masa depan diperlukan untuk menentukan apakah FEM1B terlibat dalam bentuk lain dari kematian sel terprogram, baik dalam cara yang sama atau berbeda, dan untuk menjelaskan bagaimana FEM1B berinteraksi dengan molekul dalam jalur pensinyalan kematian sel.
