Abstrak
Glikan memainkan peran penting dalam bakteri, seperti menyediakan integritas struktural atau memungkinkan interaksi dengan ekosistem. Mereka dapat dikaitkan dengan lipid, peptida, atau protein. Dalam protein, mereka memodifikasi asparagin ( N- glikosilasi) atau serin atau treonin ( O- glikosilasi). Spesies dari filum Bacteroidota, komponen utama mikrobioma manusia dan ekosistem laut dan tanah, memiliki jenis O- glikosilasi unik yang memodifikasi beberapa protein nonsitoplasma yang mengandung urutan asam amino tertentu. Hanya sejumlah kecil spesies yang saat ini telah dikarakterisasi, tetapi dalam satu spesies, umumnya semua protein dimodifikasi dengan struktur glikan yang sama. Sebagian besar spesies berbagi bagian dalam yang sama tetapi berbeda dalam komposisi gula dan percabangan bagian luar glikan mereka. Ini menunjukkan bahwa biosintesis glikan terjadi dalam dua langkah terpisah. Baik inti dalam maupun glikana luar kemungkinan besar disusun dari monosakarida yang diaktifkan oleh nukleotida pada undekaprenil fosfat di sisi sitoplasma membran dalam, sebelum dibalik ke periplasma dan dipindahkan ke protein. Lokus genom yang bertanggung jawab atas biosintesis glikana luar telah diidentifikasi, yang mengandung beberapa gen yang dilestarikan lintas spesies. Meskipun ada kemajuan substansial dalam karakterisasi sistem O -glikosilasi ini, fungsinya, keragaman keseluruhan struktur glikana di seluruh filum, dan jalur biosintesis lengkap sebagian besar masih belum diketahui. Karena pentingnya kelompok spesies ini bagi mikrobioma usus manusia, menjelaskan aspek-aspek ini dapat membuka strategi untuk memodulasi komposisi komunitas mikrobioma menuju keadaan yang sehat.
Singkatan
GLCNAc (Glukosa)
N -asetilglukosamin
Bahasa Inggris GT
glikosiltransferase
LFG
lokus glikosilasi fragilis
LPS
lipopolisakarida
Bahasa Inggris MurNAc
Asam N -asetilmuramat
Bahasa Indonesia: OMV
vesikel membran luar
OTase
oligosakarida transferase
RNA duta besar
transfer asam ribonukleat
Und-P
undekaprenil fosfat
Bakteri menghasilkan berbagai macam struktur glikana yang memainkan peran penting dalam berbagai proses seluler [ [ 1 ] ]. Dibandingkan dengan eukariota, ini mengandung monosakarida bakteri yang unik dan modifikasi rantai gula. Glikana hadir dalam bakteri Gram-negatif dan Gram-positif dan dapat terdiri hanya dari karbohidrat atau dikaitkan dengan lipid, peptida pendek, atau protein. Banyak dari struktur ini memberikan integritas pada sel, perlindungan dari pertahanan inang, virulensi, atau adhesi permukaan [ [ 1 ] ]. Contohnya adalah sebagai berikut: peptidoglikan (dinding sel), suatu struktur yang terdiri dari rantai linier residu N -asetilglukosamin (GlcNAc) dan asam N -asetilmuramat (MurNAc) bergantian yang dihubungkan oleh ikatan silang peptida pendek [ [ 2 ] ]; asam teikoat, yang merupakan glikopolymer anionik dari gliserol fosfat, ribitol fosfat, atau gula fosfat yang ditemukan pada bakteri Gram-positif yang terikat secara kovalen pada peptidoglikan atau berlabuh pada lapisan luar membran sitoplasma [ [ 3 ] ]; lipopoly- dan lipooligosakarida pada bakteri Gram-negatif, yang terdiri dari glikolipid membran luar yang disebut lipid A, inti oligosakarida, dan dalam kasus LPS pengulangan polisakarida antigen- O luar [ [ 4 ] ]; eksopolisakarida dan kapsul, yang merupakan polisakarida ekstraseluler dengan berat molekul tinggi dengan komposisi yang bervariasi tergantung pada spesies [ [ 5 , 6 ] ]; dan glukan periplasma yang diatur osmoregulasi, yang terdiri dari tulang punggung β-glukan yang dapat dimodifikasi dengan substituen yang berbeda [ [ 7 ] ]. Glikosilasi protein juga terjadi pada bakteri—baik glikosilasi O , di mana asam amino yang dimodifikasi adalah serin atau treonin, dan glikosilasi N , di mana asam amino yang dimodifikasi adalah asparagin (yang terakhir hanya dijelaskan pada bakteri Gram-negatif) [ [ 8 ] ]. Biosintesis dan struktur glikana ini bisa sangat berbeda dari eukariota.
Tinjauan ini berfokus pada sistem glikosilasi protein pada bakteri, dan khususnya pada sistem glikosilasi O unik yang ada pada spesies filum Bacteroidota [ [ 9 ] ]. Fungsi sistem ini masih belum jelas, tetapi sistem ini berperan dalam kelangsungan hidup spesies ini di lingkungan alaminya. Hal ini memiliki konsekuensi penting bagi kesehatan manusia, karena spesies filum Bacteroidota termasuk spesies yang paling melimpah dan umum dalam mikrobioma usus manusia [ [ 10 ] ].
Glikosilasi protein bakteri
Pada bakteri, empat jalur glikosilasi protein yang berbeda telah diidentifikasi, dua jenis bertanggung jawab untuk N -glikosilasi dan dua untuk O -glikosilasi.
Jalur N- glikosilasi kanonik menyusun glikana dari monosakarida yang diaktifkan nukleotida secara bertahap ke undecaprenyl fosfat (Und-P), setelah itu glikana lengkap dibalik melintasi membran dalam ke periplasma [ [ 1 , 8 ] ]. Ini diikuti oleh transfer glikana ke residu asparagin dalam motif D/E-X1-N-X2-S/T (di mana X1 dan X2 tidak dapat berupa prolin) dalam protein yang berbeda.
Jalur N -glikosilasi bakteri nonkanonik mentransfer monosakarida dari prekursor yang diaktifkan nukleotida langsung ke protein dalam sitoplasma [ [ 1 , 8 ] ]. Berbeda dengan N -glikosilasi eukariotik, tidak ada struktur inti N -glikana yang terkonservasi yang telah diamati pada bakteri [ [ 11 ] ]. Protein N -glikosilasi telah terbukti penting untuk kelangsungan hidup bakteri, adhesi, autoagregasi, dan patogenisitas pada bakteri Gram-negatif, tetapi belum diidentifikasi pada bakteri Gram-positif.
Untuk O -glikosilasi, satu jalur bersifat independen oligosakaril transferase (OTase) dan hadir pada bakteri Gram-negatif dan positif. Jalur ini menggunakan monosakarida yang diaktifkan nukleotida sebagai donor untuk glikosiltransferase terlarut yang hadir dalam sitoplasma, memfasilitasi penambahan monosakarida secara bertahap ke protein [ [ 1 ] ]. Fungsi utamanya adalah O -glikosilasi flagela dan adhesin (protein ekstraseluler) [ [ 13 ] ]. Untuk O -glikosilasi flagela , tidak ada urutan pengenalan asam amino di luar S/T yang dimodifikasi telah diidentifikasi [ [ 13 ] ]. Pada adhesin, O -glikosilasi terjadi di daerah dengan pengulangan kaya serin dan treonin [ [ 14 ] ]. O – glikana bervariasi dalam struktur dari monosakarida tunggal hingga oligosakarida lebih dari 10 gula, dan penting untuk perakitan filamen, motilitas bakteri, perlekatan, dan pembentukan biofilm [ [ 13 , 14 ] ].
Jenis lain dari O -glikosilasi bergantung pada OTase dan terutama terdapat pada bakteri Gram-negatif [ [ 1 ] ]. Jenis glikosilasi ini tidak terjadi pada eukariota tetapi mengingatkan pada jalur N -glikosilasi eukariota, jalur N -glikosilasi kanonik pada bakteri dan bahkan bagian dari jalur biosintesis LPS pada bakteri Gram-negatif [ [ 11 ] ]. Seperti jalur N -glikosilasi kanonik, ia menggunakan monosakarida yang diaktifkan oleh nukleotida dan merakit glikana terlebih dahulu ke Und-P pada sisi sitosolik sebelum dibalik ke periplasma oleh flippase. Glikana kemudian ditambahkan ke serin atau treonin pada protein target oleh O -OTase di periplasma.
Sistem O- glikosilasi unik Bacteroidota
Berbeda dengan N -glikosilasi bakteri, O -glikosilasi umumnya tidak terjadi pada motif urutan tertentu, dan lokasi glikana sulit diprediksi [ [ 14 ] ]. Satu-satunya pengecualian yang diketahui sejauh ini adalah jenis O -glikosilasi unik dalam filum Bacteroidota. Jenis O -glikosilasi bakteri ini pertama kali ditunjukkan pada F. meningosepticum , di mana ia terjadi pada serin dan treonin yang didahului oleh asam aspartat dan diikuti secara istimewa oleh asam amino hidrofobik [ [ 15 , 16 ] ].
Glikosilasi O -spesifik Bacteroidota didorong oleh motif urutan pada protein nonsitoplasma
Preferensi sekuens untuk motif glikosilasi telah menjadi jelas setelah beberapa analisis glikoproteomik (Gbr. 1A ). Asam aspartat hampir selalu mendahului residu glikosilasi, dan substitusi dengan asam amino yang paling mirip (asam glutamat) tidak ditoleransi dalam B. fragilis [ [ 9 ] ], tetapi telah diamati pada kesempatan langka pada spesies lain [ [ 17 , 18 ] ]. Pada semua spesies, ada sedikit preferensi untuk serin daripada treonin pada posisi yang diglikosilasi (Gbr. 1A , Gbr. S1a ), dan asam amino yang mengikuti tidak dipengaruhi oleh identitas residu glikosilasi (Gbr. S1c ). Spesies yang berbeda tampaknya memiliki preferensi untuk residu terakhir ini dalam motif [ [ 19 , 20 ] ], yang paling umum adalah salah satu residu hidrofobik leusin, isoleusin, valin, treonin, alanin, serin, atau metionin, dalam urutan ini. Glisin, fenilalanin, dan sistein juga kadang-kadang terdeteksi (Gbr. S1b ), tetapi upaya untuk memperkenalkan glisin pada posisi ini dengan manipulasi genetik B. fragilis mengakibatkan hilangnya glikosilasi [ [ 9 ] ]. Jenis O -glikosilasi ini tampaknya melimpah di Bacteroidota, karena sekitar setengah dari protein nonsitoplasma mengandung motif glikosilasi dan serin atau treonin dalam motif umumnya hampir sepenuhnya tersubstitusi (setidaknya ketika mempertimbangkan motif yang lebih umum) [ [ 15 , 18 – 24 ] ]. Selain itu, pengenalan motif glikosilasi yang direkayasa ke dalam protein menyebabkan glikosilasinya [ [ 21 ] ]. Bahkan dimungkinkan untuk melakukan glikosilasi silang protein oleh spesies yang berbeda, karena pengenalan protein B. fragilis ke dalam T. forsythia menghasilkan glikosilasi protein tersebut dengan O- glikana T. forsythia dan sebaliknya [ [ 23 ] ].
 Gbr. 1
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Sistem glikosilasi O yang unik dari Bacteroidota terjadi pada motif spesifik di daerah larut protein nonsitoplasma. (A) Preferensi urutan peptida glikosilasi O dari analisis ulang glikoproteom yang diperoleh sebelumnya [ [ 17 – 20 , 24 ] ] menunjukkan bahwa asam amino glikosilasi (serin atau treonin) hampir selalu didahului oleh residu asam aspartat dan lebih disukai diikuti oleh residu hidrofobik. Asam amino L/I/V/T/A/S bersama-sama membentuk sekitar 90% asam amino yang ditemukan hilir residu glikosilasi, dengan M/F/C/G tidak umum sekitar 2% masing-masing dan N/E/Q/P/D memiliki kejadian kurang dari 1%. (B) Protein glikosilasi diperkaya dalam protein transmembran dan yang mengandung peptida sinyal seperti yang diprediksi oleh DeepTMHMM [ [ 25 ] ], yang menunjukkan bahwa glikosilasi hanya terjadi pada protein nonsitoplasma. (C) Contoh situs glikosilasi terukur di daerah larut dari dua protein Flavobacterium johnsoniae [ [ 19 ] ]. Untuk protein transmembran (A5F9W0), motif periplasma dan ekstraseluler dapat diglikosilasi. Protein disebut dengan nomor entri UniProt, dan situs glikosilasi didasarkan pada identifikasi sebelumnya [ [ 19 ] ].
Glikoprotein O yang diidentifikasi dalam berbagai spesies Bacteroidota sebagian besar terlokalisasi di periplasma, dan membran dalam dan luar (Gbr. 1B ) [ [ 9 , 17 – 21 , 24 , 26 ] ]. Sebagian besar situs O -glikosilasi terletak di daerah protein yang larut, dengan protein transmembran yang memiliki situs glikosilasi sebagian besar menghadap periplasma, tetapi secara sporadis juga menghadap bagian luar sel (Gbr. 1C ) [ [ 17 , 19 , 24 ] ].
O- glikosilasi tersebar luas di filum Bacteroidota
Motif glikosilasi diperkaya terutama di Bacteroidota jika dibandingkan dengan semua spesies bakteri lainnya (Gbr. 2A ). Motif ini tampak diperkaya di hampir semua famili dalam filum, tetapi tidak di semua spesies. Ini menunjukkan bahwa motif ini berevolusi pada nenek moyang umum awal klade ini. Dari semua spesies Bacteroidota, O-glikana hanya sebagian atau sepenuhnya dikarakterisasi untuk segelintir spesies yang tersebar jarang di seluruh filum (Gbr. 2B ) [ [ 16-21 , 24 , 27-29 ] ] . Untuk sebagian besar spesies, protein umumnya dimodifikasi dengan glikoform yang sama, tetapi struktur ini bervariasi dari spesies ke spesies (Gbr. 2C ). Untuk beberapa spesies, ada sedikit variasi glikoform yang hadir dalam kelimpahan yang lebih rendah [ [ 19 , 24 ] ]. Tampaknya ada trisakarida umum pada ujung reduksi glikana yang terdiri dari heksosa (manosa), deoksiheksosa (ramnosa), dan asam heksuronat (asam glukuronat). Satu-satunya pengecualian untuk ini adalah spesies Tannerella yang diselidiki , tetapi spesies ini tampaknya berbeda dari spesies lain yang dikarakterisasi, karena mereka terutama mengglikosilasi dua protein lapisan-S [ [ 18 , 26 ] ]. T. forsythia disarankan memiliki beberapa glikoform berlimpah yang berbeda yang spesifik untuk motif glikosilasi yang berbeda [ [ 20 ] ], dan beberapa strain menukar residu asam pseudaminat dengan stereoisomernya asam legionaminat [ [ 30 ] ]. T. serpentiformis memiliki dua glikoform berlimpah yang berbeda yang menunjukkan preferensi untuk situs glikosilasi spesifik pada protein [ [ 18 ] ]. Glikana luar menunjukkan keragaman struktural antara spesies, tetapi spesies yang terkait erat memiliki glikana luar yang lebih mirip secara struktural (Gbr. 2C ).
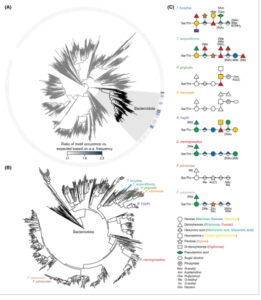 Gambar 2
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Distribusi filogenetik dari O -glikana yang saat ini dikarakterisasi. (A) Pohon filogenetik bakteri, termasuk strain representatif dari setiap genus untuk setiap cabang seperti yang didefinisikan oleh Genome Taxonomy Database [ [ 31 ] ], dan dengan filum Bacteroidota disorot. Cincin luar mewakili rasio frekuensi motif glikosilasi DS/TA/L/V/I/M/T dalam protein nonsitoplasma yang diprediksi dengan yang diharapkan secara kebetulan, yang memperhitungkan frekuensi asam amino spesifik spesies. (B) Pohon filogenetik Bacteroidota, termasuk strain representatif dari setiap spesies dengan spesies yang O- glikoproteomnya telah dikarakterisasi secara kimia disorot. (C) Struktur kimia dari O- glikana yang dikarakterisasi dalam spesies yang berbeda [ [ 16 – 21 , 24 , 27 – 29 ] ].
Jalur biosintesis O- glikana dilestarikan di seluruh spesies
Jalur biosintesis glikana ini pertama kali dijelaskan dalam B. fragilis , di mana daerah genom yang mengandung flippase dan beberapa glikosiltransferase diidentifikasi dan disebut lokus glikosilasi fragilis (LFG) [ [ 9 ] ]. Lokus homolog pada spesies lain dari genus Bacteroides kemudian diidentifikasi (beberapa spesies ini sekarang dianggap sebagai genus terpisah) [ [ 22 ] ]. Lokus-lokus ini berbagi organisasi genetik yang sama, dimulai dengan metionil-tRNA sintetase ( metG ) diikuti oleh flippase wzx dan diakhiri dengan dua glikosiltransferase yang homolog di semua spesies (Gbr. 3A ). Di antara gen-gen ini terdapat serangkaian protein lain yang bervariasi dari spesies ke spesies, dengan sebagian besar dari mereka diprediksi sebagai glikosiltransferase berdasarkan urutan dan homologi struktural. Glikosiltransferase ini sebagian besar belum dikarakterisasi, dan hanya untuk beberapa contoh kita mengetahui monosakarida mana yang mereka tambahkan ke glikan [ [ 23 , 24 , 29 , 30 , 32 , 33 ] ]. Penghapusan lokus ini (dari flippase wzx ke glikosiltransferase terakhir) menghapuskan sebagian besar glikan, hanya menyisakan heksosa dan deoksiheksosa yang umum pada sebagian besar spesies yang dikarakterisasi hingga saat ini (Gbr. 2C ). Dengan demikian, sebuah model telah diusulkan di mana glikan disintesis dalam dua langkah independen (Gbr. 3B ): disakarida inti yang lebih kekal dan yang mesinnya dikodekan di tempat lain dalam genom; dan glikan luar yang sangat bervariasi dan dikodekan oleh gen dalam LFG [ [ 22 ] ]. Dalam homologi dengan jalur O -glikosilasi yang bergantung pada OTase , diperkirakan bahwa setiap glikana dirakit dari monosakarida yang diaktifkan oleh nukleotida pada sisi sitosol membran dalam sebelum dibalik ke periplasma dan ditransfer ke protein oleh OTase untuk glikan inti dan oleh ligase untuk glikan luar. Flippase untuk glikan inti, dan OTase dan ligase masih belum ditemukan. O -glikana akhir umumnya dimodifikasi dengan gugus asetil dan metil, dan dalam kasus yang jarang terjadi dengan gugus fosfat, asetamidin, amino, gliseroil, glisero, dan/atau gula alkohol (Gbr. 2C ). Saat ini tidak diketahui apakah modifikasi ini sudah ada pada monosakarida yang diaktifkan oleh nukleotida atau apakah mereka diperkenalkan setelah perakitan glikan.
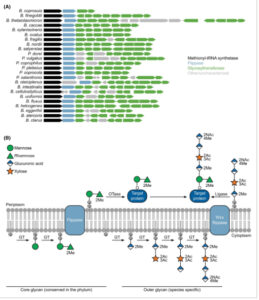 Gambar 3
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Biosintesis O- glikana Bacteroidota . (A) Mesin enzimatik yang diperlukan untuk sintesis O- glikana dikelompokkan dalam lokus genetik dengan struktur serupa di seluruh spesies, tetapi menunjukkan keragaman pada gen yang ada. Fungsi yang diusulkan didasarkan pada homologi struktural dengan protein lain di UniProt menggunakan Foldseek [ [ 34 ] ]. (B) Model yang diusulkan untuk langkah-langkah biosintesis seperti yang dijelaskan sebelumnya [ [ 22 ] ] dan di sini dicontohkan untuk spesies Flavobacterium columnare . Dua glikana terpisah disintesis pada pembawa lipid Und-P dalam sitoplasma oleh glikosiltransferase (GT). GT yang menambahkan monomer gula spesifik sebagian besar tidak berkarakterisasi. Glikana inti (dilestarikan di seluruh filum), dan glikana luar (spesifik spesies) diusulkan untuk disintesis secara terpisah. Kedua glikana dibalikkan ke periplasma oleh flippase, dan glikana inti diperkirakan melekat pada protein target oleh oligosakaril transferase (OTase). Ligase kemudian menambahkan glikana luar ke glikana inti. Me: O -metil; Ac: O -asetil; NAc: N -asetil.
Prospek masa depan
Beberapa aspek dari O -glikana ini memerlukan penyelidikan lebih lanjut, seperti fungsinya, keragaman keseluruhan struktur glikana, dan jalur biosintesis lengkapnya.
Fungsi glikosilasi O -spesifik Bacteroidota masih belum sepenuhnya dipahami
Fungsi dari O -glikana ini saat ini sebagian besar belum diketahui. Penghapusan glikana luar menyebabkan penurunan jumlah sel B. fragilis yang hidup di semua tahap pertumbuhan [ [ 9 ] ]. Hal ini dapat menyiratkan bahwa glikana meningkatkan stabilitas protein dengan mencegah denaturasi atau degradasi proteolitik. Hal ini dapat dipelajari pada tingkat proteom dengan mengukur stabilitas termal protein [ [ 35 , 36 ] ] atau stabilitas proteolitik [ [ 37 , 38 ] ], sehingga akan menarik untuk menggunakan pendekatan tersebut dalam konteks ini.
Glikana ini juga mungkin penting untuk interaksi dengan inang, karena mutan delesi glikana luar dapat menjajah usus tikus, tetapi memiliki kerugian kebugaran ketika bersaing dengan strain tipe liar [ [ 9 ] ]. Selain itu, pemotongan glikana pada T. forsythia menyebabkan infiltrasi neutrofil yang dimediasi Th17 yang lebih tinggi pada jaringan gingiva [ [ 26 , 30 , 32 ] ] dan berkurangnya tingkat biofilm [ [ 39 , 40 ] ]. Rantai gula protein mirip OmpA dari spesies yang sama berinteraksi dengan beberapa selectin dan siglec [ [ 41 ] ], dan asam pseudaminat dan asam legionaminat yang ada dalam glikana T. forsythia mungkin berfungsi sebagai tiruan molekuler asam sialik eukariotik untuk menghindari respons imun inang [ [ 30 ] ]. Lipoprotein O -glikosilasi juga telah terbukti hadir di vesikel membran luar (OMV), yang diduga mengalihkan respons sistem imun dari sel bakteri [ [ 42 ] ].
Namun, tidak semua spesies filum Bacteroidota berasosiasi dengan inang. Misalnya, beberapa spesies Flavobacteria menempati habitat laut dan tanah. Bersama dengan fakta bahwa mesin yang bertanggung jawab atas sintesis glikana luar tampaknya dilestarikan di sebagian besar galur dari spesies yang sama [ [ 22 ] ], ini menunjukkan bahwa ada tekanan selektif bagi anggota spesies yang sama untuk memodifikasi protein mereka dengan struktur glikana yang sama, yang dapat menyiratkan bahwa mereka digunakan untuk pengenalan diri. Penelitian lebih lanjut diperlukan untuk mengidentifikasi interaksi spesifik glikana dengan biomolekul lainnya.
Luasnya keragaman struktural masih harus dieksplorasi
Pandangan kita saat ini tentang keragaman kimia glikana ini terbatas pada sejumlah kecil spesies dalam famili terbatas (Gbr. 2B ), dengan hanya beberapa dari mereka yang sepenuhnya dikarakterisasi dalam hal komposisi monosakarida dan jenis hubungan yang tepat (Gbr. 2C ). Memperluas karakterisasi ini ke sejumlah besar spesies filum Bacteroidota mungkin mengungkapkan lebih banyak monosakarida dan modifikasi spesifik bakteri. Saat ini, satu-satunya cara untuk mencapai ini adalah dengan pemurnian glikana dan penentuan struktur dengan resonansi magnetik nuklir. Analisis yang lebih luas pada spesies lain dapat mempercepat karakterisasi langsung dari data spektrometri massa, karena monosakarida spesifik dan jenis hubungan telah terbukti menghasilkan intensitas ion fragmen yang dapat diprediksi [ [ 43 ] ].
Lebih jauh, mungkin menarik untuk memperluas analisis ini ke filum saudara Fibrobacterota, yang menunjukkan pengayaan serupa dalam konservasi motif glikosilasi dan berbagi akar evolusi yang sama (Gbr. 2A ). Ini akan memungkinkan penentuan asal usul sistem glikosilasi ini.
Jalur biosintesis lengkap belum dikarakterisasi
Glikosiltransferase yang bertanggung jawab untuk mensintesis glikana luar tampaknya terletak di satu lokus tunggal di beberapa Bacteroides dan genera terkait (LFG). Namun, tampaknya lokus ini tidak dilestarikan di seluruh filum Bacteroidota. Misalnya, dalam P. gingivalis , homolog protein LFG B. fragilis tampaknya tidak terletak berdekatan dalam genom [ [ 24 , 29 ] ]. Dengan beberapa pengecualian [ [ 23 , 24 , 29 , 30 , 32 , 33 ] ], reaksi spesifik yang dikatalisis oleh setiap glikosiltransferase dalam lokus ini juga sebagian besar tidak diketahui. Pekerjaan biologi molekuler dan biokimia terperinci untuk menghapus atau memurnikan setiap komponen diperlukan.
Selain itu, mesin yang bertanggung jawab untuk sintesis inti glikana yang dibagi antar spesies belum diidentifikasi (Gbr. 3B ). Jalur ini menyerupai sistem O- mannosilasi eukariotik [ [ 44 ] ] dan dengan demikian mencari homolog sistem tersebut pada spesies ini dapat memberikan wawasan tentang protein yang terlibat.
Kesimpulan
Meskipun kemajuan substansial telah dibuat untuk mengkarakterisasi sistem glikosilasi ini, mempelajarinya secara lebih rinci dapat membuka strategi untuk memodulasi komposisi mikrobioma usus. Anggota filum Bacteroidota umumnya dianggap sebagai spesies kunci untuk mikrobioma yang sehat tetapi kadang-kadang dikaitkan dengan penyakit [ [ 45 ] ]. Penghambatan glikosiltransferase spesifik untuk mengubah glikana luar dapat mengubah kebugaran bakteri tertentu dan dengan demikian memungkinkan penargetan spesies tertentu. Strategi lain adalah dengan menggunakan galur rekayasa genetika dengan glikana spesifik yang dapat menempati ceruk unik di dalam usus. Akhirnya, glikana ini dapat menjadi target potensial untuk antibodi yang ditargetkan OMV dan pengembangan vaksin untuk penyakit sistemik yang terkait dengan Bacteroidota dan OMV mereka [ [ 42 ] ].
