Abstrak
Mediator utama untuk penyerapan asam amino dalam Saccharomyces cerevisiae adalah permease yang termasuk dalam famili transporter asam amino ragi. Baru-baru ini, kami menemukan bahwa anggota famili ini mendukung pertumbuhan pada lebih banyak asam amino daripada yang dijelaskan sebelumnya. Di sini kami mempelajari spektrum substrat Lyp1, transporter utama yang bertanggung jawab untuk penyerapan lisin dalam ragi. Kami menunjukkan bahwa Lyp1 yang diekspresikan secara berlebihan mendukung pertumbuhan pada alanin, asparagin, leusin, metionin, fenilalanin, serin, dan valin ketika ini disediakan sebagai satu-satunya sumber nitrogen untuk strain yang sangat kekurangan penyerapan asam amino. Kami menunjukkan bahwa alanin dan serin bersaing dengan lisin untuk sistem transportasi umum, meskipun dengan afinitas yang jauh lebih rendah. Dengan demikian, Lyp1 memiliki spektrum substrat yang jauh lebih luas daripada yang diperkirakan sebelumnya, yang mungkin berlaku untuk banyak transporter asam amino.
Singkatan
AAP3 , asam amino permease 3
ADH1 , alkohol dehidrogenase 1
AdiC , antiporter arginin/agmatin
APC , asam amino-poliamina-organokation
Bap2 , permease asam amino rantai cabang 2
Can1 , resistensi kanavanin terhadap permease 1
GABA , asam gamma-aminobutyric
GAL1 , galaktokinase 1
Gap1 , permease asam amino umum 1
GFP , protein fluoresensi hijau
Ikatan H , ikatan hidrogen
Hxt7 , transporter heksosa 7
KP , penyangga kalium fosfat
KPC , penyangga kalium-fosfat-asam sitrat
Leu-T , transporter leusin
Lyp1 , permease spesifik lisin 1
PAT1 , transporter asam amino berpasangan proton 1
PAT2 , transporter asam amino berpasangan proton 2
PMF , gaya gerak proton
PrnB , dugaan prolin permease
RMSD , deviasi akar kuadrat rata-rata
SD , simpangan baku
SEM , kesalahan standar rata-rata
TM , transmembran
Vba5 , transporter asam amino basa vakuolar 5
YAT , transporter asam amino ragi
YB , dasar ragi
YNB , basa nitrogen ragi
Asam amino adalah nutrisi penting, menyediakan tidak hanya sumber karbon dan nitrogen untuk organisme seperti Saccharomyces cerevisiae , tetapi juga berfungsi sebagai blok pembangun untuk biosintesis protein, senyawa pensinyalan, dan metabolit sekunder [ [ 1 ] ]. Bukti pertama untuk akumulasi asam amino yang disediakan secara eksternal di dalam sel ragi diterbitkan pada tahun 1955, dan segera setelah itu, pembawa asam amino pertama yang bertanggung jawab untuk impor asam amino dikarakterisasi [ [ 2 , 3 ] ]. Dalam S. cerevisiae , transporter utama yang memediasi impor asam amino dan analognya melintasi membran plasma termasuk dalam keluarga transporter asam amino ragi (YAT), yang terdiri dari 18 paralog [ [ 4 ] ].
Transporter YAT berkisar dari spesialis, yang menerima satu atau beberapa substrat asam amino, hingga generalis, yang mengenali berbagai macam substrat [ [ 4 – 6 ] ]. Pengangkutan zat terlarut oleh simporter YAT didorong oleh gaya motif proton (PMF), dan penyerapan asam amino ke dalam sel digabungkan dengan impor proton. Ketika PMF dihamburkan, sebagian besar asam amino keluar dari sel menuruni gradien konsentrasinya [ [ 7 , 8 ] ]. Meskipun belum ada data struktural yang menjelaskan mekanisme pasti dari pengangkutan asam amino dan proton yang digabungkan, pemodelan struktur YAT dan studi mutagenesis telah menjelaskan lipatan struktural Leu-T yang diprediksi dan gerakan akses bergantian dari transporter [ [ 9 – 16 ] ].
Transporter utama untuk penyerapan lisin, Lyp1, dicirikan oleh kinetika transpor asimetris, dengan afinitas untuk impor asam amino menjadi 3-4 kali lipat lebih tinggi daripada afinitas untuk efluks [ [ 6 , 17 ] ]. Unidireksionalitas ini mengarah pada akumulasi lisin yang tinggi di dalam sel ragi [ [ 17 , 18 ] ]. Dalam kondisi pembatasan nitrogen, akumulasi lisin dapat menghambat pertumbuhan S. cerevisiae [ [ 19 , 20 ] ]. Namun, dalam kondisi oksidatif, lisin yang terakumulasi secara berlebihan disalurkan menuju metabolit sekunder, dan pemrograman ulang metabolik sel berikutnya memberikan toleransi terhadap stres [ [ 21 ] ]. Dengan meningkatnya masuknya lisin, ekor sitosolik N-terminal, yang terdiri dari 110 residu pertama protein, mengalami ubikuitinasi, yang menandakan penurunan regulasi endositosis transporter [ [ 22 ] ]. Analisis in silico dan studi fungsional mengungkapkan bahwa, dari 12 heliks transmembran transporter, residu dalam heliks 3 dan 10 penting untuk spesifisitas substrat, sedangkan loop ekstraseluler ketiga berperan dalam lokalisasi dan aktivitas spesifik transporter [ [ 10 , 18 ] ].
Sampai saat ini, lisin adalah satu-satunya substrat Lyp1 yang diketahui yang penyerapannya telah dijelaskan secara kinetik. Baru-baru ini, kami menunjukkan bahwa kisaran substrat transporter lebih besar dari yang diperkirakan sebelumnya [ [ 5 ] ]. Penyerapan Met oleh Lyp1 telah ditunjukkan di masa lalu, sementara potensi pengangkutan His dan Orn telah disarankan oleh eksperimen pertumbuhan dan efek penghambatan asam amino ini pada pengangkutan lisin [ [ 19 , 23 ] ]. Meskipun demikian, afinitas Lyp1 untuk substrat selain lisin belum dijelaskan dan diperkirakan sangat rendah [ [ 19 , 24 ] ].
Di sini, kami menjelaskan spektrum substrat Lyp1. Kami menemukan bahwa ekspresi berlebih Lyp1 dapat mendukung pertumbuhan dalam media minimal di mana Ala, Asn, Leu, Met, Phe, Ser, atau Val hadir sebagai satu-satunya sumber nitrogen untuk galur S. cerevisiae yang sangat kekurangan penyerapan asam amino. Kami juga menunjukkan bagaimana laju pertumbuhan spesifik S. cerevisiae pada setiap asam amino bergantung pada konsentrasinya. Kami menunjukkan bagaimana identifikasi substrat dapat dikaburkan dalam uji transpor ketika konstanta afinitas nyata untuk asam amino berada dalam kisaran milimolar. Kami selanjutnya menjelaskan efek penghambatan kompetitif Ala dan Ser pada transpor Lys dan menunjukkan bahwa transporter menunjukkan afinitas rendah untuk kedua asam amino ini, meskipun faktanya mereka memungkinkan pertumbuhan cepat ketika disediakan sebagai satu-satunya sumber nitrogen.
Bahan dan metode
Plasmid DNA, strain ragi dan media
Galur S. cerevisiae Δ10AA (MATa, gap1-1 put4-1 uga4-1 Δcan1::HisGΔlyp1- alp1::HisGΔhip1::HisGΔdip5::HisG Δgnp1Δagp1 ura3-1 ) [ [ 25 ] ] ditransformasikan dengan plasmid multikopi pADHXC3GH atau pADHXC3GH- LYP1 seperti yang dijelaskan dalam [ [ 5 ] ]. pADHXC3GH berasal dari pYEXC3GH, di mana promotor GAL1 ditukar dengan promotor ADH1 konstitutif S. cerevisiae . LYP1 diekspresikan sebagai protein fusi dengan situs pembelahan 3C N-terminal, yeGFP, dan tag His 10 .
Galur S. cerevisiae ditumbuhkan baik pada media YNB padat (6,9 g·L −1 media nitrogen ragi tanpa asam amino (Formedium), 20 g·L −1 glukosa, pH 5,7; disaring steril) atau pada media YB cair (1,9 g·L −1 YNB tanpa asam amino dan tanpa amonium sulfat (Formedium), 20 g·L −1 glukosa, pH 5,7; disaring steril) yang dilengkapi dengan sumber nitrogen spesifik (larutan stok asam amino yang disaring steril) sesuai kebutuhan. Urutan plasmid tersedia di Zenodo DOI: 10.5281/zenodo.14752041 .
Uji pertumbuhan
Uji pertumbuhan S. cerevisiae Δ10AA pADHXC3GH- LYP1 dan kontrol dilakukan seperti yang dijelaskan dalam [ [ 5 ] ]. Laju pertumbuhan diperoleh berdasarkan model pertumbuhan Baranyi, menggunakan paket laju pertumbuhan dalam R [ [ 26 ] ]. Kode, data mentah, dan analisis statistik tersedia di Zenodo DOI: 10.5281/zenodo.14752041 .
Hipotesis nol untuk perbedaan antara laju pertumbuhan rata-rata Δ10AA yang mengekspresikan Lyp1 dan strain kontrol diuji dengan uji- t Student ( P < 0,05) [ [ 27 ] ]. Untuk analisis statistik, replikasi teknis tambahan dari strain yang mengekspresikan Lyp1 (termasuk tiga replikasi biologis) serta lima kontrol vektor diambil dari [ [ 5 ] ] dan ditambahkan ke analisis, menghasilkan jumlah akhir enam replikasi untuk setiap sampel.
Untuk mempelajari ketergantungan laju pertumbuhan pada konsentrasi substrat, model empiris Monod digunakan seperti yang dijelaskan oleh persamaan:
![]() di mana μ max adalah laju pertumbuhan spesifik maksimum [h −1 ], [ S ] adalah konsentrasi substrat [m m ], dan K s adalah konstanta setengah-jenuh untuk zat terlarut [m m ] [ [ 28 ] ]. Untuk pemasangan model dan perhitungan K s dan μ max , GraphPad Prism (10.4.0) digunakan.
di mana μ max adalah laju pertumbuhan spesifik maksimum [h −1 ], [ S ] adalah konsentrasi substrat [m m ], dan K s adalah konstanta setengah-jenuh untuk zat terlarut [m m ] [ [ 28 ] ]. Untuk pemasangan model dan perhitungan K s dan μ max , GraphPad Prism (10.4.0) digunakan.
Uji transportasi in vivo
Uji transpor in vivo untuk penyerapan asam amino berlabel radioaktif (PerkinElmer) dilakukan seperti yang dijelaskan dalam [ [ 5 ] ]. Kultur dicuci sebelum pengujian dengan 100 m m buffer KPC pH 5 (10 m m glukosa, 100 m m K 2 HPO 4 /buffer asam sitrat) untuk penyerapan Ala, Lys, Phe, Ser, dan Val berlabel radioaktif. Selain itu, penggunaan 100 m m buffer KPC pH 6 diuji untuk penyerapan Ala dan Ser berlabel radioaktif, dan penggunaan 100 m m buffer KP pH 6 (10 m m glukosa, 13,4 m m K 2 HPO 4 , 86,8 m m KH 2 PO 4 ) diuji untuk penyerapan Lys berlabel radioaktif.
Reaksi penyerapan dimulai dengan menambahkan 0,45 μCi·mL −1 dari 14 C-Ala pada konsentrasi akhir 20 μm atau 60 mm , atau 0,45 μCi·mL −1 dari 14 C-Lys pada konsentrasi akhir 20 μm , atau 0,45 μCi·mL −1 dari 14 C-Phe pada konsentrasi akhir 2 mm , atau 0,04 μCi·mL −1 dari 14 C-Ser pada konsentrasi akhir 2 mm , atau 0,11 μCi·mL −1 dari 14 C-Ser pada konsentrasi akhir 40 mm , atau 0,11 μCi·mL −1 dari 14 C-Val pada konsentrasi akhir 2 mm , atau 0,11 μCi·mL −1 dari 14 C-Ser pada konsentrasi akhir 30 mm. konsentrasi akhir 2 mm . Untuk mempelajari kinetika penyerapan Lys, 0,11 μCi·mL −1 dari 14 C-Lys pada konsentrasi akhir berkisar antara 1 hingga 50 mm ditambahkan . Untuk mempelajari efek penghambatan Ala dan Ser, 0,11 μCi·mL −1 dari 14 C-Lys pada konsentrasi akhir 1 mm atau 4 mm atau 10 mm dengan beberapa konsentrasi Ala atau Ser (dari 0 hingga 140 mm ) ditambahkan. Radioaktivitas ditentukan dengan penghitungan sintilasi cair pada penganalisa sintilasi cair Tri-Carb 2800TR (PerkinElmer).
Laju penyerapan dihitung dalam amol/(sel × menit), dengan mengonversi nilai OD 600 ke jumlah sel yang dihitung dengan bilik hitung Thoma. Hipotesis nol bahwa laju penyerapan rata-rata Δ10AA yang mengekspresikan Lyp1 tidak berbeda dari nilai tetap strain dengan kontrol vektor diuji dengan uji- t satu sampel ( P < 0,05) [ [ 27 ] ].
Untuk mempelajari kinetika Lys, model Michaelis–Menten digunakan seperti yang dijelaskan oleh persamaan:
![]() di mana V max adalah kecepatan protein maksimum [amol/(sel × min)], [ S ] adalah konsentrasi substrat [μ m ] dan K m adalah konstanta Michaelis [μ m ] [ [ 29 ] ]. Untuk pemasangan model dan perhitungan K m dan V max , GraphPad Prism (10.4.0) digunakan.
di mana V max adalah kecepatan protein maksimum [amol/(sel × min)], [ S ] adalah konsentrasi substrat [μ m ] dan K m adalah konstanta Michaelis [μ m ] [ [ 29 ] ]. Untuk pemasangan model dan perhitungan K m dan V max , GraphPad Prism (10.4.0) digunakan.
Jenis penghambatan Ala dan Ser pada penyerapan Lys ditentukan dari analisis Lineweaver–Burk. Ki untuk Ala dan Ser dihitung dari plot Dixon masing – masing. Analisis statistik dan hasil pemasangan tersedia di Zenodo DOI: 10.5281/zenodo.14752041 .
Pengujian lokalisasi
Pencitraan sel fluoresensi dari sel yang mengekspresikan Lyp1-GFP dilakukan pada mikroskop pemindai laser confocal Zeiss LSM 710, yang dilengkapi dengan lensa objektif C-Apochromat 40×/1.2 NA dengan laser ion argon biru (488 nm). Gambar sel hidup dalam Isotope Buffer diperoleh, dengan bidang fokus diposisikan di bagian tengah sel.
Docking substrat
Untuk docking substrat yang berbeda pada model AlphaFold Lyp1 (AF-P32487), alat AutoDock Vina dari Chimera (1.17.1) digunakan [ [ 30 , 31 ] ]. Situs pengikatan ditentukan setelah penyelarasan struktural Lyp1 yang terpotong di N- dan C-terminal (asam amino 112–548) dengan AdiC yang terpotong (PDB: 3OB6 ; asam amino 11–428) di ChimeraX (1.8) [ [ 32 ] ]. Untuk penyelarasan sekuens berpasangan, algoritma Needleman–Wunsch dengan matriks BLOSUM-12 dan penalti perpanjangan celah sebesar 1 digunakan. Penyelarasan struktur sekunder didasarkan pada pasangan rantai yang paling selaras antara kedua struktur. Untuk itu, bobot kesamaan residu sebesar 0,3 digunakan dengan penalti celah intra-heliks dan intra-untai tambahan sebesar 18 dan penalti celah lainnya sebesar 6. Untuk pemasangan, atom-atom Ca dari residu yang selaras dengan urutan dipasangkan, menghasilkan RMSD untuk sebagian besar asam amino serupa secara struktural yang digunakan untuk pemasangan (RMSD fit ) dan RMSD global untuk seluruh protein (RMSD global ).
Penentuan situs pengikatan Lyp1 didasarkan pada posisi dan residu yang berinteraksi dari AdiC yang selaras dalam kompleks dengan substratnya Arg. Kisi docking ditetapkan pada 14 × 15 × 17 Å, dengan pusat massa ligan mewakili pusat kisi. Aplikasi docking dilakukan dengan menggunakan kelengkapan pencarian global sebesar 8. Interaksi ikatan hidrogen antara Lyp1 dan setiap substrat yang di-docking diperoleh dalam ChimeraX (1.8), dengan toleransi jarak 0,4 Å dan toleransi sudut 20°.
Pilihan konformasi terbaik untuk setiap substrat didasarkan pada inspeksi visual setiap pose dan perbandingan dengan struktur AdiC-Arg, energi bebas pengikatan ( s -skor), akurasi docking, dan jumlah, panjang, dan jenis ikatan hidrogen yang diprediksi antara donor dan akseptor [ [ 33 – 36 ] ]. Menurut parameter tersebut, hasil skor tertinggi dari AutoDock Vina dipilih sebagai pose terbaik untuk Lys yang di-dock dan tertinggi kedua untuk Ala dan Ser yang di-dock. Informasi docking dari konformasi yang diturunkan dan interaksi ikatan hidrogen dari pose docking terbaik tersedia di Zenodo DOI: 10.5281/zenodo.14752041 .
Hasil
Didorong oleh temuan terbaru kami bahwa YAT memiliki spektrum substrat yang lebih luas daripada yang diperkirakan sebelumnya [ [ 5 ] ], kami mempelajari pertumbuhan S. cerevisiae Δ10AA yang mengekspresikan berlebihan Lyp1 berlabel GFP C-terminal dari plasmid pADHXC3GH pada 20 asam amino L yang berbeda (proteinogenik dan nonproteinogenik). Galur Δ10AA tidak memiliki 10 transporter membran yang termasuk dalam famili YAT dan dengan demikian menunjukkan defisiensi parah untuk penyerapan asam amino [ [ 25 ] ]. Setelah transformasi galur dengan vektor ekspresi yang membawa transporter yang diinginkan, profil substrat permease spesifik ditentukan dalam percobaan pertumbuhan sel yang menyediakan 2 mm asam amino sebagai satu-satunya sumber nitrogen. Karena Lys tidak dapat digunakan sebagai satu-satunya sumber nitrogen oleh S. cerevisiae , ia tidak disertakan dalam uji pertumbuhan [ [ 19 , 20 ] ].
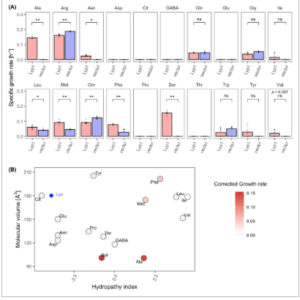
Perbandingan laju pertumbuhan spesifik strain yang mengekspresikan Lyp1 dengan strain kontrol, yang membawa vektor ekspresi kosong, mengungkap enam substrat baru untuk transporter (Gbr. 1 ; Gbr. S1 ). Peningkatan pertumbuhan didukung oleh asam amino kecil Ala dan Ser (laju pertumbuhan spesifik μ = 0,15 h −1 ), diikuti oleh Met, Phe, dan Leu yang lebih hidrofobik (μ = 0,06–0,08 h −1 ). Pertumbuhan yang lambat tetapi signifikan diamati pada Asn yang hidrofilik (μ = 0,02 h −1 ). Sedikit atau tidak ada pertumbuhan yang didukung oleh asam amino dengan volume molekul sedang, terlepas dari indeks hidropatinya (Gbr. 1B ).
 Gbr. 1
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Lyp1 mendukung pertumbuhan pada berbagai asam amino. (A) Laju pertumbuhan spesifik S. cerevisiae Δ10AA yang mengekspresikan Lyp1 dari pADHXC3GH atau yang mengandung vektor kontrol pada 2 mm dari 20 asam amino berbeda yang disediakan sebagai satu-satunya sumber nitrogen. Batang galat menunjukkan SEM ( n = 6). Tanda bintang menunjukkan derajat perbedaan signifikan dalam perbandingan berpasangan ( uji- t Student ; ** P < 0,01, * P < 0,05, ns = perbedaan tidak signifikan). Untuk kurva pertumbuhan masing-masing, lihat Gambar S1 . (B) Laju pertumbuhan rata-rata Δ10AA yang mengekspresikan Lyp1 per substrat sebagai fungsi indeks hidropati asam amino (sumbu x) dan volume molekuler (sumbu y). Warna sesuai dengan laju pertumbuhan yang dikoreksi setelah pengurangan vektor kontrol. Substrat afinitas tinggi Lys ditunjukkan sebagai berlian biru. Plot didasarkan pada (A).
Lokalisasi seluler Lyp1 diselidiki setelah 72 jam pertumbuhan pada asam amino yang berbeda. Seperti yang diharapkan, transporter sebagian besar terletak di membran plasma selama pertumbuhan eksponensial, seperti yang ditunjukkan untuk pertumbuhan pada Met, Phe, Leu, dan Asn, sementara tanda-tanda internalisasi terlihat ketika sel mencapai fase stasioner, seperti yang ditunjukkan untuk pertumbuhan pada Ala dan Ser (Gbr. S2 ). Meskipun laju pertumbuhan yang rendah tetapi terukur (μ = 0,02 jam −1 ) pada Val tidak berbeda secara signifikan dari laju pertumbuhan galur kontrol dalam percobaan ini, kami tunjukkan di bawah ini bahwa Val adalah substrat potensial Lyp1. Khususnya, asam amino Arg dan Orn dikeluarkan dari analisis lebih lanjut karena pertumbuhan latar belakang yang tinggi dari galur kontrol, mungkin karena aktivitas transporter Vba5 [ [ 37 ] ]. Selanjutnya, sel-sel tidak menunjukkan tanda-tanda fluoresensi membran plasma setelah 72 jam pertumbuhan pada Arg atau Orn, yang mungkin mencerminkan efek translasi atau perdagangan regulasi yang diinduksi asam amino pada Lyp1 (Gbr. S1 , S2 ).
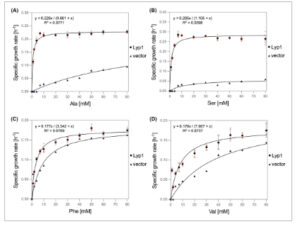
Ketergantungan laju pertumbuhan pada konsentrasi Ala, Ser, Phe atau Val dianalisis dengan persamaan Monod. Laju pertumbuhan maksimum (μ max ) kultur adalah 0,29 jam −1 untuk pertumbuhan pada Ser, 0,23 jam −1 pada Ala dan 0,18 jam −1 pada Phe atau Val. Untuk lebih jauh menggambarkan kinetika pertumbuhan, konsentrasi substrat di mana laju pertumbuhan spesifik adalah setengah dari laju maksimum (K s ) ditentukan. Dihitung bahwa K s Ala = 0,9 ± 0,07 mm , K s Ser = 1,1 ± 0,15 mm , K s Phe = 3,3 ± 0,26 mm , dan K s Val = 7,9 ± 1,51 mm . Nilai K s yang tinggi untuk Phe dan Val bertepatan dengan laju pertumbuhan maksimum yang lebih rendah (Gbr. 2 ; Gbr. S3 ). Perbedaan laju pertumbuhan antara strain yang mengekspresikan Lyp1 dan kontrol pada konsentrasi tinggi menunjukkan bahwa Val memang merupakan substrat Lyp1. Jadi, meskipun pertumbuhan S. cerevisiae Δ10AA yang mengekspresikan Lyp1 pada 2 mm dari sebagian besar sumber nitrogen yang diuji memberikan bukti untuk spektrum substrat transporter, asam amino dengan nilai K s yang tinggi , seperti Val, memerlukan konsentrasi yang lebih tinggi untuk identifikasinya.
 Gambar 2
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Laju pertumbuhan sebagai fungsi konsentrasi asam amino. Laju pertumbuhan spesifik S. cerevisiae Δ10AA yang mengekspresikan Lyp1 dari pADHXC3GH atau yang mengandung vektor kontrol pada berbagai konsentrasi Ala (A), Ser (B), Phe (C), dan Val (D) sebagai satu-satunya sumber nitrogen. Kesesuaian model Monod diplot, dan ketergantungan pada konsentrasi asam amino [x] untuk kultur yang mengekspresikan Lyp1 ditunjukkan di bagian atas setiap panel. Batang galat menunjukkan SEM ( n = 3). Untuk kurva pertumbuhan masing-masing, lihat Gambar S3 .
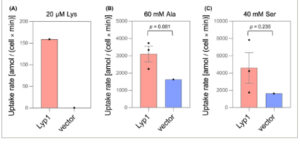
Perbedaan yang diamati dalam laju pertumbuhan memberikan indikasi pertama aktivitas transpor untuk setiap asam amino. Untuk menyelidiki sifat perbedaan, kami mengukur laju penyerapan Lys, Ala, Ser, Phe, dan Val berlabel radioaktif secara in vivo (Gbr. 3 ; Gbr. S4 ). Konstanta afinitas yang diamati ( K m ) dari Lyp1 untuk Lys adalah 4,2 ± 0,46 μ m dan V maks adalah 2,8 ± 0,08 amol/(sel × mnt) (Gbr. 4A,B ). Perbedaan kecil dari nilai K m dan V maks yang dijelaskan sebelumnya, mungkin mencerminkan penggunaan strain yang berbeda dan/atau variasi dalam kondisi pengujian [ [ 17 , 18 , 38 , 39 ] ].
 Gambar 3
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Lyp1 mendukung penyerapan berbagai asam amino. Penyerapan 20 μ m 14 C-Lys (A), 60 mm 14 C -Ala (B), dan 40 mm 14 C -Ser (C) dalam S. cerevisiae Δ10AA yang mengekspresikan Lyp1 dari pADHXC3GH atau yang mengandung vektor kontrol (Buffer pengujian: KCP pada pH 5). Batang galat menunjukkan SEM ( n = 3). Derajat perbedaan signifikan dalam (B, C) dihitung menggunakan uji-t satu sampel dengan laju penyerapan vektor kontrol sebagai nilai tetap. Untuk kurva penyerapan masing-masing, lihat Gambar S4
 Gambar 4
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
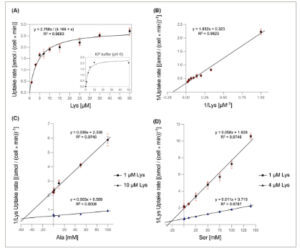
Kinetika transpor Lys dengan dan tanpa adanya Ala dan Ser. (A) Laju penyerapan 14 C-Lys oleh S. cerevisiae Δ10AA yang mengekspresikan Lyp1 dari pADHXC3GH (Bufer uji: KCP pada pH 5). Uji dalam KP pada pH 6 ditunjukkan dalam sisipan. Kesesuaian model Michaelis–Menten diplot. (B) Plot Lineweaver–Burk dan regresi linier untuk peningkatan konsentrasi 14 C-Lys. (C, D) Plot Dixon dan regresi linier untuk peningkatan konsentrasi Ala dengan adanya 1 dan 10 μ m 14 C-Lys (C), atau Ser dengan adanya 1 dan 4 μ m 14 C – Lys (D) (Bufer uji: KCP pada pH 5). Untuk laju penyerapan masing-masing, lihat Gambar . Persamaan plot dan nilai R 2 ditampilkan di bagian atas grafik masing-masing. Batang kesalahan mewakili SEM ( n = 3).
Mengenai penyerapan substrat yang baru ditemukan, kami mengamati bahwa studi kinetik dikaburkan oleh penyerapan latar belakang seperti yang terlihat pada kontrol saat konsentrasi rendah Ala, Ser, Phe, dan Val digunakan (Gbr. S4 ). Untuk asam amino hingga 2 mm , laju transpor dibatasi oleh konsentrasi substrat yang tersedia. Penyerapan Ala dan Ser berlabel radioaktif paling baik ditunjukkan pada 60 mm dan 40 mm , masing-masing (Gbr. 3B,C ). Meskipun galur tumbuh pada 2 mm Ala , Ser, Phe, dan Val, konstanta afinitas Lyp1 untuk setiap asam amino jauh lebih tinggi daripada konsentrasi ini. Ini menunjukkan bahwa aktivitas maksimal Lyp1 tidak diperlukan untuk pertumbuhan pada substrat asam amino afinitas rendah.
Mengingat tingginya laju pertumbuhan sel yang mengekspresikan Lyp1 pada Ala dan Ser, kami menyelidiki transpornya lebih lanjut. Untuk menentukan konstanta afinitas Lyp1 untuk Ala dan Ser, kami mempelajari efek penghambatan asam amino ini pada penyerapan Lys berlabel radioaktif. Kecocokan Lineweaver–Burk dari regresi linier untuk meningkatkan konsentrasi Ala dan Ser sesuai dengan model penghambatan kompetitif (Gbr. 4 ; Gbr. S5 ). Melalui plot Dixon masing-masing, dihitung bahwa konstanta penghambatan Ki adalah 53 mm untuk Ala dan 26 mm untuk Ser (Gbr. 4C,D ).
Perbedaan dalam afinitas dan, dengan demikian, energi bebas pengikatan ini juga didukung oleh studi docking Lys, Ala, dan Ser pada situs pengikatan substrat yang diprediksi dari Lyp1 ( skor- s Lys < skor- s Ser < skor- s Ala ). Situs pengikatan Lyp1 ditentukan setelah penyelarasan struktural dari struktur protein yang diprediksi oleh AlphaFold dan struktur kristal transporter arginin/agmatin AdiC dari E. coli , yang memiliki kesamaan urutan yang tinggi dengan Lyp1 (Gbr. S6 , S7 ). N- dan C-terminal dikecualikan dari penyelarasan karena fleksibilitasnya yang tinggi. Kesamaan struktural dari 147 dari 404 asam amino menghasilkan kecocokan RMSD sebesar 1,083 Å. Skor penyelarasan terbaik diamati untuk heliks transmembran 3, 4, 6, 8, dan 10.
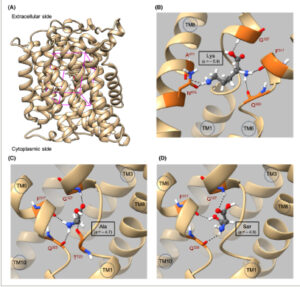
Penentuan situs pengikatan substrat Lyp1 untuk docking dengan AutoDock Vina (1.1.2) didasarkan pada posisi masing-masing dan residu yang berinteraksi dari AdiC dengan substratnya Arg. Khususnya, asam amino G127 (heliks transmembran TM1), F317 (TM6), dan Q320 (TM6) dari Lyp1 diprediksi membentuk ikatan hidrogen (H) dengan substrat Lys, Ala, dan Ser. Ikatan H ini berada pada jarak hingga 2,5 Å antara atom hidrogen akseptor dan donor (Gbr. 5 ). Secara khusus, asam amino yang sama, atau yang berada di sekitar, diprediksi membentuk ikatan H di sebagian besar pose substrat, terlepas dari substrat spesifiknya. Secara keseluruhan, afinitas Lyp1 untuk asam amino yang berbeda mencakup lebih dari empat tingkat besaran ( K m Lys = 4 μ m dan K i Ala = 53 m m sebagai nilai paling ekstrem), yang menunjukkan pergaulan bebas transporter untuk asam amino yang beragam.
 Gambar 5
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Penyambungan substrat pada situs pengikatan Lyp1 yang diprediksi. (A) Tampilan samping Lyp1 (AF-P32487). Kotak volume yang digunakan untuk menyambungkan substrat dengan AutoDock Vina (1.1.2) di Chimera (1.17.1) ditampilkan dalam warna magenta. Kotak tersebut mencakup residu yang diharapkan berkontribusi pada situs pengikatan substrat, yang disajikan sebagai batang, menurut struktur AdiC-Arg. (B–D) Tampilan samping model AlphaFold Lyp1 (AF-P32487) dan Lys yang disambungkan (PubChem CID: 5962) (B), Ala (PubChem CID: 5950) (C), atau Ser (PubChem CID: 5951) (D), seperti yang diprediksi oleh AutoDock Vina (1.1.2) di Chimera (1.17.1). Ikatan hidrogen digambarkan sebagai garis putus-putus, dengan residu Lyp1 yang berpartisipasi di dalamnya ditampilkan sebagai batang berwarna cokelat. Atom-atom diwarnai sebagai abu-abu: karbon; merah: oksigen; biru: nitrogen; putih: hidrogen. Masing-masing TM disebutkan dalam lingkaran. Divisualisasikan dalam ChimeraX (1.8).
Diskusi
Transporter utama untuk penyerapan asam amino dalam ragi termasuk dalam famili YAT. Meskipun anggota pertama dideskripsikan pada tahun 1960-an, karakterisasi fungsional dan strukturalnya masih jauh dari kata lengkap. Baru-baru ini, kami menemukan bahwa lima paralog YAT memiliki spektrum substrat yang lebih luas daripada yang dilaporkan sebelumnya, dengan transporter utama untuk lisin, Lyp1, menjadi salah satunya [ [ 5 ] ]. Kami sekarang menunjukkan bahwa konstanta afinitas Lyp1 untuk asam amino yang berbeda berkisar dari kisaran mikromolar hingga milimolar.
Kami menunjukkan bahwa Lyp1 dapat mendukung pertumbuhan S. cerevisiae pada Ala, Asn, Leu, Met, Phe, Ser, dan Val ketika disediakan sebagai satu-satunya sumber nitrogen (Gbr. 1A ). Uji berbasis pertumbuhan yang digunakan menunjukkan sensitivitas yang baik dalam mengungkap aktivitas transporter promiscuous [ [ 40 ] ]. Sebuah studi tentang transporter Bap2, yang gennya diekspresikan di bawah promotor aslinya dalam galur S. cerevisiae Δ10AA, menunjukkan bahwa penemuan aktivitas promiscuous hanya mungkin terjadi ketika protein diproduksi pada tingkat tinggi, yaitu, diekspresikan dari plasmid multikopi [ [ 5 ] ]. Substrat dengan nilai Ks hingga empat kali lebih tinggi daripada konsentrasi asam amino yang disediakan kemudian dapat diidentifikasi (Gbr. 2 ). Selain itu, sistem ini memungkinkan identifikasi substrat yang pengenalannya dianggap sulit selama uji transpor in vivo karena afinitasnya yang sangat rendah ( Km tinggi ) atau waktu uji yang singkat (Gbr. 3 ; Gbr. S4 ). Kondisi dinamis dari kultur yang sedang tumbuh dan waktu pengukuran yang lama memungkinkan identifikasi substrat, bahkan ketika substrat tersebut ditransportasikan pada kecepatan yang sangat rendah.
Tampak jelas bahwa ekspresi berlebihan Lyp1 mendukung pertumbuhan cepat pada asam amino kecil (Ala, Ser) dan pertumbuhan lebih lambat pada asam amino hidrofobik yang volumenya mirip dengan Lys (Phe, Leu, Met, dan Val), ketika ini disajikan sebagai satu-satunya sumber nitrogen untuk strain yang sangat terganggu dalam penyerapan asam amino (Gbr. 1B ). Pengamatan kami selaras dengan penelitian sebelumnya yang menunjukkan penyerapan Met yang agak rendah namun signifikan oleh Lyp1 [ [ 23 ] ]. Kami selanjutnya mengamati laju pertumbuhan yang lebih rendah daripada kontrol ketika sel tumbuh pada Orn, konsisten dengan temuan dari penelitian sebelumnya [ [ 19 ] ]. Dalam kondisi ini, Lyp1 tidak terlokalisasi pada membran plasma, yang dapat menunjukkan efek regulasi negatif Orn pada translasi, trafficking, atau pelipatan Lyp1. Mekanisme regulasi serupa dapat dihipotesiskan untuk Arg (Gbr. S2 ). Kedua asam amino dapat diambil oleh Δ10AA melalui Vba5, karena gennya tidak dihapus dalam strain ini [ [ 37 ] ]. Peran asam amino sebagai substrat dan titik pemeriksaan regulasi telah ditunjukkan untuk Bap2 dan Gap1, yang mana substrat afinitas tinggi mereka, Leu dan Gln, masing-masing, mengatur ekspresinya [ [ 41 , 42 ] ]. Untuk Lyp1, telah ditunjukkan bahwa masuknya lisin yang meningkat menandakan ubikuitinasi dan penurunan regulasi endositosis permease berikutnya [ [ 22 ] ]. Demikian pula, impor Arg oleh Can1, kerabat evolusi terdekat Lyp1, mengatur ubikuitinasi transporter, dan dengan demikian sel menghindari potensi efek toksik dari akumulasi Arg yang berlebihan [ [ 15 , 16 , 43 ] ]. Oleh karena itu, jelaslah bahwa substrat yang tidak menentu dapat tetap tersembunyi tidak hanya karena afinitasnya yang rendah terhadap permease, tetapi juga dengan menginduksi perubahan dalam keadaan fungsional atau tingkat ekspresinya.
Kami juga menunjukkan penghambatan kompetitif penyerapan Lys melalui Lyp1 oleh Ala dan Ser, dengan konstanta Ki sebesar 26 mm untuk Ser dan 53 mm untuk Ala (Gbr. 4 ). Khususnya, Lys, Ala, dan Ser membentuk ikatan-H dengan residu pada heliks TM1 (G127) dan TM6 (F317 dan Q320), yang, bersama dengan heliks TM10, berpartisipasi dalam gerakan menutup-keluar transporter lipatan LeuT (Gbr. 5 ) [ [ 9 , 16 , 44 ] ]. Secara khusus, F317 termasuk dalam motif (F/Y)(S/A/T)(F/Y)xGxE yang sangat terkonservasi di TM6. Residu ekuivalen dalam AdiC telah terbukti berinteraksi dengan Arg dan menstabilkan keadaan semi-tertutup protein melalui interaksi antar-loop [ [ 45 ] ]. Pentingnya F317 dalam pengenalan substrat juga telah dipamerkan dalam studi mutagenesis residu ekuivalen pada Bap2 [ [ 46 ] ]. Demikian pula, residu Q320 yang sesuai di AdiC terletak pada jarak ikatan hidrogen dari substratnya [ [ 45 ] ]. Residu G127 pada Lyp1 adalah bagian dari motif GSG yang sangat terkonservasi di TM1. Residu ekuivalen di AdiC juga berinteraksi dengan substrat transporter, sementara substitusi residu ekuivalen di Gap1 dan PrnB menghasilkan hilangnya fungsi [ [ 11 , 12 , 47 , 48 ] ]. Dengan demikian, meskipun kurangnya struktur resolusi tinggi Lyp1, konservasi residu pada posisi yang dibahas dan kekayaan data mutagenesis dalam protein homolog dari organisme lain mengungkapkan sifat terkonservasi dari kantong pengikat substrat dalam keluarga YAT. Hasil ini dapat menjadi titik awal untuk studi struktural dan fungsional lebih lanjut dari kelas penting protein transpor membran ini.
Lyp1 menunjukkan afinitas tertinggi untuk lisin, dengan K m yang tampak sebesar 4 μ m . Afinitas Lyp1 yang agak rendah untuk Ala dan Ser menunjukkan bahwa mereka bukan substrat yang disukai untuk transporter (Gbr. 4 ). Namun, dalam kondisi stres, transpor mereka dapat menawarkan keuntungan kebugaran yang signifikan bagi organisme, setidaknya ketika satu atau beberapa YAT dinonaktifkan. Rentang afinitas dari mikromolar ( K m Lys = 4 μ m ) hingga rentang milimolar ( Ki Ala = 53 m m ) agak belum pernah terjadi sebelumnya dalam keluarga YAT tetapi telah dicatat untuk anggota lain dari superfamili APC (asam amino-poliamina-organokasi) [ [ 49 – 61 ] ]. Satu contoh menarik adalah transporter asam amino berpasangan proton PAT2 pada tikus, yang menunjukkan rentang afinitas 360 kali lipat ( K m Pro = 0,12 mm ; K m Ser = 43 mm ) , sementara rentang paralognya, PAT1, lebih kecil ( K m Pro = 2,8 mm ; K m Ser = 69 mm ) [ [ 62 ] ]. Contoh serupa dapat ditemukan pada tanaman, dengan transporter asam amino umum AAP3 memiliki afinitas submilimolar untuk Pro ( K m Pro = 100–250 μ m ) dan milimolar untuk GABA ( K m GABA = 12,9 mm ) [ [ 63 , 64 ] ]. Dengan cara yang sama, pembawa heksosa dari S. cerevisiae , seperti Hxt7 ( K m Glukosa = 0,5 m m ; K m Xilosa = 200 m m ), menunjukkan rentang afinitas yang tinggi di antara substratnya, yang memungkinkan regulasi fleksibel transportasi gula dalam berbagai kondisi lingkungan [ [ 3 , 65 – 67 ] ].
Akhirnya, kami mencatat bahwa transporter Lyp1 yang digunakan dalam laporan kami diekspresikan secara berlebihan untuk mengamankan sensitivitas yang baik untuk penyaringan substrat dan penandaan GFP untuk mengonfirmasi pelokalannya yang benar pada membran plasma. Kami mengakui efek penandaan terhadap aktivitas dan pengangkutan protein [ [ 68 – 70 ] ]. Meskipun kami menganggap tidak mungkin bahwa penandaan GFP telah memengaruhi spesifisitas transporter dan dengan demikian kesimpulan utama laporan kami, adalah bijaksana untuk mempelajari protein endogen di masa mendatang.
Secara keseluruhan, temuan kami menunjukkan bahwa Lyp1 memiliki spektrum substrat yang lebih luas daripada yang diperkirakan sebelumnya. Setiap substrat dapat memaksakan kebugaran spesifik pada organisme, yang dapat bergantung pada konstanta afinitas untuk asam amino itu, laju pergantian protein spesifik substrat, regulasi transporter pada pengikatan atau penyerapan substrat, dan/atau efisiensi jalur metabolisme hilir [ [ 71 – 73 ] ]. Kami mengidentifikasi dua asam amino yang memberikan kebugaran tinggi pada strain S. cerevisiae yang mengalami gangguan transportasi asam amino meskipun afinitasnya sangat rendah untuk Lyp1, dan menunjukkan bahwa rentang afinitas transporter berkisar dari beberapa mikromolar hingga milimolar. Dari perspektif evolusi, pergaulan bebas seperti itu diharapkan dan dapat terbukti bermanfaat bagi organisme karena memungkinkan adaptasi dalam kondisi stres dan eksplorasi relung ekologi baru [ [ 5 , 74 , 75 ] ].