Abstrak
Tidak ada biomarker protein berbasis darah yang saat ini tersedia untuk penggunaan klinis rutin guna menentukan prognosis pasien dengan glioblastoma (GB). Kami melakukan proteomik berbasis spektrometri massa akuisisi independen data (DIA-MS) pada 96 sampel serum prabedah dari pasien dengan GB dan 30 sampel serum dari kontrol sehat untuk mengidentifikasi penanda tersebut. Di antara 622 protein serum yang diekspresikan secara berbeda antara kelompok GB dan kontrol, 191 memiliki |log 2 (perubahan lipat)| ≥ 0,58 dan area di bawah kurva ≥ 0,75. Analisis nilai prognostiknya mengungkapkan bahwa kadar IL1R2 yang tinggi dan kadar CRTAC1 dan HRG yang rendah dikaitkan dengan kelangsungan hidup yang buruk. Analisis regresi Cox multivariat mengidentifikasi IL1R2 sebagai faktor prognostik independen untuk PFS dan CRTAC1 sebagai faktor prognostik independen untuk OS. Konsentrasi CRTAC1 dalam sampel serum dari kelompok independen penyintas GB jangka pendek dan jangka panjang (masing-masing STS dan LTS) melalui ELISA terbukti lebih rendah pada kelompok STS dibandingkan pada kelompok LTS. CRTAC1, HRG, dan IL1R2 berpotensi digunakan untuk memberikan informasi yang lebih baik mengenai prognosis dan memprediksi respons pengobatan pada pasien GB.
Singkatan
AUC
area di bawah kurva
BBB
penghalang darah-otak
Ringkasan
faktor dampak penelitian bioresources
DIA-MS
spektrometri massa akuisisi data-independen
DMNC
kepadatan komponen lingkungan maksimum
EOR
tingkat reseksi
FFPE
formalin-fiksasi parafin-tertanam
Bahasa Inggris: GB
penyakit glioma
GTR
reseksi total bruto (100%)
IDH
isositrat dehidrogenase
KPS
Skor kinerja Karnofsky
Bahasa Inggris
penyintas jangka panjang
PKS
sentralitas klik yang maksimal
Manajemen Manajemen
O6-metilguanin metiltransferase
mikrofon
meminimalkan kriteria informasi perkiraan
Sistem Operasi
kelangsungan hidup secara keseluruhan
PCA
analisis komponen utama
PFS
kelangsungan hidup bebas perkembangan
hubungan masyarakat
reseksi parsial (< 90%)
Bahasa Inggris ROC
karakteristik operasi penerima
ROS
spesies oksigen reaktif
SAM
analisis signifikansi microarray
STR
reseksi subtotal (≥ 90%)
STS
korban jangka pendek
Berita
temozolomida
1 Pendahuluan
Glioblastoma (GB) merupakan tumor primer yang paling umum dan agresif pada sistem saraf pusat. Standar perawatan terkini untuk GB yang baru terdiagnosis—protokol Stupp, yang mencakup reseksi aman maksimum diikuti oleh radioterapi plus temozolomide (TMZ) bersamaan dan adjuvan—kini dapat dikombinasikan dengan terapi bidang pengobatan tumor [ [ 1 , 2 ] ]. Meskipun demikian, prognosis pasien tetap buruk, dengan median kelangsungan hidup sekitar 22 bulan [ [ 3 ] ].
Penelitian ilmiah dan teknologi yang signifikan sedang dilakukan untuk meningkatkan perawatan GB [ [ 4 ] ], termasuk pencarian biomarker yang andal dan noninvasif untuk manajemen pasien GB, yang akan berguna untuk menilai prognosis dan memantau respons terhadap pengobatan, mendeteksi perkembangan sebenarnya pada, atau bahkan sebelum tanda pertama peningkatan kontras dan memfasilitasi diagnosis tumor yang tidak dapat dioperasi. Beberapa biomarker genetik dan molekuler dalam jaringan GB telah ditemukan yang memfasilitasi prediksi prognosis dan respons pengobatan [ [ 5 ] ]. Misalnya, metilasi promotor O6-methylguanine DNA methyltransferase ( MGMT ) merupakan penanda prediktif potensial untuk respons terhadap TMZ, dan mutasi isocitrate dehydrogenase (IDH) telah diidentifikasi sebagai penanda prognosis yang baik [ [ 6 , 7 ] ]. Namun, GB bermutasi IDH sekarang dianggap sebagai astrocytoma grade 4 bermutasi IDH, dengan profil metilasi dan ekspresi gen yang berbeda dari GB tipe liar IDH, dan prognosis serta respons terhadap pengobatan yang berbeda [ [ 8 , 9 ] ].
Sampel darah ideal untuk penilaian prognosis dan pemantauan respons pengobatan, karena sampel diperoleh dengan metode yang kurang invasif daripada biopsi jaringan atau tusukan cairan serebrospinal, dan sampel berulang dapat diperoleh selama pengobatan untuk mengevaluasi dinamika tumor secara real time. Kami sebelumnya menunjukkan bahwa penilaian pra operasi penanda darah seluler, seperti rasio neutrofil terhadap limfosit, jumlah sel darah merah, dan jumlah trombosit, dapat memprediksi hasil kelangsungan hidup pasien GB yang diobati dengan terapi standar [ [ 10 ] ]. Upaya penelitian saat ini difokuskan pada komponen tumor yang ada dalam darah, seperti sel tumor yang bersirkulasi, DNA tumor yang bersirkulasi, RNA yang bersirkulasi, vesikel ekstraseluler, dan protein yang bersirkulasi, tetapi sejauh pengetahuan kami, tidak satu pun dari biomarker yang bersirkulasi ini pernah dimasukkan ke dalam pemantauan prognostik rutin pasien GB [ [ 5 ] ]. Kurangnya protein sirkulasi yang relevan secara klinis yang mampu memprediksi hasil kelangsungan hidup dan respon pengobatan pada pasien GB mungkin disebabkan oleh rendahnya sensitivitas deteksi protein oleh teknologi proteomik yang digunakan dalam penelitian dan kecilnya ukuran kohort sampel darah GB pra operasi (<40) [ [ 11 – 14 ] ].
Dalam studi ini, kami menggunakan pendekatan proteomik berbasis spektrometri massa akuisisi independen data (DIA-MS) untuk mengkarakterisasi proteom serum dari kelompok pasien GB yang lebih besar ( n = 96) dan kontrol sehat ( n = 30). Teknologi bebas label yang kuat ini telah terbukti menjadi strategi generasi berikutnya yang cocok untuk proteomik kuantitatif throughput tinggi dengan sejumlah aplikasi klinis potensial, memberikan wawasan tentang biologi fungsional kanker dan mengidentifikasi target pengobatan baru dan biomarker prognostik untuk penggunaan klinis [ [ 15 , 16 ] ]. Kami telah menggunakan DIA-MS untuk mendeteksi perbedaan dalam kelimpahan protein dalam sampel tumor dan serum dari penyintas GB jangka pendek dan jangka panjang (masing-masing STS dan LTS) [ [ 17 ] ]. Di sini, kami membandingkan proteom serum dari kontrol sehat dan pasien dengan GB dengan data klinis dan kelangsungan hidup yang tersedia untuk mengidentifikasi potensi biomarker prognostik yang beredar pada pasien GB. Kumpulan besar data proteomik serum yang dikaitkan dengan data klinis ini akan sangat berguna bagi komunitas ilmiah.
2 Metode
2.1 Kelompok studi
Studi ini mencakup 96 pasien yang baru didiagnosis dengan GB antara Januari 2012 dan Desember 2021 di Rumah Sakit Universitas Angers. Kriteria inklusi berikut digunakan: (1) pasien berusia ≥ 18 tahun, (2) baru didiagnosis GB supratentorial unilateral, (3) GB tanpa pewarnaan imunohistokimia untuk IDH1-R132H, (4) tumor direseksi, (5) tidak ada kemoterapi intraoperatif, dan (6) pengobatan lini pertama dengan kemoradioterapi bersamaan lengkap menurut protokol Stupp [ [ 18 ] ]. Jumlah siklus kemoterapi adjuvan berikutnya dengan TMZ oral bergantung pada toleransi dan respons radiologis. Kami juga menyertakan 30 kontrol sehat yang direkrut di Rumah Sakit Universitas Angers.
2.2 Persetujuan etika dan persetujuan untuk berpartisipasi
Penelitian ini dilakukan sesuai dengan Deklarasi Helsinki.
Pasien dengan GB dimasukkan dalam FGB [ [ 19 ] ]. FGB dideklarasikan kepada Kementerian Kesehatan dan Penelitian Prancis [nomor deklarasi: DC-2011-1467, nomor otorisasi penyerahan: AC-2023-5473, nomor BRIF (faktor dampak penelitian sumber daya hayati): BB-0033-00093]. Protokol dan peraturan FGB disetujui oleh komite etik CPP OUEST II (CB 2012/02, tanggal persetujuan: 20 Desember 2011) dan CNIL (“Commission Nationale de l’Informatique et des Libertés,” otoritas perlindungan data nasional Prancis, no. 1476342, tanggal persetujuan: 10 Oktober 2011). Kontrol yang sehat dimasukkan dalam biokoleksi “CELREMED” Rumah Sakit Universitas Angers dengan persetujuan komite etik CPP OUEST II (CB 2015/02, tanggal persetujuan: 20 Maret 2015). Eksperimen dilakukan dengan pemahaman dan persetujuan tertulis dari setiap subjek.
2.3 Pengumpulan data klinis
Karakteristik dasar, seperti usia, jenis kelamin, skor kinerja Karnofsky (KPS) praoperasi, lokasi tumor, data darah sebelum operasi, luas reseksi (EOR), status metilasi MGMT , dan rejimen protokol Stupp, dikumpulkan dari catatan medis. Status metilasi promotor MGMT dinilai dengan pyrosequencing [ [ 20 ] ]. Kelangsungan hidup keseluruhan (OS) didefinisikan sebagai waktu dari operasi awal hingga tindak lanjut terakhir atau kematian. Kelangsungan hidup bebas perkembangan (PFS) diukur dari operasi awal hingga tanggal perkembangan pertama.
2.4 DIA-MS dan pemilihan protein serum yang diinginkan
Sampel darah dikumpulkan dari semua 96 pasien GB sebelum operasi. Aliquot serum yang disiapkan dari sampel darah GB dan kontrol diproses seperti yang dijelaskan sebelumnya [ [ 17 ] ]. Setiap sampel serum (200 ng) dianalisis dengan LC–MS/MS dengan sistem nanoElute UHPLC (Bruker Daltonik GmbH, Bremen, Jerman) berdasarkan kolom C 18 fase terbalik seri Aurora (diameter internal 25 cm × 75 μm, C 18 1,6 μm , IonOpticks, Fitzroy, Australia) yang dipanaskan hingga 50°C dan digabungkan ke TimsTOF Pro2 (Bruker Daltonik GmbH). Gradien linier 2–35% fase mobil B (0,1% asam format dalam asetonitril) selama 60 menit digunakan dengan 0,1% asam format dalam H 2 O tingkat milliQ sebagai fase mobil A. Total waktu proses, termasuk peningkatan fase B dari 35 hingga 95% untuk membersihkan kolom dan mempersiapkan sampel berikutnya, adalah 90 menit. Pengukuran diperoleh dalam mode DIA-PASEF (akuisisi independen data, akumulasi paralel, fragmentasi serial). Kami menganalisis 200 ng peptida dari setiap sampel selama gradien 60 menit. Rentang m/z default adalah 400–1201, dengan rentang IM 0,6–1,43 1/K0 [V s·cm −2 ], yang sesuai dengan perkiraan waktu siklus 1,80 d. Pengaturan default juga digunakan untuk jendela DIA-PASEF dan energi tumbukan, dengan basis 0,85 1/K0 [V s·cm −2 ] ditetapkan pada 20 eV dan 1,30 1/K0 [V s·cm −2 ] ditetapkan pada 59 eV. TIMS dan kalibrasi massa dilakukan secara linear dengan tiga ion kalibrasi pada 622, 922, dan 1222 m/z (Agilent Technologies, Les Ulis, Prancis) pada rentang yang berbeda untuk mencocokkan Δ1/K0 dari rangkaian rentang yang sesuai. Data spektrometri massa dianalisis dengan DIA-NN v.1.8.1, dengan pencarian terhadap basis data Human Uniprot yang ditinjau (diperoleh 4/21), dengan perangkat lunak dalam mode bebas pustaka. Fitur match-between-runs dan normalisasi intersample digunakan untuk semua analisis, dan output (prekursor) difilter untuk menjaga rasio penemuan palsu di bawah 1%. Penyelarasan waktu retensi dan koreksi untuk akurasi massa dilakukan secara otomatis. Data selanjutnya ditransformasikan ke log 2. Untuk setiap protein dengan nilai hilang kurang dari 30% secara keseluruhan di seluruh sampel, imputasi data dilakukan dengan seperlima dari nilai terendah yang tercatat untuk ekspresi yang digunakan untuk mengganti nilai yang hilang sehingga uji statistik dapat dilakukan. Protein dengan lebih dari 30% nilai hilang di seluruh sampel dikeluarkan dari analisis. Analisis komponen utama (PCA) digunakan untuk mengidentifikasi outlier. Metode analisis signifikansi microarray (SAM) digunakan dengan paket R “samr” untuk mengidentifikasi protein yang menampilkan ekspresi diferensial yang signifikan antara kelompok GB dan kontrol. Protein dengan SAM Q-nilai < 0,05 dianggap menunjukkan ekspresi diferensial yang signifikan. Kinerja diagnostik protein serum dinilai dengan memplot kurva karakteristik operasi penerima (ROC) dan menghitung area di bawah kurva (AUC) dengan paket R “survivalROC”. Nilai AUC ≥ 0,75 dianggap signifikan. Protein yang menunjukkan ekspresi diferensial signifikan dengan |log 2 (FC)| ≥ 0,58 dan AUC ≥ 0,75 dianggap sebagai protein yang diinginkan. 2.5 Pengayaan fungsional, analisis protein modul dan hub untuk protein serum yang diinginkan Fungsi biologis dan jalur pensinyalan potensial dari protein serum yang diinginkan dianalisis dengan Metascape ( https://metascape.org ) [ [ 21 ] ]. Analisis jaringan interaksi protein-protein (PPI) dilakukan dengan versi database STRING 12.0 [ [ 22 ] ]. Skor kepercayaan ≥ 0,40 dipilih untuk konstruksi jaringan PPI dalam Cytoscape versi 3.9.0. Kami menggunakan Molecular Complex Detection (MCODE; versi 1.5.1) [ [ 23 ] ] untuk mengidentifikasi modul paling signifikan dalam jaringan PPI. Skor MCODE > 3 dan sejumlah node ≥ 5 ditetapkan sebagai kriteria batas dengan parameter default (batas derajat ≥ 2, batas skor node ≥ 2, k-core ≥ 2 dan kedalaman maks = 100).
2.6 Analisis nilai prognostik protein serum yang diinginkan
Analisis regresi Cox univariat dilakukan untuk menilai nilai prognostik protein serum yang diinginkan berdasarkan data kelangsungan hidup dari 96 pasien GB. Protein dianalisis sebagai variabel kontinu dan dikotomi. Dikotomi dicapai dengan pemisahan median atau penggunaan set batas optimal menurut statistik peringkat yang dipilih secara maksimal dari paket R “maxstat”. Metode kriteria informasi perkiraan minimal (MIC) diimplementasikan dalam paket R “coxphMIC” [ [ 24 ] ] untuk memilih protein serum dengan nilai prognostik potensial. Penanda prognostik potensial ini kemudian dievaluasi dalam analisis regresi Cox multivariat termasuk informasi klinis yang relevan, seperti usia, jenis kelamin, KPS, dan pengobatan konsolidasi TMZ, kecuali jika variabel-variabel ini berkorelasi. Kurva kelangsungan hidup diplot menurut metode Kaplan–Meier dan dibandingkan dengan uji log-rank.
2.7 Imunohistokimia (IHC) untuk CRTAC1
IHC dilakukan untuk CRTAC1 (protein asam tulang rawan 1) pada potongan jaringan 4-μm yang difiksasi formalin dan dibenamkan dalam parafin (FFPE) dengan Leica BOND III otomatis (Leica Biosystems, Nanterre, Prancis) sesuai dengan petunjuk pabrik. Empat belas blok jaringan FFPE dari STS ( n = 7, OS ≤ 12 bulan) dan LTS dengan GB ( n = 7, OS ≥ 30 bulan) yang sampel serumnya dianalisis dengan DIA-MS dipilih untuk IHC. Antibodi anti-CRTAC1 (Proteintech, Planegg-Martinsried, Jerman) digunakan pada pengenceran 1/50 dalam BOND Primary Antibody Diluent (Leica) untuk pengambilan antigen EDTA dan divisualisasikan dengan BOND Polymer Refine Detection (Leica). Gambar digital diambil dengan pemindai Aperio CS2 (Leica) yang dilengkapi lensa objektif 20x dan dianalisis dengan perangkat lunak Aperio ImageScope v12.3.2.8009 (Leica). Analisis semikuantitatif gambar IHC dilakukan dengan perangkat lunak Fiji. Persentase positif dihitung sebagai jumlah piksel positif dibagi dengan jumlah total piksel di area yang dianalisis, dikalikan dengan 100. Enam area tumor dengan ukuran yang sama dianalisis di setiap bagian, dan persentase positif rata-rata dihitung.
2.8 Uji imunosorben terkait enzim (ELISA) untuk CRTAC1
Konsentrasi CRTAC1 juga ditentukan dalam sampel serum dari kelompok independen STS ( n = 12) dan LTS dengan GB ( n = 13), dengan kit ELISA komersial untuk CRTAC1 (EH133RB; Invitrogen, Fisher Scientific, Illkirch, Prancis) yang digunakan sesuai dengan petunjuk pabrik. Sampel serum dari 12 kontrol sehat yang digunakan dalam analisis DIA-MS juga disertakan. Konsentrasi CRTAC1 dihitung dengan membandingkannya dengan kurva standar. Sampel dievaluasi secara duplikasi.
2.9 Analisis statistik
Analisis statistik dilakukan dengan perangkat lunak r (versi 4.1.0; https://www.r-project.org ). Nilai- P dikoreksi untuk beberapa perbandingan (menghasilkan nilai- Q ). Nilai P < 0,05 atau Q < 0,05 dianggap signifikan secara statistik. Selain pengujian yang dijelaskan di atas, perbedaan antar kelompok dinilai dengan uji Mann–Whitney U atau uji Kruskal–Wallis untuk variabel kuantitatif. Korelasi kadar serum protein prognostik potensial dengan parameter hematologi dianalisis dengan menghitung koefisien korelasi Pearson.
3 Hasil
3.1 Identifikasi protein serum yang diinginkan
Kami menganalisis 126 sampel serum (GB = 96, Kontrol = 30) dengan DIA-MS. Karakteristik dasar dari 96 pasien GB terpilih dan kontrol sehat ditunjukkan pada Tabel 1. Secara total, 1305 protein (963 dengan < 30% nilai hilang) diidentifikasi dalam sampel serum (Tabel S1 ). PCA tidak mengidentifikasi outlier di antara sampel serum. Kami mengidentifikasi 622 protein serum yang menunjukkan ekspresi diferensial signifikan antara kelompok GB dan kontrol (Tabel S1 ). Protein ini mencakup 191 dengan |log 2 (FC)| ≥ 0,58 dan AUC ≥ 0,75 (Tabel S2 ), yang kami anggap sebagai protein yang diinginkan. Kami menemukan bahwa 89 protein serum yang diinginkan mengalami peningkatan regulasi pada kelompok GB dan 102 mengalami peningkatan regulasi pada kelompok kontrol (Tabel S2 ).
Tabel 1. Karakteristik demografi dan klinis dari kontrol sehat dan pasien dengan GB yang diobati dengan rejimen Stupp lini pertama.
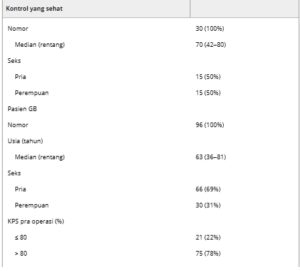
EOR, luas reseksi; GTR, total reseksi bruto (100%); KPS, skor kinerja Karnofsky; MGMT , O6-metilguanina metiltransferase; OS, kelangsungan hidup keseluruhan; PFS, kelangsungan hidup bebas perkembangan; PR, reseksi parsial (<90%); STR, reseksi subtotal (≥ 90%); TMZ, temozolomide.
3.2 Analisis pengayaan fungsional pada protein serum yang diinginkan dan identifikasi modul utama
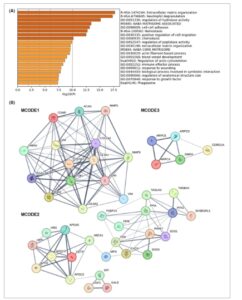
Analisis metascape dari 191 protein serum yang diminati mengindikasikan bahwa mereka terkait dengan 13 proses biologis ontologi gen (GO), tiga set gen reaktom, dua jalur kanonik, dan dua jalur KEGG (Gbr. 1A ). Istilah dengan tiga nilai- P terbaik adalah sebagai berikut: organisasi matriks ekstraseluler (R-HSA-1474244), degranulasi neutrofil (R-HSA-6798695), dan regulasi aktivitas hidrolase (GO:0051336) (Gbr. 1A ). Analisis jaringan PPI pada 191 protein serum yang diminati mengidentifikasi 178 node dan 583 tepi. Tiga modul signifikan diekstraksi dengan alat plugin MCODE dari Cytoscape yang diterapkan pada jaringan PPI, mengidentifikasi 44 protein hub (Gbr. 1B dan Tabel S3 ). Istilah dengan nilai- P terbaik untuk setiap MCODE yang ditunjukkan oleh analisis Metascape adalah: organisasi matriks ekstraseluler (R-HSA-1474244), perakitan, remodeling, dan pembersihan lipoprotein plasma (R-HSA-174824) dan kompleks protein Arp2/3 (CO
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
Analisis pengayaan fungsional dan identifikasi modul-modul utama. (A) Grafik batang Metascape pengayaan istilah fungsional untuk 191 protein serum yang diminati (diberi kode warna menurut nilai- P ). (B) Identifikasi tiga modul paling signifikan dalam jaringan PPI untuk 191 protein serum yang diminati dengan MCODE di Cytoscape (MCODE1: skor = 12,3, nodus = 15; MCODE2: skor = 5,4, nodus = 24; MCODE3: skor = 4, nodus = 5). GB, glioblastoma; PPI, interaksi protein-protein.
3.3 Nilai prognostik protein serum yang diinginkan dan pemilihan protein prognostik potensial
Hasil analisis regresi Cox univariat pada 191 protein serum yang diinginkan berbeda menurut perlakuan protein ini sebagai variabel kontinu atau sebagai variabel dikotomis yang ditentukan menurut median atau titik potong optimal (Tabel S4 dan S5 ). Kami memutuskan untuk memilih kandidat biomarker prognostik menurut kriteria berikut: nilai prognostik untuk PFS dan OS dalam setidaknya dua metode analisis regresi Cox univariat, kuantifikasi ekspresi dalam semua sampel GB, dan pola konkordan (yaitu, arah regulasi) antara analisis diferensial dan analisis prognostik. Lima protein memenuhi kriteria ini: AHSG (glikoprotein A2–Heremans–Schmid), CRTAC1, HRG (glikoprotein kaya histidin), IL1R2 (reseptor interleukin 1 tipe 2), dan TALDO1 (transaldolase 1) (Gbr. 2A ). Sembilan biomarker prognostik serum lainnya dikecualikan oleh metode ini karena mereka dikaitkan dengan PFS dan OS hanya ketika dianggap sebagai variabel dikotomis dengan batas optimal: GPI (glukosa-6-fosfat isomerase), HPR (protein terkait haptoglobin), PGLYRP2 (protein pengenalan peptidoglikan 2), PPIB (peptidylprolyl isomerase B), S100A8 (protein pengikat kalsium S100 A8), S100A9, SERPINB1 (anggota keluarga serpin B 1), SOD3 (superoksida dismutase 3), dan TKT (transketolase) (Gbr. 2A ). Metode MIC yang diterapkan pada lima protein terpilih mengidentifikasi CRTAC1, HRG, dan IL1R2 sebagai biomarker prognostik potensial (Gbr. 2A ).

Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Identifikasi protein yang berpotensi prognostik dalam serum pasien GB ( n = 96). (A) Diagram Venn dan metode MIC yang mengidentifikasi tiga protein serum yang berpotensi prognostik. Kriteria berikut digunakan untuk memilih protein serum prognostik: (1) protein yang diekspresikan secara diferensial antara kelompok GB dan kontrol dengan nilai Q SAM <0,05, |log 2 (FC)| ≥ 0,58 dan AUC ≥ 0,75, (2) protein yang secara konsisten dikaitkan dengan PFS dan OS dalam analisis regresi Cox univariat yang dilakukan oleh setidaknya dua metode (variabel kontinu atau variabel dikotomis yang ditentukan menurut median atau batas optimal), (3) protein yang dikuantifikasi dalam semua sampel GB, (4) protein yang menunjukkan pola yang sesuai (yaitu, arah regulasi) antara analisis diferensial dan analisis prognostik. Lima protein memenuhi kriteria ini: AHSG, CRTAC1, HRG, IL1R2, dan TALDO1; Metode MIC memilih CRTAC1, HRG, dan IL1R2 sebagai biomarker prognostik yang potensial. (B) Kurva Kaplan–Meier untuk CRTAC1, HRG, dan IL1R2. Uji log-rank dilakukan untuk menentukan signifikansi statistik perbedaan kelangsungan hidup ( P < 0,05). GB, glioblastoma; OS, kelangsungan hidup secara keseluruhan; PFS, kelangsungan hidup bebas progresi; MIC, meminimalkan kriteria informasi perkiraan.
Pasien dengan kadar CRTAC1 rendah, kadar HRG rendah, atau kadar IL1R2 tinggi dalam serum memiliki PFS dan OS yang secara signifikan lebih buruk (Gbr. 2B ). Analisis regresi Cox multivariat digunakan untuk menilai nilai prediktif independen kadar serum CRTAC1, HRG, dan IL1R2 untuk PFS dan OS. Kadar IL1R2 serum tetap menjadi faktor prognostik independen untuk PFS, dan kadar CRTAC1 serum tetap menjadi faktor prognostik independen untuk OS setelah penyesuaian untuk variabel lain, termasuk usia, jenis kelamin, KPS, dan TMZ (Tabel S6 ).
3.4 Verifikasi nilai prognostik CRTAC1
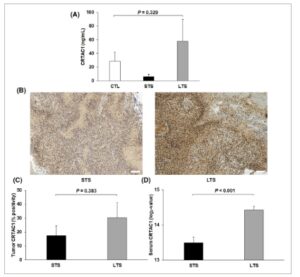
Tingkat serum CRTAC1 diidentifikasi sebagai faktor prognostik independen untuk OS. Oleh karena itu, kami memeriksa, dengan ELISA, konsentrasi protein ini dalam sampel serum dari kontrol sehat dan kohort independen STS dan LTS dengan GB. Konsentrasi CRTAC1 lebih tinggi pada kelompok LTS dan kontrol sehat dibandingkan pada kelompok STS, tetapi perbedaan ini tidak signifikan dalam uji Kruskal–Wallis ( P = 0,329) (Gbr. 3A ). Kit ELISA komersial yang digunakan mungkin tidak cocok untuk kuantifikasi serum CRTAC1, karena banyak sampel memiliki kadar CRTAC1 di bawah konsentrasi minimum yang dapat dideteksi (1,23 ng·mL −1 ): kelompok kontrol = 41,7%, kelompok STS = 66,7%, dan kelompok LTS = 61,5%. Kami juga menyelidiki ekspresi CRTAC1 dalam jaringan dengan pewarnaan IHC pada spesimen tumor dari STS dan LTS yang sampel serum berpasangannya dianalisis dengan DIA-MS. CRTAC1 diekspresikan dalam sel tumor dan matriks ekstraseluler (Gbr. 3B ). Analisis semikuantitatif dari gambar IHC menunjukkan bahwa persentase positif untuk CRTAC1 lebih rendah dalam jaringan STS (17,4 ± 6,9%) dibandingkan dalam jaringan LTS (30,2 ± 10,9%), tetapi perbedaan ini tidak signifikan dalam uji Mann–Whitney U ( P = 0,383) (Gbr. 3C ). Kadar CRTAC1 dalam sampel serum berpasangan, seperti yang ditentukan oleh DIA-MS, juga lebih rendah dalam kelompok STS dibandingkan dalam kelompok LTS ( P < 0,001, uji Mann–Whitney U ) (Gbr. 3D).
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Verifikasi nilai prognostik CRTAC1. (A) Kadar CRTAC1, sebagaimana dinilai dengan ELISA, dalam sampel serum dari kontrol sehat ( n = 12) dan kohort independen STS ( n = 12) dan LTS dengan GB ( n = 13). Tidak ada perbedaan signifikan antara kelompok dalam uji Kruskal–Wallis (rata-rata ± SEM, P = 0,329). (B) Contoh gambar IHC ekspresi CRTAC1 dalam sampel tumor dari STS ( n = 7) dan LTS ( n = 7) dengan GB. Batang skala sesuai dengan 100 μm. (C) dan (D) Kadar CRTAC1 dalam sampel serum dan tumor berpasangan dari STS ( n = 7) dan LTS dengan GB ( n = 7). Kadar serum CRTAC1, sebagaimana ditentukan oleh DIA-MS, secara signifikan lebih rendah pada kelompok STS dibandingkan pada kelompok LTS (rata-rata ± SEM, P < 0,001, uji Mann–Whitney U ) (D). Kadar tumor CRTAC1, sebagaimana ditentukan oleh IHC, juga lebih rendah pada kelompok STS dibandingkan pada kelompok LTS, tetapi perbedaan ini tidak signifikan (rata-rata ± SEM, P = 0,383, uji Mann–Whitney U ) (C). CTL, kontrol sehat; GB, glioblastoma; IHC, imunohistokimia; LTS, penyintas jangka panjang; SEM, standar error rata-rata; STS, penyintas jangka pendek.
3.5 Analisis hubungan antara kadar CRTAC1, HRG, dan IL1R2 dengan parameter hematologi
Kami menilai hubungan CRTAC1, HRG, dan IL1R2 dengan parameter hematologi (Tabel S7 ). Jumlah total sel darah putih dan neutrofil berkorelasi positif signifikan dengan kadar IL1R2 ( masing-masing R = 0,37; Q = 0,005, R = 0,38; Q = 0,003) dan berkorelasi negatif dengan kadar CRTAC1 (masing-masing R = −0,57; Q < 0,001, R = −0,52; Q < 0,001) dan HRG (masing-masing R = −0,39; Q = 0,002, R = −0,38; Q = 0,003).
4 Diskusi
Analisis DIA-MS mengidentifikasi 622 protein serum yang menampilkan ekspresi diferensial yang signifikan antara kelompok GB dan kontrol, termasuk 191 protein yang diminati dengan |log 2 (FC)| ≥ 0,58 dan AUC ≥ 0,75. Analisis fungsional dari 191 protein yang diminati menunjukkan bahwa mereka terkait dengan beberapa istilah yang diperkaya, yang paling signifikan di antaranya adalah organisasi matriks ekstraseluler, degranulasi neutrofil, dan regulasi aktivitas hidrolase. Arora et al. mengidentifikasi 40 protein dengan kelimpahan diferensial dalam sampel serum dari pasien GB dengan metodologi iTRAQ 4-plex [ [ 13 ] ]. Dalam penelitian kami, 20 dari protein ini menunjukkan disregulasi yang sesuai antara GB dan serum kontrol, dan tujuh di antaranya termasuk dalam 191 protein yang diminati: AHSG, C1QA (rantai komplemen C1q A), HRG, LUM (lumican), PGLYRP2, S100A8, dan S100A9.
Analisis nilai prognostik dari 191 protein serum yang menjadi perhatian mengidentifikasi tiga biomarker sirkulasi potensial: CRTAC1, HRG, dan IL1R2. Kadar serum CRTAC1 dan HRG lebih rendah pada pasien GB dibandingkan pada kontrol sehat, dan kadar rendah protein ini dikaitkan dengan PFS dan OS yang buruk. Sebaliknya, kadar serum IL1R2 lebih tinggi pada pasien GB dibandingkan pada kontrol sehat, dan kadar tinggi protein ini dikaitkan dengan PFS dan OS yang buruk. IL1R2 ditemukan sebagai faktor prognostik independen untuk PFS, dan CRTAC1 diidentifikasi sebagai faktor prognostik independen untuk OS. Menilai korelasi potensial antara kadar biomarker prognostik serum ini, perubahan kromosom atau genetik pada jaringan GB, dan status metilasi MGMT tidak memungkinkan karena data yang hilang secara signifikan dalam kohort. Di pusat kami, analisis ini tidak wajib dalam laporan patologi, karena relevansinya terbatas pada pengambilan keputusan klinis lini pertama. Selain itu, kurangnya data proteomik serum skala besar untuk GB yang terkait dengan data klinis juga mencegah penggunaan set data tersebut untuk mendukung potensi prognostik CRTAC1, HRG, dan IL1R2. Untuk mengatasi hal ini, kami menganalisis konsentrasi CRTAC1 dalam sampel serum dari kohort independen STS dan LTS dengan GB menggunakan ELISA, karena protein ini telah diidentifikasi sebagai faktor prognostik independen untuk OS. Kami mengamati bahwa kadar protein ini lebih rendah pada kelompok STS daripada pada kelompok LTS. Hal ini konsisten dengan analisis proteomik berbasis DIA-MS kami sebelumnya yang membandingkan sampel serum dari STS dan LTS dengan GB [ [ 17 ] ] di mana kadar serum CRTAC1 dan HRG lebih rendah pada kelompok STS daripada pada kelompok LTS, sedangkan kadar serum IL1R2 lebih tinggi pada kelompok STS. Namun, ukuran sampel terlalu kecil untuk analisis ELISA dan DIA-MS untuk memiliki daya yang cukup untuk menunjukkan perbedaan yang signifikan. Proporsi rendah LTS dengan GB membuatnya sulit untuk mendapatkan kohort sampel biologis yang besar. Sebelas protein lain—AHSG, GPI, HPR, PGLYRP2, PPIB, S100A8, S100A9, SERPINB1, SOD3, TALDO1, dan TKT—juga diidentifikasi sebagai biomarker prognostik serum yang menarik tetapi tidak dipilih dengan kriteria penyaringan yang digunakan. Dua dari protein ini, S100A8 dan AHSG, telah dilaporkan memiliki nilai prognostik pada pasien GB [ [ 13 , 25 ] ]. Kadar malate dehidrogenase 1 (MDH1) dan ribonuclease inhibitor 1 (RNH1)—dua protein serum yang terkait dengan detoksifikasi spesies oksigen reaktif (ROS) yang sebelumnya kami temukan meningkat secara signifikan pada kelompok STS relatif terhadap kelompok LTS [ [ 17 ]]—tidak berbeda secara signifikan antara kelompok GB dan kontrol dalam penelitian ini, menyoroti hambatan penggunaan biomarker protein ini untuk pemantauan prognostik karena kesulitan dalam menentukan ambang ekspresi yang relevan [ [ 17 ] ]. GPI, TALDO1, dan TKT, yang terkait dengan detoksifikasi ROS, adalah alternatif yang mungkin untuk MDH1 dan RNH1.
Hasil kami konsisten dengan data yang dipublikasikan tentang keterlibatan CRTAC1, HRG, dan IL1R2 dalam onkogenesis. IL-1R2, reseptor umpan IL-1, diekspresikan secara berlebihan dalam berbagai kanker (jaringan dan/atau serum), termasuk kanker payudara, lambung, dan pankreas, dan dikaitkan dengan prognosis yang buruk [ [ 26 – 28 ] ]. HRG, protein yang sebagian besar diproduksi di hati tetapi juga dapat disintesis oleh monosit dan makrofag, telah terbukti memperlambat pertumbuhan tumor pada model tikus berbagai kanker, termasuk GB [ [ 29 , 30 ] ]. Kadar HRG yang lebih rendah dalam darah dikaitkan dengan prognosis yang lebih buruk pada kanker ovarium dan pankreas [ [ 31 ] ]. Kadar HRG serum sangat berkorelasi dengan kadar serum AHSG, protein lain yang diproduksi di hati yang kadar rendahnya diketahui terkait dengan OS yang buruk pada pasien GB [ [ 25 ] ]. CRTAC1, protein matriks ekstraseluler yang awalnya diisolasi dari jaringan kondrogenik manusia [ [ 32 ] ], ditemukan hadir pada tingkat yang lebih rendah dalam plasma pasien glioma dibandingkan dengan pasien nonglioma, dan dalam jaringan glioma dibandingkan dengan jaringan otak bebas tumor [ [ 33 ] ]. Tingkat tumor CRTAC1 yang rendah merupakan prediksi prognosis yang buruk pada berbagai kanker, termasuk kanker kandung kemih, kanker lambung, kanker paru-paru, dan glioma tingkat rendah [ [ 34 – 37 ] ]. Secara konsisten, kami mengamati bahwa tingkat CRTAC1 cenderung lebih rendah dalam sampel tumor dan serum berpasangan dari STS dibandingkan dengan yang dari LTS.
CRTAC1, HRG, dan IL1R2 bukan biomarker khusus kanker, tetapi secara umum terkait dengan berbagai penyakit. Misalnya, IL1R2 adalah biomarker darah dari beberapa penyakit inflamasi seperti Dengue, sepsis, dan rheumatoid arthritis, tetapi hubungan antara kadar yang beredar dan prognosis atau tingkat keparahan penyakit bervariasi [ [ 26 ] ]. HRG adalah biomarker prognostik darah pada pasien dengan sepsis dan pneumonia yang didapat dari komunitas, dengan kadar HRG yang rendah dikaitkan dengan tingkat keparahan penyakit yang lebih besar [ [ 38 , 39 ] ]. Kadar CRTAC1 darah yang meningkat dikaitkan dengan hasil yang buruk pada pasien dengan stroke iskemik akut dan osteoartritis [ [ 40 , 41 ] ].
Mekanisme kerja terperinci dari CRTAC1, HRG, dan IL1R2 dalam perkembangan kanker belum sepenuhnya ditetapkan. Peningkatan IL1R2 telah terbukti mengatur lingkungan mikro tumor imunosupresif, mendorong proliferasi dan invasi tumor, dan mengaktifkan ekspresi faktor angiogenik [ [ 26 , 28 , 42 ] ]. Beberapa penelitian telah melaporkan bahwa peningkatan CRTAC1 menghambat proliferasi, invasi, dan migrasi sel tumor, serta glikolisis dan angiogenesis, dan meningkatkan kemosensitivitas [ [ 37 , 43 – 45 ] ]. HRG telah dijelaskan untuk menghambat pertumbuhan tumor dan metastasis dengan mendorong polarisasi M1 makrofag terkait tumor dan normalisasi pembuluh tumor [ [ 30 , 46 ] ]. Kami mengamati bahwa kadar serum CRTAC1 dan HRG berkorelasi terbalik dengan jumlah neutrofil yang bersirkulasi. Kami dan yang lain sebelumnya telah menunjukkan bahwa tingkat neutrofil yang bersirkulasi adalah penentu utama imunosupresi, perkembangan, dan resistensi pengobatan pada GB [ [ 10 , 47 , 48 ] ]. Hal ini menyoroti bahwa CRTAC1 dan HRG juga dapat memediasi efek antitumornya dengan mengurangi perekrutan neutrofil. Secara konsisten, Yin et al. menunjukkan bahwa HRG menghambat metastasis kanker hati ke paru-paru dengan mengurangi perekrutan neutrofil dan produksi perangkap ekstraseluler neutrofil [ [ 49 ] ]. Demikian pula, You et al. menemukan korelasi terbalik antara ekspresi CRTAC1 dan infiltrasi neutrofil pada pasien dengan kanker kandung kemih [ [ 50 ] ].
Mekanisme dasar yang mengendalikan pelepasan CRTAC1, HRG, dan IL1R2 ke dalam aliran darah pasien GB memerlukan penyelidikan lebih lanjut. Korelasi kadar CRTAC1 antara sampel tumor dan serum yang dipasangkan menunjukkan bahwa kadar rendah CRTAC1 yang bersirkulasi mungkin disebabkan oleh berkurangnya produksi protein ini oleh sel GB. Faktor-faktor yang berkontribusi terhadap penurunan regulasi CRTAC1 dalam jaringan GB masih belum jelas. Mutasi pada daerah promoter CRTAC1 telah disarankan [ [ 33 ] ]. Hipermetilasi promoter CRTAC1 juga dapat bertanggung jawab atas berkurangnya ekspresinya (portal UALCAN, http://ualcan.path.uab.edu ) [ [ 51 , 52 ] ]. Konsisten dengan ini, hipermetilasi promoter CRTAC1 telah diamati pada kanker kandung kemih dan adenokarsinoma paru [ [ 37 , 44 ] ]. Mengenai HRG, kadar darahnya yang rendah pada pasien GB mungkin disebabkan oleh penurunan fungsi hati secara keseluruhan atau peningkatan degradasi HRG oleh sel tumor. Sesuai dengan ini, analisis IHC jaringan GB jarang mendeteksi HRG dalam sel tumor (Human Protein Atlas, https://www.proteinatlas.org ) [ [ 53 ] ]. Kadar IL1R2 darah yang tinggi pada pasien GB mungkin disebabkan oleh peningkatan sekresi oleh sel GB, yang mampu mengekspresikan protein ini (Human Protein Atlas). Ini mungkin juga disebabkan oleh peningkatan sekresi oleh neutrofil, yang dilaporkan sangat mengekspresikan IL1R2. Temuan kami, yang menunjukkan bahwa kadar IL1R2 yang tinggi dalam sampel serum pra operasi dari pasien GB dikaitkan dengan jumlah neutrofil yang bersirkulasi lebih tinggi, mendukung hipotesis ini.
5. Kesimpulan
Proteomik berbasis DIA-MS mengidentifikasi tiga protein serum—CRTAC1, HRG, dan IL1R2—yang diekspresikan secara berbeda antara kelompok GB dan kontrol dan mungkin memiliki nilai prognostik yang potensial. Penelitian lebih lanjut kini diperlukan untuk memahami mekanisme yang mengatur kadar protein ini dalam aliran darah. Karena protein serum ini tidak spesifik untuk GB, model pembelajaran mesin yang mengintegrasikan kadar serumnya dengan data klinis, genomik, dan pencitraan akan sangat penting untuk memanfaatkannya sebagai biomarker prognostik yang andal bagi pasien GB.
