Abstrak
Kanker prostat resistan-kastrasi (CRPC) kemungkinan merupakan hasil pengobatan hormon untuk kanker prostat lanjut. Meskipun tidak lagi bergantung pada kadar androgen, CRPC tetap didorong oleh reseptor androgen (AR). Salah satu mekanisme perkembangan yang diusulkan adalah repertoar protein coregulator yang diubah yang memiliki kemampuan untuk mengubah aktivitas AR. Peningkatan ekspresi motif tripartit yang mengandung 24 ( TRIM24 ) dan TRIM28 —dua anggota subfamili coregulator motif Tripartit (TRIM) yang mengandung bromodomain—terjadi pada CRPC. TRIM24 dan TRIM28 endogen berinteraksi satu sama lain dan AR, mengikat kromatin dan mengatur gen seperti faktor angiogenik faktor pertumbuhan endotel vaskular A ( VEGFA ) dan onkogen MYC . Pembungkaman TRIM24 dan TRIM28 secara bersamaan, tetapi tidak salah satu saja, membuat lini sel model CRPC peka terhadap antiandrogen enzalutamide dan bicalutamide. Resensitisasi terhadap terapi antiandrogen ini kemudian dapat dibalikkan dengan penambahan VEGF. Lebih jauh, ekspresi TRIM24 dan TRIM28 yang dikaitkan dengan tanda-tanda angiogenesis dalam sampel tumor, dan media terkondisi dari sel kanker yang dibungkam TRIM24 dan TRIM28 menghambat proliferasi sel endotel dan pembentukan struktur tabung vaskular. Data kami menunjukkan bahwa protein TRIM24 dan TRIM28 berinteraksi, dengan cara yang spesifik terhadap gen, untuk mengatur aktivitas AR, meningkatkan pensinyalan VEGF dan angiogenesis, dan bahwa menargetkan koregulator ini dapat meningkatkan efektivitas terapi antiandrogen.
Singkatan
ADT
terapi deprivasi androgen
AR
reseptor androgen
ARG (Asosiasi Argologi)
gen yang diatur oleh androgen
BIC
bikalutamid
Chip
Imunopresipitasi kromatin
cm
media terkondisi
KoIP
ko-imunopresipitasi
CRPC
kanker prostat resistan kebiri
DHT
dihidrotestosteron
Bahasa Inggris ENZ
enzalutamida
FFPE
parafin yang difiksasi dengan formalin tertanam
JIKA
imunofluoresensi
Posyandu
imunohistokimia
Tidak ada
reseptor nuklir
PCa
kanker prostat
TMA
jaringan mikroarray
MEMANGKAS
motif tripartit yang mengandung
VC
kontrol kendaraan
Bahasa Indonesia: Ke-VI
tanda tangan indeks vaskularisasi
1 Pendahuluan
Pasien kanker prostat (PCa) dengan penyakit lanjut atau metastasis umumnya diobati dengan terapi hormonal yang bertujuan untuk memblokir pensinyalan reseptor androgen (AR). Pensinyalan AR sangat penting untuk perkembangan dan progresi PCa. Dengan berpindah dari sitoplasma ke nukleus setelah aktivasi ligan (pengikatan androgen), AR mendorong proses transkripsi yang terlibat dalam diferensiasi prostat tetapi, pada kanker, juga mendorong jalur proliferatif yang memediasi progresi kanker. Mengingat peran penting AR dalam biologi PCa, terapi hormonal mencakup terapi deprivasi androgen (ADT) untuk memblokir produksi androgen dan antiandrogen seperti bicalutamide, enzalutamide dan darolutamide untuk secara langsung menghambat aktivitas AR. Memblokir pensinyalan AR awalnya efektif dalam mengurangi beban tumor, namun penyakit ini pada akhirnya akan muncul kembali sebagai PCa resistan kastrasi yang mematikan (CRPC) [ [ 1 ] ]. Yang penting, pada CRPC, sinyalisasi AR tetap aktif, ini juga dapat terjadi melalui produksi androgen intra-tumor, amplifikasi AR dan varian penyambungan AR [ [ 2 ] ], namun di sini kita akan fokus pada pengaruh koregulator dalam perkembangan CRPC.
Selain AR itu sendiri, komponen kunci lain dari pensinyalan AR adalah kelompok protein yang disebut coregulator, yang saat ini terdiri dari lebih dari 300 protein yang memperkuat (ko-aktivator) atau mengurangi (korepresor) aktivitas AR [ [ 3 ] ]. Coregulator memberikan efeknya sebagian besar dalam dua cara. Pertama, mereka dapat berinteraksi dengan dan memodifikasi histon untuk memengaruhi interaksi dengan DNA, mengatur perombakan/aksesibilitas kromatin dan perekrutan mesin transkripsi. Kedua, coregulator dapat memengaruhi aktivitas dinamis protein AR, memengaruhi stabilitas, pengikatan ligan, pergerakan intraseluler, dan interaksi dengan protein lain [ [ 4 – 6 ] ]. Perubahan dalam ekspresi coregulator diyakini sebagai salah satu mekanisme yang memungkinkan PCa bertahan dari terapi antiandrogen dan berkembang menjadi CRPC [ [ 3 , 7 , 8 ] ]. Secara khusus, perubahan coregulator di CRPC disarankan untuk memungkinkan AR direkrut atau tetap aktif pada DNA meskipun kekurangan androgen yang bersirkulasi dan/atau adanya antiandrogen dan untuk mengatur gen kunci tanpa adanya ligan [ [ 3 , 9 ] ].
Protein yang mengandung motif tripartit (TRIM) adalah satu keluarga coregulator [ [ 10 ] ]. Dalam hal ini, subkelompok kecil yang dikenal sebagai keluarga Kelas C-VI yang terdiri dari TRIM24, TRIM28 dan TRIM33 [ [ 10 – 12 ] ] adalah unik di antara protein TRIM karena meskipun mereka mengandung domain RING-finger, B-box dan coiled-coil, mereka juga mengandung domain PHD-finger dan bromodomain, yang mampu mengenali dan mengikat histon terasetilasi dan termetilasi [ [ 10 , 13 , 14 ] ]. Mereka juga sering ditemukan mengalami disregulasi di CRPC; sementara TRIM33 telah dilaporkan mengalami downregulasi, TRIM24 dan TRIM28 muncul dari analisis sistematis literatur sebagai coregulator yang sering mengalami upregulasi di CRPC [ [ 15 ] ]. Baik TRIM24 (TIF1α) dan TRIM28 (TIF1β/KAP1) berinteraksi langsung dengan AR: TRIM24 berinteraksi dengan domain fungsi aktivasi transkripsi (AF-2) C-terminal [ [ 16 , 17 ] ], dan TRIM28 berinteraksi dengan wilayah lain yang penting untuk aktivasi transkripsi, domain Tau1 di N terminus [ [ 18 ] ]. Baik TRIM24 maupun TRIM28 dilaporkan mampu membaca tanda/status histon melalui domain PHD dan bromodomain, serta mampu memodifikasi status asetilasi dan metilasi histon [ [ 13 , 19 – 21 ] ]. TRIM24 adalah ko-aktivator yang diketahui dapat berinteraksi dengan histon (H3K4/H3K23) [ [ 16 , 21 , 22 ] ], sementara TRIM28 telah dideskripsikan memiliki fungsi represor dan berinteraksi dengan sejumlah protein korepresor yang bergantung pada ligan [ [ 23 – 25 ] ], tetapi ekspresinya juga dikaitkan dengan peningkatan aktivitas AR [ [ 18 , 25 ] ]. Lebih jauh lagi, ekspresi keduanya diatur oleh AR dalam loop umpan balik potensial [ [ 22 , 25 ] ]. Di sini, kami mengeksplorasi interaksi antara TRIM24, TRIM28 dan AR dalam pensinyalan androgen dan CRPC. Kami menemukan peran TRIM24 dan TRIM28 yang bekerja bersama untuk memediasi kelangsungan hidup sel PCa yang didorong AR, dengan meningkatkan proliferasi, menurunkan aktivitas caspase dan berpotensi menginduksi angiogenesis melalui kontrol VEGFA.
2 Bahan dan Metode
2.1 Garis sel, kultur dan uji proliferasi
LNCaP (RRID:CVCL_0395), C4-2B (RRID:CVCL_4784), DU145 (RRID:CVCL_0105), PC3 (RRID:CVCL_0035), 22Rv1 (RRID:CVCL_1045) lini sel sebelumnya dibeli dari ATCC, Manassas, VA, USA; sel-sel ini dan sel-sel 22Rv1 tanpa AR berukuran penuh (22Rv1-ARflKO (RRID:CVCL_WK44), hadiah dari Luke Gaughan, Universitas Newcastle, Inggris, [ [ 26 ] ]), R1-AD1 (RRID:CVCL_ZC60) dan R1-D567 (RRID:CVCL_ZC61) garis sel CWR-R1 (hadiah dari Scott Dehm, Universitas Minnesota, AS, [ [ 27 ] ]) secara rutin ditumbuhkan dalam media RPMI (Gibco, Carlsbad, CA, AS) yang disuplemen dengan 10% FBS (F9665, Sigma-Aldrich, St Louis, MA, AS). Dalam pengujian yang mengukur aktivitas DHT, sel ditanam dan ditumbuhkan dalam media RPMI Bebas Phenol-Red (PRF) yang dilengkapi dengan 5% Dextran Coated Charcoal stripped FBS (02-48-850, First Link, Wolverhampton, Inggris). Dalam percobaan yang hanya meneliti enzalutamide, RPMI dengan FBS lengkap digunakan. Lini sel diautentikasi dengan analisis pengulangan tandem singkat (Eurofins, kota Luxembourg, Luksemburg) dan diperiksa secara rutin untuk mengetahui adanya kontaminasi mikoplasma. Sel HUVEC (Lonza C2519, Basel, Swiss) dipelihara dalam EGM Endothelial Medium BlueKit dengan suplemen (Lonza, CC-3121 CC-4133).
Jumlah sel diukur menggunakan uji Crystal Violet (C0775, Sigma-Aldrich) atau reagen MTT (M6494, Sigma-Aldrich) sesuai penelitian sebelumnya [ [ 28 ] ]. Singkatnya, dalam pelat 96-sumur, sel PC3 ditanam pada 5 × 105 sel per sumur, sementara semua lini sel lainnya ditanam pada 3 × 104 . Dalam percobaan yang menguji efek DHT, sel ditanam ke dalam 96-sumur yang ditanam pada 1 × 103 sel per sumur dalam 5% DCC-FBS PRF-RPMI. Perlakuan terdiri dari media segar yang disuplemen dengan DHT (A8380, Sigma-Aldrich), enzalutamide (Enz, S1250-SEL, Stratech Scientific, Cambridge, UK), bicalutamide (BIC, B9061, Sigma-Aldrich) atau kontrol pembawa (VC, etanol, DMSO, Sigma-Aldrich). Untuk pengujian kristal violet, sel difiksasi dengan formalin 1% selama 1 jam, sebelum dicuci dengan PBS, dikeringkan, diwarnai dengan kristal violet (0,4%) selama 1 jam, dicuci dengan air, dikeringkan dengan asam dan dibaca pada OD 570 nm. Untuk MTT, sel diinkubasi selama 4 jam dengan media MTT (5 mg per 10 mL media), kemudian pewarna dielusi dengan larutan isopropanol dan dibaca pada OD 570 nm (Tecan SUNRISE, LifeSciences, Männedorf, Swiss).
Untuk studi transfeksi, sel ditransfeksi dengan 5 μm siRNA gabungan terhadap TRIM24 atau TRIM28 atau kontrol negatif (Thermo Fisher Scientific, Waltham, MA, AS). Dalam uji proliferasi, transfeksi terjadi pada pelat 96-sumur sehari setelah penyemaian, dengan perlakuan ditambahkan sehari setelahnya, pengujian dilakukan seperti di atas. Untuk pengujian yang mengevaluasi efek enzalutamide atau bicalutamide saja, sel diperlakukan dalam media RPMI penuh dengan 10% FCS. Untuk studi yang mencakup VEGF, sel diperlakukan dengan 10 ng·mL −1 protein VEGF rekombinan (PHC9394, Gibco Thermo Fisher). Untuk pengumpulan RNA dan protein, transfeksi terjadi sehari setelah penyemaian, dan hari perlakuan pada hari berikutnya, kemudian pengujian diikuti seperti di bawah ini.
2.2 Analisis ekspresi gen pada penyakit prostat
Ekspresi lebih dari 300 protein yang berinteraksi dengan reseptor nuklir (NR) dinilai dalam tiga set data GSE35988 ( N = 226 pasien) [ [ 29 ] ], GSE70770 (hanya pasien dengan sampel yang mengandung > 70% tumor, N = 68 pasien) [ [ 30 ] ], GSE32269 ( N = 51 sampel pasien PCa) [ [ 31 ] ]. Data array mentah ( GSE35988 , GSE32269 ) atau data yang dinormalisasi/ditransformasikan ( GSE70770 ) diproses menggunakan AltAnalyzer [ [ 32 ] ], yang menggabungkan ekstraksi probeset/fitur, penyelarasan, normalisasi array RMA, dan penghapusan efek batch dengan combat. Ekspresi gen diferensial ditentukan sebagai perubahan di atas 0,5 log2 kali lipat antara status penyakit dengan nilai- P yang disesuaikan (Benjamini–Hochberg) <0,05. Data ekspresi LOG2 juga ditransformasikan ke Z -Score untuk setiap gen (untuk setiap gen = (sampel – rata-rata)/stdev), secara individual dalam setiap kelompok relatif terhadap semua sampel.
Analisis gen yang berpotensi terkait dengan AR , TRIM24 dan TRIM28 dinilai dengan cara berikut. Untuk menilai AR pada CRPC, data AR-ChIP dari model sel CRPC (22Rv1 [ [ 33 ] ], C4-2B [ [ 34 ] ], LNCaP-abl [ [ 22 ] ] dan LNCaP-Bic-resistant [ [ 35 ] ]) dibandingkan dengan data AR-ChIP dari sel LNCaP yang sensitif terhadap androgen. TRIM24 yang serupa dinilai antara sel LNCaP-abl dan LNCaP, dan TRIM28 dinilai dalam sel LNCaP yang diobati plus minus androgen. Pengikatan dinilai dengan Cistrome, menggunakan jalur analisis Snakemake, pemetaan/penyaringan/pengurutan baca menggunakan bwa kemudian samtools, puncak disebut dengan MACS2 ( q < 0,01) [ [ 36 , 37 ] ]. Puncak dengan rasio sinyal-latar belakang kurang dari lima kali lipat disaring. Analisis BETA dan pembuatan skor potensi regulasi untuk setiap gen digunakan untuk mengidentifikasi gen yang terkait dengan puncak pengikatan [ [ 38 ] ]. Analisis jalur dilakukan menggunakan shinygo [ [ 39 ] ].
Dua tanda tangan gen vaskularisasi—tanda tangan vaskularisasi positif 14 gen (VI + ) dan tanda tangan vaskularisasi negatif 22 gen (VI − ) [ [ 40 ] ] dinilai dalam GSE35988 ( N = 226 pasien), GSE70770 ( N = 68 pasien), GSE32269 ( N = 51 sampel pasien PCa) dan TCGA ( N = 499 pasien). Tanda tangan gen aktivitas AR (27 gen [ [ 41 ] ]) dan tanda tangan gen aktivitas CRPC-AR (16 gen [ [ 42 ] ]) juga diperiksa dalam kohort TCGA dan MSKCC PCa. Hubungan antara TRIM24, TRIM28, tanda tangan vaskularisasi, tanda tangan AR dan gen yang ditargetkan TRIM dinilai menggunakan IBM spss Statistics 24, NY, AS.
2.3 Kultur jaringan eksplant yang berasal dari pasien (PDE)
Spons gigi kolagen (Surgispon, Aegis Lifesciences, Gujarat, India) direndam dalam media RPMI yang ditambah dengan 5% FBS dan 1 m m enzalutamide atau kontrol kendaraan yang setara (VC) [ [ 43 ] ]. Jaringan dikumpulkan dari pasien yang setuju dan segera dipindahkan dalam RPMI dingin. Jaringan dibedah dengan hati-hati menjadi kubus berukuran 1 mm3 dan ditempatkan pada spons yang telah direndam sebelumnya dalam pelat kultur jaringan 24 sumur. Sebanyak 500 μL media yang mengandung perawatan ditambahkan ke setiap sumur. Setelah kultur 72 jam, jaringan dikumpulkan dalam formalin untuk studi histologis atau dibekukan untuk analisis RNA. Pemeriksaan histologis dan ekspresi gen mengonfirmasi adanya kanker.
Metodologi penelitian sesuai dengan standar yang ditetapkan oleh Deklarasi Helsinki. Bahan pasien dikumpulkan dari Rumah Sakit Charing Cross (London, Inggris) antara tahun 2018 dan 2023 berdasarkan persetujuan etis dari Imperial College Healthcare Tissue Bank (REC 22/WA/0214) berdasarkan nomor referensi subkoleksi Uro_MW_13_010. Penggunaan dan metodologi eksperimen jaringan manusia disetujui berdasarkan id proyek R18041. Sampel diambil dari pasien yang menjalani diagnosis penyakit primer bervolume tinggi, dengan rentang usia antara 55 dan 88 tahun. Semua pengambilan sampel dilakukan setelah setiap subjek mengonfirmasi pemahaman dan diberikan persetujuan tertulis.
2.4 Percobaan in vivo
Pekerjaan dilakukan berdasarkan ketentuan Animals (Scientific Procedures) Act 1986 dari United Kingdom (HMSO, London, UK, 1990) dan telah disetujui oleh Imperial College Animal Welfare and Ethical Review Body. Penelitian dilakukan berdasarkan nomor lisensi proyek 70/8705. Galur tikus transgenik in house digunakan [ [ 44 , 45 ] ], tikus Pten loxp/loxp yang mengekspresikan ARE-Luc ; tikus Pb – Cre4 (delesi PTEN pada sel epitel prostat) dengan latar belakang C57BL/6J (Laboratorium Jackson, Bar Harbor, ME, USA). Tikus ditempatkan di fasilitas hewan terpusat di Imperial College London, di kandang berventilasi terisolasi dalam kondisi bebas patogen dengan kelembapan dan suhu terkontrol, dan terpapar siklus siang/malam 12 jam. 3–4 tikus ditempatkan per kandang. Semua tikus memiliki akses ke makanan dan air ad libitum , serta alas tidur dan bahan bersarang. Tikus jantan berusia antara 26 dan 32 minggu diobati dengan 6 mg·kg −1 IBET dan/atau 50 mg·kg −1 Enzalutamide (dalam 5%DMSO + 1%CMC + 0,1% P80 oral gavage) setiap hari selama 3 hari, dengan berat badan dan kesehatan umum diukur/diamati selama percobaan sebelum dikorbankan. Jaringan diambil untuk analisis RNA dengan RT-qPCR, dan sampel lainnya diproses dengan FFPE untuk analisis IHC.
2.5 RT-qPCR dan imunoblot
Ke dalam pelat 6-sumur , sel-sel disemai pada 5 × 105 . Dalam percobaan di mana DHT sendiri atau dalam kombinasi dengan enzalutamide sedang diuji, sel-sel kemudian diobati dengan kombinasi DHT, enzalutamide dan pembawa (etanol dan/atau DMSO sebagaimana mestinya) dalam PRF-PRMI dengan DCC-FCS. Dalam percobaan di mana hanya efek enzalutamide dibandingkan dengan kontrol pembawa (VC) yang diuji, sel-sel diobati dengan enzalutamide dalam RPMI dengan 10% FCS, dengan DMSO sebagaimana digunakan pada kontrol pembawa. Untuk RNA, sel diperlakukan selama 24 jam, dan total RNA disiapkan menggunakan kit Monarch® menurut petunjuk pabrik (New England Biolabs, Ipswich, MA, AS), cDNA dibuat (RevertAid First Strand cDNA synthesis Kit, Thermo Fisher Scientific), dan ekspresi diukur dengan QuantStudio™ 7 (Applied Biosystems, Waltham, MA, AS), menggunakan SYBR green (Thermo Fisher Scientific) dengan primer yang dirinci dalam Tabel S1 . Efisiensi primer dihitung untuk semua primer, dan kurva leleh dijalankan untuk semua reaksi. Untuk protein, lisat dikumpulkan setelah perawatan 48 jam dalam buffer RIPA yang dilengkapi dengan inhibitor protease (1/200 μL, P8340, Sigma) dan inhibitor fosfatase (1/200 μL, P5726, Sigma). Protein dicampur dengan buffer pemuatan SDS dan dijalankan pada gel 10%. Protein dipindahkan ke membran Immobilon-P (IPVH85R Sigma), yang diblokir dengan susu skim selama 2 jam sebelum imunopewarnaan dengan antibodi terhadap TRIM24 (1/1000 Santa Cruz, sc-271266, Paso Robles, CA, AS), TRIM28 (1/1000 Invitrogen, 730029, Waltham, MA, AS), AR (1/2000 SantaCruz, sc-7305x), MYC (1/1000 Abcam, ab32072, Cambridge, Inggris), FKBP5 (1/2000 SantaCruz, sc-13983), VEGFA (1/500 Santa Cruz, sc-7269), total caspase 3 (1/1000 Cell Signalling, 9662s, Danvers, MA, AS), caspase-3 terbelah (1/1000 Cell Signalling, 9661S) dan B-Actin (1/3000 Abcam, ab6276). Antibodi primer diuji dengan antibodi sekunder berlabel peroksidase (Sigma A0545/A5278), dideteksi dengan SuperSignal™ West Pico PLUS Chemiluminescent Substrate (Thermo Fisher) dan dicitrakan dengan iBright CL1500 (Thermo Fisher Scientific).
2.6 Ko-imunopresipitasi (CoIP)
Metode diadaptasi dari teknik yang dipublikasikan [ [ 46 ] ]. Secara singkat, sel LNCaP dan 22RV1 disemai dalam pelat 10 cm pada 1 × 106 sel per pelat dan tumbuh dalam PRF-RPMI dengan DCC-FCS hingga konfluensi 80%, 1 pelat per IP dan perlakuan. Sel diperlakukan dengan 10 nm DHT selama 4 jam, kemudian dicuci dengan PBS dan dilisis dengan buffer lisis (50 m m Tris/HCl pH 7,4, 150 m m NaCl, 1 m m EDTA, 2 m m EGTA, 0,25% CHAPS, ditambah inhibitor protease). Lisat dikumpulkan dan disentrifugasi, dengan supernatan diinkubasi semalam pada suhu 4 °C dengan Protein G Dynabeads (10004D, Life Technologies) yang telah dilapisi terlebih dahulu dengan 5 ng antibodi. Manik-manik dicuci, dan protein dielusi ke dalam buffer pemuatan dan dianalisis melalui imunoblot.
2.7 Imunopresipitasi kromatin (ChIP)
Metode ini dilakukan pada sel LNCaP dan 22Rv1 serta pada jaringan manusia [ [ 47 ] ]. Garis sel, disemai ke dalam pelat 15 cm pada 5 × 106 sel per pelat, tumbuh dalam PRF-RPMI + 10% DCC-FCS diperlakukan dengan DHT 10 nm atau volume ekivalen pembawa (etanol), selama 4 jam sebelum fiksasi dengan 1% formaldehida. Untuk jaringan, sampel dipotong menjadi kubus tidak lebih besar dari 0,3 cm 3 sebelum fiksasi, diemulsi menjadi larutan sel tunggal dan disonikasi seperti yang dijelaskan sebelumnya [ [ 48 , 49 ] ]. Setelah lisis dan sonikasi, sampel diinkubasi dengan 5 ng per sampel antibodi terhadap AR (SantaCruz, sc-816x, sc-7305x), TRIM24 (SantaCruz, sc-271266), atau TRIM28 (Invitrogen, 730029), dengan kontrol IgG (Santa Cruz, sc-2025). Untuk ChIP dengan siRNA, sel C4-2B dan 22Rv1 ditanam ke dalam pelat berukuran 15 cm dan ditumbuhkan dalam RPMI + 10% FCS, ditransfeksi dengan 5 μ m siRNA, dan ChIP dilakukan setelah 3 hari.
Data ChIP-seq yang tersedia untuk publik untuk H3K27ac: GSM686937 ( GSE27823 ), GSM1249448 ( GSE51621 ); AR: GSM2480801 ( GSE94682 ), GSM3148986 ( GSE114732 ), GSM1868866 ( GSE72714 ); TRIM24: (GSM1697902 ( GSE69331 ), GSM2891162 ( GSE108144 )), TRIM28: (GSM2480827 ( GSE94682 ) dan GSM2891164 ( GSE108144 )) dianalisis melalui jalur analisis Cistrome [ [ 36 , 37 , 50 , 51 ] ]; Alur kerja analisis Snakemake, pemetaan/penyaringan/pengurutan pembacaan menggunakan bwa kemudian samtools, puncak dipanggil dengan MACS2 ( q < 0,01). Data divisualisasikan menggunakan WashU Epigenome Browser [ [ 51 ] ]. Alat Galaxy DiffBind digunakan untuk analisis puncak diferensial dengan deseq 2 [ [ 52 ] ]. Gen yang terkait dengan data AR, TRIM24 dan TRIM28 dinilai menggunakan analisis BETA-minus menggunakan Cistrome [ [ 38 ] ].
2.8 ChIP-reChIP
ChIP-reChIP dilakukan pada sel LNCaP, C4-2B dan 22Rv1 sesuai metode yang dipublikasikan sebelumnya [ [ 53 ] ] dengan amandemen. Singkatnya, sel diobati dengan 10 nm DHT atau kendaraan volume ekivalen (VC) selama 4 jam, kemudian untuk memaksimalkan pengikatan reseptor-kromatin nuklir, sel difiksasi dalam larutan PBS, 1 m m MgCl 2 , 1 m m CaCl 2 dan 2 m m disuccinimidyl-glutarate sebelum fiksasi formalin [ [ 49 ] ]. Lebih jauh lagi, untuk meningkatkan penarikan protein, RNA kontrol manusia (4307281, Thermo Fisher) dan histon rekombinan 2B (M2505S, New England Biolabs) ditambahkan ke langkah imunopresipitasi [ [ 48 , 49 ] ].
2.9 Imunofluoresensi (IF)
AR, TRIM24 dan TRIM28 divisualisasikan dalam sel LNCaP dan 22RV1 melalui metode imunofluoresensi yang dijelaskan sebelumnya [ [ 54 ] ]. Secara singkat, sel yang disemai pada penutup kaca dalam pelat 24 sumur (1 × 105 sel per sumur) diobati dengan kombinasi 10 n m DHT, 1 μ m Enzalutamide atau kontrol kendaraan yang setara. Sel menjalani fiksasi dengan formaldehida 1% sebelum pencucian PBS-T, pemblokiran dengan BSA dan inkubasi semalam dengan antibodi primer (anti-AR 1/5000, anti-TRIM24 1/1000, anti-TRIM28 1/1000). Antibodi primer divisualisasikan menggunakan Alexa Fluor ® 488 goat anti-mouse IgG (A-11029, Molecular Probes, Life Technologies, Eugene, OR, AS) atau Alexa Fluor ® 568 goat anti-rabbit IgG (A-11036, Molecular Probes, Life Technologies). Inti diwarnai menggunakan DAPI. Fluoresensi ditangkap menggunakan mikroskop EVOS (Thermo Fisher).
2.10 Imunohistokimia (IHC)
Mikroarray jaringan (TMA) sebelumnya dibuat dari 99 pasien PCa, menggunakan sampel dari Imperial College Healthcare Tissue Bank (ICHTB). ICHTB didukung oleh National Institute for Health Research (NIHR) Biomedical Research Centre yang berpusat di Imperial College Healthcare NHS Trust dan Imperial College London. ICHTB disetujui oleh Wales REC3 untuk merilis materi manusia untuk penelitian (22/WA/0214), dan sampel untuk proyek ini (R14122). Dari setiap pasien, 2 inti dari daerah kanker dan jaringan jinak yang ditentukan oleh ahli patologi disertakan [ [ 55 ] ]. Materi tetap dari sampel PDE juga menjalani analisis IHC.
Metode imunohistokimia diadaptasi dari penelitian sebelumnya [ [ 28 , 56 ] ]. Pengambilan antigen yang diinduksi panas digunakan dengan larutan penyangga sitrat 0,01 M (pH 6,0). Potongan dicuci dalam PBS sebelum menginkubasi ON dengan antibodi terhadap TRIM24, TRIM28 dan VEGF (seperti yang digunakan dalam potongan imunoblot). Antibodi terikat dideteksi menggunakan Histostain-Plus IHC HRP Kit dan DAB+ (Life Technologies).
Pewarnaan dinilai secara independen oleh dua ilmuwan, secara buta, pada skala intensitas pewarnaan mulai dari 0 (tidak ada pewarnaan), 1+, 2+, 3+ (kuat). Skor dirata-ratakan untuk setiap sampel. Skor pewarnaan rata-rata dinilai menurut karakteristik klinis atau korelasi menggunakan IBM spss Statistics 24.
2.11 Pengujian pembentukan tabung
Kemampuan sel HUVEC untuk membentuk tabung di hadapan media terkondisikan dari sel kanker yang ditransfeksi dengan siRNA terhadap protein TRIM dinilai menggunakan kit Abcam (ab204726). Secara singkat, pelat 96-well dilapisi dengan 50 μL Matrigel yang dibiarkan selama 1 jam sebelum menerapkan 1 × 10 4 sel HUVEC per well dalam 50 μL media. Ditambahkan ke setiap well adalah 50 μL CM dari sel LNCaP, C4-2B dan 22RV1 yang ditransfeksi dengan siRNA seperti di atas. Media yang mengandung 10 ng·mL −1 VEGF digunakan sebagai kontrol. HUVEC kemudian diinkubasi, dan foto diambil setelah inkubasi 6 dan 18 jam. Pembentukan tabung dinilai secara manual dengan menghitung jumlah struktur cincin yang terbentuk dan jumlah titik percabangan. Pembentukan tabung juga dinilai menggunakan Angiogenesis makro di fiji [ [ 57 , 58 ] ].
2.12 Media yang dikondisikan
Media yang dikondisikan dikumpulkan setelah media segar diinkubasi dengan sel selama 48 jam atau dari eksplan selama 72 jam, media dikumpulkan, disentrifugasi pada kecepatan tinggi selama 5 menit dan disaring (0,22 μm) sebelum digunakan.
2.13 Uji LDH
Untuk mendeteksi LDH yang dilepaskan dari sel sebagai penanda kematian sel, kami menggunakan Uji Sitotoksisitas LDH-Glo (J2381, Promega, Madison, WI, AS). Uji dilakukan menggunakan media terkondisi dari percobaan eksplan dan kultur sel. Uji dilakukan sesuai petunjuk pabrik pembuatnya.
2.14 Tes ELISA VEGF
VEGFA yang disekresikan dideteksi dengan Human VEGF-A ELISA Kit (BMS277-2, Invitrogen). Pengujian dilakukan pada media terkondisi dari model eksplan dan lini sel sesuai petunjuk pabrik pembuatnya.
3 Hasil
3.1 Tingkat ekspresi coregulator yang mengandung bromodomain TRIM24 dan TRIM28 diatur naik dalam CRPC
Analisis terhadap lebih dari 300 coregulator reseptor nuklir (NR) yang diketahui di tiga set data yang tersedia untuk umum mengidentifikasi yang diekspresikan secara berbeda dalam CRPC, yang mana 19 di antaranya diekspresikan secara berbeda secara konsisten di ketiga basis data (Gbr. 1A , Tabel S2 ). Ini terutama mencakup peningkatan regulasi dua dari subkelompok anggota keluarga TRIM yang mengandung bromodomain, TRIM24 dan TRIM28 (Gbr. 1B ). Ekspresi anggota ketiga dari subkelompok ini, TRIM33 , tidak meningkat dalam CRPC (Gbr. S1A ). Ekspresi TRIM24 dan TRIM28 sangat terkait dengan ekspresi AR (Gbr. S1B ). Kami selanjutnya menganalisis data ekspresi TRIM24 / 28 dari 259 sampel yang diambil dari berbagai lokasi penyakit metastasis ( GSE6919 ) dan menemukan peningkatan ekspresi TRIM24 secara signifikan di semua lokasi metastasis dibandingkan dengan tumor primer, sementara TRIM28 juga meningkat pada metastasis hati dan di lokasi metastasis selain getah bening, tulang, dan jaringan lunak lainnya (termasuk adrenal dan otot) (Gbr. S1C ).
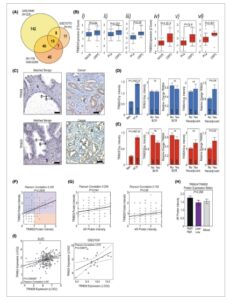
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Ekspresi TRIM24 dan TRIM28 meningkat seiring perkembangan penyakit (A) Analisis ekspresi coregulator berubah secara signifikan ( P < 0,05, LFC > 0,5) pada kanker prostat resistan-kastrasi (CRPC) dibandingkan dengan sampel non-CRPC/kanker prostat primer (PCa) di tiga set data berbeda ( GSE35988 , GSE70770 dan GSE32269 ). Kotak plot ekspresi median di GSE35988 naif n = 59, CRPC n = 35; GSE70770 PCa n = 23, CRPC n = 8, GSE32269 PCa n = 22, CRPC n = 29. (B) Analisis ekspresi TRIM24 (i–iii) dan TRIM28 (iv–vi) dalam sampel CRPC (i/iv) GSE32269 (CRPC dibandingkan dengan PCa primer, sampel ‘Naif’ pengobatan hormon), (ii/v) GSE35988 (CRPC dibandingkan dengan PCa terlokalisasi), (iii/vi) GSE70770 (CRPC dibandingkan dengan sampel PCa terlokalisasi). Signifikansi ditentukan melalui nilai- P yang disesuaikan (Benjamini–Hochberg). (C) Contoh pewarnaan imunohistokimia TRIM24 atau TRIM28 dalam jaringan mikroarray (TMA) dari 99 pasien dengan inti dari kanker dan jaringan jinak yang cocok dari setiap pasien. B, sel basal; C, kanker; E, sel epitel; S, stroma. Skala batang = 25 μm. Skor intensitas ekspresi untuk (D) TRIM24 dan (E) TRIM28 dibandingkan antara sampel kanker prostat (PCa n = 99) dan sampel jinak yang cocok (Ben n = 99), kekambuhan biokimia masa depan (BCR), dan pasien yang menerima vs. tidak menerima terapi hormonal neoadjuvan. Ekspresi TRIM24 dan TRIM28 dievaluasi dalam semua pengaturan ini, dan sebagai perubahan rata-rata antara sampel kanker dan jaringan normal yang berdekatan. Data disajikan sebagai rata-rata n = 99 dengan SEM. Signifikansi ditentukan melalui uji- t . (F) Korelasi antara intensitas pewarnaan TRIM24 dan TRIM28 dalam n = 99 sampel PCa. (G) Korelasi ekspresi protein TRIM24 dan TRIM28 dengan ekspresi AR dalam kohort TMA ( n = 99). Ukuran korelasi dengan metode Pearson. (H) Ekspresi protein AR dalam sampel TMA dikelompokkan menurut ekspresi protein TRIM, TRIM24 dan TRIM28 Tinggi (Tinggi/Tinggi, n = 35) atau TRIM24 dan TRIM28 Rendah (Rendah/Rendah, 21), atau kombinasi ekspresi TRIM lainnya (Campuran, n = 44). Data menunjukkan rerata ± SEM. Signifikansi ditentukan melalui uji- t . (I) Korelasi mRNA TRIM24 dan TRIM28 dalam sampel PCa metastatik dari SU2C (kiri, N = 209) dan GSE21034 (kanan, n = 37) kohort. Korelasi Pearson digunakan untuk menganalisis hubungan dalam ekspresi.
Kami menyelidiki apakah ekspresi yang lebih tinggi ini terbukti juga pada tingkat protein dalam kelompok jaringan yang mencakup kanker dan jaringan jinak yang cocok dari 99 pasien (contoh dalam Gambar 1C ). Dalam jaringan jinak, ekspresi TRIM24 dan TRIM28 minimal atau tidak ada dalam sel epitel luminal, tetapi ada dalam sel epitel basal. Tingkat intensitas TRIM24 dan TRIM28 secara signifikan lebih tinggi dalam jaringan kanker dibandingkan dalam jaringan jinak yang cocok (Gambar 1D,E , P < 0,001, P < 0,05), meskipun tidak ada perbedaan yang signifikan antara tingkat Gleason individu (Gambar S1Di ). Tidak ada perbedaan yang signifikan dalam tingkat protein TRIM24 dan TRIM28 antara pasien yang kemudian kambuh (kambuh biokimia, BCR) dan mereka yang tidak, atau dalam perubahan relatif dalam ekspresi TRIM24 atau TRIM28 dalam sampel kanker dibandingkan dengan jaringan jinak mereka sendiri (Gambar 1D,E ). Dalam sampel kanker dari pasien yang telah menerima terapi hormon neoadjuvant, secara keseluruhan, perubahan ekspresi TRIM24 dan TRIM28 antara kanker dan jaringan jinak meningkat secara signifikan dibandingkan dengan mereka yang tidak menerima ini, meskipun jumlahnya kecil (Gbr. 1D,E , P = 0,04 dan P = 0,03, berturut-turut). Selain itu, ekspresi dan perubahan ekspresi antara jaringan kanker dan jaringan jinak pasien sendiri dari TRIM24 dan TRIM28 berkorelasi secara signifikan satu sama lain dalam jaringan pasien ini (Gbr. 1F , P < 0,001, Gbr. S1Dii ). Baik ekspresi TRIM24 dan TRIM28 berkorelasi dengan ekspresi AR dalam jaringan kanker (Gbr. 1G ), dan jaringan pasien dengan ekspresi protein TRIM24 dan TRIM28 yang tinggi juga menunjukkan tren (tidak signifikan) menuju ekspresi AR yang lebih tinggi (Gbr. 1H ). Kami juga menemukan korelasi ekspresi antara dua gen TRIM dalam dua kelompok metastasis [ [ 59 , 60 ] ](Gbr. 1I ).
Singkatnya, pada jaringan primer, tingkat ekspresi RNA dan protein TRIM24 dan TRIM28 berkorelasi, meningkat pada kanker, tetapi tidak menunjukkan kekambuhan di masa mendatang. Akan tetapi, ekspresi TRIM24 dan TRIM28 meningkat pada penyakit lanjut dan metastasis dan dikaitkan dengan CRPC, yang mungkin menjadi alasan mengapa ada hubungan antara terapi neoadjuvan dan peningkatan ekspresi di lokasi primer. Jika digabungkan, data ini menunjukkan bahwa meskipun meningkat antara kanker dan jaringan normal/jinak, bahkan antara tumor normal/jinak dan Gleason 6, TRIM24 dan TRIM28 mungkin juga penting dalam perkembangan penyakit lanjut dan CRPC.
3.2 Ekspresi dan interaksi TRIM24 dan TRIM28 dengan AR
Untuk memodelkan peran protein TRIM ini dalam CRPC, kami menilai ekspresinya di beberapa lini sel PCa yang berbeda dalam ekspresi AR dan responsivitas terhadap/ketergantungan pada androgen. Dibandingkan dengan lini LNCaP yang AR-positif dan bergantung androgen: pada tingkat protein, TRIM24 diekspresikan lebih tinggi di lini sel yang tidak peka androgen yang mengekspresikan beberapa bentuk AR (C4-2B, 22Rv1 dan turunan AR-FL-KO, R1-AD1 dan turunan R1-D567) dan sangat rendah di lini sel AR-null (PC3, DU145), sementara TRIM28 paling rendah di sel LNCaP dan C4-2B, dan relatif konsisten (dan lebih tinggi) di seluruh lini sel yang tidak peka androgen (Gbr. 2A,C dan Gbr. S2A ). Pada tingkat RNA, TRIM24 diekspresikan secara tinggi dalam model C4-2B, R1-AD1 dan 22Rv1, TRIM28 diekspresikan paling tinggi dalam sel 22Rv1 (Gbr. 2B,C dan Gbr. S2A ). Pengujian proliferasi dalam beberapa lini sel PCa yang ditransfeksi dengan siRNA terhadap TRIM24 , TRIM28 , atau kombinasi keduanya (Gbr. S2B,C ) menunjukkan (menggunakan dua pengujian berbeda) bahwa knockdown mampu mengurangi proliferasi dalam sebagian besar kasus (meskipun meningkat pada R1-AD1) hingga berbagai tingkat dengan sedikit hubungan dengan status AR atau sensitivitas androgen (Gbr. 2D dan Gbr. S2D ).
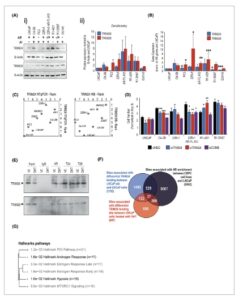
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Interaksi TRIM24 dan TRIM28 dengan reseptor androgen (AR). (A) (i) Imunoblot ekspresi TRIM24 dan TRIM28 di seluruh lini sel, dipisahkan menjadi AR-positif/negatif dan independensi androgen (AI), dengan (ii) densitometri di seluruh sampel, dinormalisasi ke kontrol B-Actin dari setiap sampel (rata-rata n = 3 ±SD). (B) Ekspresi mRNA TRIM24 dan TRIM28 di setiap lini sel (rata-rata n = 3 ±SD). Signifikansi ditentukan oleh uji- t Student , *, **, *** = P < 0,05, 0,01, 0,001, dibandingkan dengan LNCaP (ditetapkan pada 1). (C) Perbandingan peringkat lini sel untuk mRNA TRIM24 dan TRIM28 dan ekspresi protein. Data disajikan sebagai rata-rata n = 3. (D) Uji proliferasi kristal violet dari sel LNCaP, C4-2B, 22Rv1, 22Rv1 AR-FL-KO, R1-AD1 dan R1-D567 yang ditransfeksi dengan siRNA terhadap TRIM24 atau TRIM28 sendiri atau dalam kombinasi. Titik waktu adalah 7 hari pascatransfeksi, data menunjukkan rata-rata n = 4 pengulangan biologis ±ECM. Signifikansi dibandingkan dengan kontrol siNEG melalui uji- t Student = * P < 0,05, ** P < 0,01, *** = P < 0,001. (E) Imunoblot dari lisat Ko-imunopresipitasi (CoIP) dari sel 22rv1 yang diobati dengan dihidrotestosteron (DHT) 10 nm atau kontrol pembawa (VC) yang setara dan mengukur interaksi protein endogen. Perwakilan dari 2 pengulangan CoIP, imunopresipitasi dengan kontrol IgG, AR, TRIM24 atau TRIM28 seperti yang diindikasikan, kemudian imunoblotting untuk protein TRIM24 dan TRIM28. (F) Diagram Venn dari tumpang tindih antara gen yang terkait dengan situs pengikatan TRIM24, TRIM28 dan AR (BS). Data berasal dari eksperimen imunopresipitasi kromatin (ChIP) yang menyelidiki AR antara lini sel kanker prostat resistan-kastrasi (CRPC) dan LNCaP sensitif-androgen [ [ 22 , 33 – 35 ] ], dan ChIP untuk TRIM24 dan TRIM28 dalam sel LNCaP [ [ 22 , 25 , 111 ] ]. (G) Analisis jalur gen yang terkait dengan situs pengikatan AR, TRIM24 dan TRIM28.
Untuk menyelidiki hubungan antara TRIM24, TRIM28 dan aktivitas AR yang berkelanjutan pada CRPC, kami terlebih dahulu menilai interaksi fisiknya dengan AR. Dalam percobaan yang menilai protein yang diekspresikan secara ektopik, anggota subfamili TRIM24, TRIM28 dan TRIM33 membentuk heterodimer [ [ 13 , 61 ] ]. TRIM28 juga mampu menstabilkan ekspresi TRIM24 melalui interaksi dengan SPOP [ [ 25 ] ]. Penilaian interaksi protein endogen pada sel 22Rv1 melalui CoIP mengidentifikasi bahwa protein asli TRIM24 dan TRIM28 berinteraksi secara fisik dan keduanya berinteraksi dengan AR (Gbr. 2E ). Namun, anggota bromodomain lain dari famili TRIM, TRIM33, diketahui berinteraksi dengan TRIM24 atau TRIM28 [ [ 13 ] ] tetapi kami tidak dapat mendeteksi interaksi ini.
TRIM24 dan TRIM28 diketahui mengatur aktivitas AR [ [ 16 , 18 , 21 , 22 , 25 ] ]; menggunakan data sekuensing yang tersedia untuk umum dari sel kanker prostat, kami menilai tempat yang mengalami perubahan dalam status kromatin antara lini sel model CRPC dan sel sensitif androgen, pola pengikatan TRIM24 pada LNCaP yang tidak sensitif androgen dibandingkan dengan sel LNCaP sensitif, dan pola pengikatan TRIM28 diferensial pada LNCaP sebagai respons terhadap androgen (Gbr. 2F ). Kami menilai gen yang terkait dengan perubahan ini untuk AR, TRIM24 dan TRIM28, menemukan 566 gen yang terkait dengan AR dan TRIM24, dan 306 gen yang terkait dengan TRIM28 dan AR (Gbr. 2F ). Analisis jalur gen-gen ini yang berpotensi terkait dengan AR dan TRIM24 atau TRIM28 mendukung peran dalam pensinyalan hormon, kanker, pensinyalan P53 dan mTOR, area pengaruh koregulator pada pensinyalan AR yang terdokumentasi (Gbr. 2G ). Beberapa jalur yang lebih baru mengidentifikasi peran potensial dalam pensinyalan angiogenesis/hipoksia (Gbr. 2G ).
3.3 TRIM24 dan TRIM28 mempengaruhi regulasi androgen pada gen target
Baik TRIM24 maupun TRIM28 terkenal karena perannya dalam mengatur aktivitas AR, jadi selanjutnya kami ingin mengonfirmasi konsekuensi fungsional dari interaksi ini dalam model kami. Pewarnaan imunofluoresensi mengonfirmasi sebagian besar lokasi nuklir AR dan TRIM dengan adanya DHT, sementara dengan adanya enzalutamide, AR sebagian terdeteksi dalam sitoplasma, tetapi baik TRIM24 maupun TRIM28 tetap berada dalam nukleus (Gbr. 3A ). Analisis kumpulan data ChIP mengonfirmasi bahwa dalam nukleus, AR dan TRIM24 serta TRIM28 berinteraksi dengan daerah kromatin terbuka (puncak H3K27ac) yang terkait dengan ARG klasik, KLK3, dan FKBP5 (Gbr. 3B ). Kami mengonfirmasi hal ini dengan eksperimen ChIP yang dilakukan pada lini sel (Gbr. 3C ) dan jaringan PCa pasien (Gbr. 3D ). Untuk menentukan apakah protein AR dan TRIM mengikat secara bersamaan, kami melakukan ChIP-reChIP menggunakan IP awal dengan antibodi AR, kemudian IP kedua untuk TRIM24 atau TRIM28. Baik TRIM24 maupun TRIM28 dapat dideteksi pada daerah pengatur kromatin terikat AR yang terkait dengan gen PSA/KLK3 dan FKBP5 (Gbr. 3E ), yang mengonfirmasi bahwa keduanya direkrut secara bersamaan dengan AR ke daerah ini. Membungkam TRIM24 atau TRIM28, atau membungkam kedua TRIM mengurangi pengikatan AR, dan membungkam salah satu TRIM mengurangi sebagian pengikatan protein TRIM lainnya (Gbr. S2E ). FKBP5 menunjukkan penghapusan yang berkurang atau lengkap dari peningkatan yang distimulasi DHT pada tingkat protein ketika TRIM24 atau TRIM28 dibungkam dalam sel LNCaP yang sensitif terhadap androgen, meskipun kurang pada tingkat RNA (Gbr. 3F,G ). Sensitivitas androgen KLK3 / PSA berkurang pada tingkat RNA (Gbr. 3G ). Dalam PDE dari pasien PCa, kami menemukan bahwa ekspresi gen AR dan target AR lebih tinggi pada pasien yang mengekspresikan kadar tinggi TRIM24 dan TRIM28 (Gbr. 3H ) dan bahwa perubahan sebagai respons terhadap enzalutamide mampu mengubah ekspresi gen (Gbr. 3H ). Lebih jauh lagi, dalam kelompok pasien TCGA dan MSKCC, ekspresi tinggi dari TRIM24 dan TRIM28 dikaitkan dengan peningkatan ekspresi tanda tangan aktivitas AR [ [ 41 ] ] dan tanda tangan aktivitas CRPC-AR [ [ 42 ] ] (Gbr. 3I ). Baik TRIM24 dan TRIM28 cenderung memiliki korelasi yang kuat dengan tanda tangan aktivitas CRPC-AR (Gbr. 3J ).
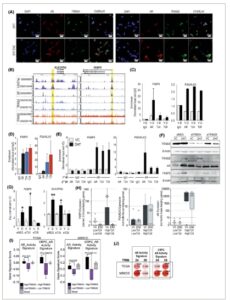
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Interaksi antara TRIM24, TRIM28 dan reseptor androgen (AR) satu sama lain dan kromatin. (A) Lokalisasi imunofluoresensi TRIM24, TRIM28 dan AR sebagai respons terhadap dihidrotestosteron (DHT) ± Enzalutamide (ENZ). Sel LNCaP diobati dengan DHT 10 nm saja atau dalam kombinasi dengan ENZ 10 μm, selama 1 jam sebelum fiksasi dan pewarnaan imunofluoresensi. Nukleus diwarnai biru dengan DAPI, AR berwarna merah, dan TRIM24 atau TRIM28 (sebagaimana diberi label) berwarna hijau. Gambar representatif dari n = 3 eksperimen. Skala batang = 20 μm (B) Contoh pengikatan H3K27ac (GSM686937 [ [ 112 ] ], GSM1249448 [ [ 113 ] ]), AR (GSM2480801 [ [ 111 ] ]), TRIM24 (GSM1697902 [ [ 22 ] ], GSM2891162 [ [ 25 ] ]), TRIM28 (GSM2480827 [ [ 111 ] ], GSM2891164, [ [ 25 ] ]) dalam eksperimen ChIP-seq yang diselesaikan dalam sel LNCaP. Area kuning menunjukkan primer wilayah untuk ChIP-qPCR didesain untuk. (C) ChIP-qPCR gen kandidat dalam sel LNCaP yang diobati dengan DHT 10 nm atau kontrol kendaraan (VC) yang setara. Imunopresipitasi (IP) dilakukan dengan AR, IgG, TRIM24 atau TRIM28 dan PCR untuk target region pada gen seperti yang diindikasikan. Data mewakili lima pengulangan biologis yang dinormalkan ke input dan IgG, dengan batang galat yang mewakili SEM. (D) RT-qPCR dari ChIP AR, TRIM24, TRIM28 diselesaikan dalam empat sampel kanker prostat (rata-rata n = 4 ± SEM ditampilkan) dinormalkan ke input dan IgG. (E) Hasil dari ChIP-reChIP dalam sel LNCaP yang diobati dengan DHT 10 nm atau VC setara, di mana imunopresipitasi (IP) pertama dilakukan dengan antibodi anti-AR atau IgG, kemudian IP kedua untuk AR, TRIM24, TRIM28 atau IgG. Data mewakili rata-rata n = 5 ± SD. (F) Analisis imunoblot untuk sel LNCaP yang ditransfeksi dengan siRNA kemudian diobati dengan DHT 10 nm atau kontrol pembawa (VC) selama 48 jam. Tingkat protein TRIM24, TRIM28, AR dan FKBP5 diukur dengan B-Actin sebagai kontrol pemuatan (B-Actin di bawah protein relevan pada noda yang sama). Gambar representatif dari n = 3 pengulangan biologis. (G) Analisis RT-qPCR dari gen target AR-TRIM dalam sel LNCaP yang ditransfeksi dengan siRNA terhadap TRIM24 dan TRIM28 atau kontrol scr dan diobati dengan DHT 10 nm ( D) atau pembawa yang setara (V). Data menunjukkan rata-rata n = 3 ± SD. Signifikansi ditentukan melalui uji- t Student yang membandingkan pengobatan DHT dengan VC, * P < 0,05, ** P < 0,01. (H) Analisis gen target dalam PDE jaringan pasien PCa yang diobati dengan DHT 10 μ mENZ atau kontrol kendaraan setara (VC) selama 3 hari. Sampel dikelompokkan berdasarkan ekspresi tinggi atau rendah dari gen TRIM24 dan TRIM28 ( N = 9 untuk setiap subkelompok). Ekspresi mRNA gen AR dan target dinilai, direpresentasikan sebagai diagram kotak, statistik dihitung dengan Kruskal–Wallis. Dengan rata-rata ditampilkan sebagai persilangan. (I) Ekspresi tanda tangan gen aktivitas AR dan tanda tangan gen CRPC-AR dalam kelompok data TCGA dan MSKCC. Sampel pasien dikelompokkan menurut tingkat ekspresi TRIM24 dan TRIM28. Uji-t independen digunakan untuk menentukan signifikansi antar kelompok. (J) Korelasi orang TRIM24 dan TRIM28 dengan dua tanda tangan gen dalam set data TCGA dan MSKCC. *** P < 0,001.
Untuk pertama kalinya, kami menunjukkan interaksi kromatin TRIM24 dan TRIM28 pada jaringan pasien, dan secara keseluruhan, data ini menunjukkan bahwa AR, TRIM24, dan TRIM28 berinteraksi pada tingkat kromatin untuk mengatur gen target. Secara khusus, TRIM24 dan TRIM28 memengaruhi pensinyalan AR pada PCa, yang berpotensi mengatur target gen yang terlibat dalam membantu pertumbuhan/kelangsungan hidup berkelanjutan, yang mengarahkan kami untuk berhipotesis bahwa menargetkan kedua TRIM ini dalam kombinasi dengan AR dapat mengurangi tumor dengan mencegah proliferasi.
3.4 TRIM24 dan TRIM28 mempengaruhi proliferasi dan mengubah respons sel kanker prostat yang resistan terhadap terapi terhadap enzalutamide
Selanjutnya kami ingin menyelidiki bagaimana TRIM24 dan TRIM28 mempengaruhi respons sel kanker terhadap terapi antiandrogen. Pada sel androgen/antiandrogen-sensitif, pembungkaman TRIM24 dan TRIM28 sendiri atau dalam kombinasi mengurangi respons terhadap DHT dan respons terhadap antiandrogen pada R1-AD1 [ [ 27 ] ] dan hanya ketika dalam kombinasi pada sel LNCaP (Gbr. S3A ). Penggerak proliferasi MYC adalah gen yang diatur oleh androgen yang diketahui, dan kami menunjukkan bahwa baik TRIM24 maupun TRIM28 mengikat ke daerah pengatur MYC dengan AR (Gbr. S3B–E ); pembungkaman baik TRIM24 maupun TRIM28 menghapuskan peningkatan androgen pada RNA/protein MYC (Gbr. S3F,G ).
Pada lini sel yang hanya mengekspresikan varian AR dan bukan AR dengan panjang penuh (sel 22Rv1-AR-FL-KO dan R1-D567), sel-sel ini resistan terhadap enzalutamide terlepas dari tidak adanya protein TRIM (Gbr. S4A ), mungkin karena kurangnya domain pengikat ligan AR. Pada sel PC3 AR-negatif, tidak ada respons terhadap enzalutamide atau bicalutamide, seperti yang diharapkan, terlepas dari penghentian TRIM (Gbr. 4A ). Menariknya, pada sel AR-positif yang tidak sensitif terhadap androgen (C4-2B dan 22Rv1), ketika TRIM24 dan TRIM28 dibungkam, dan hanya bersama-sama, sel C4-2B dan 22Rv1 menjadi sensitif terhadap enzalutamide 10 μ m , dan sel C4-2B juga terhadap Bicalutamide (Gbr. 4A dan Gbr. S4A,B ), dengan tingkat respons yang sama terhadap antiandrogen ini seperti yang terlihat pada sel LNCaP. Kami mengeksplorasi hal ini lebih lanjut dengan penskalaan dosis dan menunjukkan bahwa respons ini konsisten, bahkan pada dosis rendah. Kombinasi pembungkaman TRIM24 dan TRIM28 membuat C4-2B sensitif terhadap konsentrasi serendah 1 μ m bicalutamide dan enzalutamide dibandingkan dengan 10 dan 20 μ m , masing-masing, dalam siNEG (Gbr. 4B ) dan sel 22Rv1 sensitif terhadap konsentrasi serendah 5 μ m bicalutamide dan enzalutamide dibandingkan dengan 20 μ m dari salah satu di sel siNEG (Gbr. 4C ). Kami menyelidiki lebih lanjut dalam sel 22Rv1 dan melihat bahwa pengurangan siRNA-dimediasi dalam TRIM28 menginduksi respons caspase 3 yang terbelah terhadap enzalutamide, dan bahwa respons ini kemudian bahkan lebih besar ketika TRIM24 dan TRIM28 keduanya dibungkam, menunjukkan peran TRIM24 dan TRIM28 yang memediasi respons apoptosis terhadap enzalutamide (Gbr. 4D ). Dalam media terkondisikan, LDH yang disekresikan sebagai penanda kematian sel meningkat sebagai respons terhadap enzalutamide hanya ketika TRIM24 dan TRIM28 dibungkam (Gbr. 4E ). Pada sel C4-2B dan 22Rv1, siklin D1 ( CCND1 ), pengatur siklus sel dan target AR dan MYC, berkurang ketika TRIM24 dan TRIM28 dibungkam (Gbr. 4F ). Lebih jauh, pengikatan AR dan MYC ke daerah pengatur siklin d1 (berkurang ketika TRIM24 dan TRIM28 dibungkam (Gbr. 4G )). Dalam model PDE, ketika kami menilai kadar caspase-3 terbelah sebagai respons terhadap enzalutamide, jumlah sel positif sebagai respons terhadap enzalutamide lebih tinggi pada sel dengan kadar TRIM24 dan TRIM28 yang lebih rendah (Gbr. 4H ). Pada media terkondisikan dari sampel eksplan ini, deteksi LDH yang disekresikan meningkat secara signifikan sebagai respons terhadap enzalutamide pada sampel yang mengekspresikan TRIM24 dan TRIM28 rendah (Gbr. 4I ). Selain itu, pada tingkat RNA, penanda proliferasi Ki67 dan PCNAmeningkat pada PDE dengan tingkat TRIM24 dan TRIM28 yang lebih tinggi (Gbr. 4J ).

Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Ekspresi TRIM24 dan TRIM28 memengaruhi respons kanker prostat (PCa) terhadap antiandrogen. (A) Uji proliferasi kristal violet yang mengukur respons sel LNCaP, C4-2B, 22Rv1 dan PC3 yang ditransfeksi dengan siRNA terhadap TRIM24 (siT24) atau TRIM28 (siT28) sendiri atau dalam kombinasi, atau kontrol negatif, kemudian diobati dengan 10 μ m Enzalutamide (E) atau Bicalutamide (B) dibandingkan dengan kontrol pembawa (V). Jumlah sel diukur setelah 6 hari, disajikan sebagai N = 4 ± SEM. Signifikansi ditentukan oleh uji- t Student , * = P < 0,05 E atau B dibandingkan dengan V untuk setiap kondisi siRNA. #, ## dan ## = P < 0,05, 0,01 dan 0,001 dibandingkan dengan pengobatan yang sama untuk kondisi siNEG. Dosis respons sel (B) C4-2B dan (C) 22Rv1 yang ditransfeksi dengan siRNA terhadap TRIM24 dan TRIM28 (siCOMB) terhadap peningkatan konsentrasi bicalutamide dan enzalutamide [μm ] , dibandingkan dengan sel C4-2B yang ditransfeksi dengan kontrol siRNA (siNEG). Data menunjukkan rata-rata n = 4 ± SEM. Uji t Student membandingkan dosis enzalutamide dari bicalutamide terhadap VC dalam sel siNEG (tanda bintang hitam) atau siCOMB (tanda bintang ungu), juga perbandingan antara siNEG dan siCOMB (tanda bintang merah). * = P < 0,05, ** = P < 0,01, *** = P < 0,001. (D) (i) Analisis imunoblot sel 22Rv1 yang ditransfeksi dengan siRNA terhadap TRIM24 dan/atau TRIM28, atau kontrol acak, yang diobati dengan dihidrotestosteron (DHT) 10 nm saja (D) atau dengan Enzalutamide (DE) 5 μm selama 48 jam. Kontrol B-Actin berada di bawah gambar protein pada blot yang sama. (ii) Densitometri TRIM24 dan TRIM28, dan (iii) caspase terbelah dan total pada sel yang ditransfeksi (rata-rata ± SD dari n = 3). Signifikansi ditentukan oleh uji- t Student antara kontrol siNEG dan sel yang ditransfeksi dengan siRNA, * = P < 0,05, ** P < 0,01, *** = P < 0,001, dan antara sampel DE dan D # = P < 0,05. (E) Uji LDH mendeteksi LDH yang disekresikan dalam media terkondisi sebagai penanda kematian sel. Data menunjukkan konsentrasi LDH yang terdeteksi dalam media terkondisi dari lini sel yang ditransfeksi dengan siRNA terhadap TRIM24, TRIM28 atau keduanya kemudian diobati dengan enzalutamide atau kontrol. Data menunjukkan rata-rata dari tiga replikasi biologis dan dinormalisasi ke media terkondisi yang diobati dengan VC. Batang galat menunjukkan SD. Signifikansi ditentukan dengan uji- t Student , * = P < 0,05. (F) Ekspresi CCND1 dalam sel C4-2B dan 22Rv1 yang ditransfeksi dengan siRNA terhadap TRIM24 dan TRIM28 sebelum pengobatan dengan 10 μ menzalutamide. Data menunjukkan rata-rata dari tiga replikasi biologis, dinormalisasi ke sampel kontrol negatif, garis galat = SD. Signifikansi antara sampel yang diobati dengan enzalutamide dan VC ditentukan dengan uji- t Student * = P < 0,05, ** = P < 0,01. (G) Eksperimen ChIP yang menggambarkan pengikatan AR, MYC, TRIM24 dan TRIM28 ke daerah pengatur CCND1 dalam sel C4-2B yang ditransfeksi dengan siRNA terhadap TRIM24 dan atau TRIM28. Pengayaan ditentukan relatif terhadap kontrol Input. Data menunjukkan rata-rata dari tiga replikasi biologis, garis galat = SD. (H) Model eksplant yang berasal dari pasien (PDE), di mana jaringan PCa pasien telah dikultur secara eks-vivo selama 72 jam dengan adanya 10 μm Enzalutamide atau kontrol pembawa yang setara (VC). Garis skala = 25 μm. (i) Contoh jaringan PCa PDE yang diwarnai untuk caspase 3 terbelah setelah perawatan dengan enzalutamide atau VC yang setara. Contoh kanker yang ditandai dengan ‘C’, stroma dengan ‘S’, caspase terbelah dengan ‘*’. (ii) Jumlah rata-rata sel caspase 3-positif terbelah per bidang pandang per sampel dengan minimal 100 sel PCa yang dihitung. Sampel dengan ekspresi TRIM24 dan TRIM28 rendah n = 8, ekspresi TRIM24 dan TRIM28 tinggi n = 9. Batang galat menunjukkan SEM. Signifikansi ditentukan dengan uji-t Student . (I) Uji LDH yang mendeteksi LDH yang disekresikan dalam media terkondisikan sebagai penanda kematian sel. Data menunjukkan konsentrasi LDH yang terdeteksi dalam media terkondisikan dari model eksplan, dinormalisasi ke media terkondisikan dari jaringan eksplan yang diobati dengan VC dari setiap pasien (ekspresi TRIM24 dan TRIM28 rendah n = 8, ekspresi TRIM24 dan TRIM28 tinggi n = 9). Batang galat menunjukkan SEM. Signifikansi ditentukan dengan uji t Student . (J) Analisis ekspresi RT-qPCR penanda proliferasi dalam sampel eksplant yang berasal dari pasien (PDE) setelah pengobatan enzalutamide. Sampel dikelompokkan berdasarkan ekspresi TRIM24 dan TRIM28 yang tinggi ( n = 9) atau ekspresi rendah ( n = 10), sampel dengan ekspresi TRIM campuran dikecualikan. Yang ditampilkan adalah median dalam diagram kotak, dengan rata-rata ditampilkan sebagai tanda silang. Signifikansi ditentukan melalui uji U Mann–Whitney .
Mendukung temuan di atas tentang keterlibatan TRIM24 dan TRIM28 dalam pertumbuhan, dalam model in vivo hiperplasia PCa (didorong oleh delesi Pten [ [ 62 ] ]), ekspresi Trim24 dan Trim28 meningkat tajam pada prostat tikus delesi homozigot Pten dibandingkan dengan tikus heterozigot (tanpa fenotipe) atau tikus Pten tipe liar (Gbr. S4C ), mendukung hubungan dengan proliferasi hiper/tak terkendali pada prostat. Pengobatan tikus dengan enzalutamide secara signifikan meningkatkan Trim24 ( P < 0,01, mirip dengan apa yang terlihat pada data klinis dengan terapi neoadjuvan) tetapi tidak ekspresi Trim28 (Gbr. S4D ). Inhibitor bromodomain, IBET (dirancang untuk menghambat Brd4 tetapi terbukti juga menghambat protein lain yang mengandung bromodomain termasuk TRIM24/28 [ [ 15 , 63 , 64 ] ]), juga dapat mengurangi ekspresi Trim24 dan Trim28 dan penanda proliferatif pada tikus ini (Gbr. S4D ). Data lini sel menunjukkan bahwa beberapa efek inhibitor bromodomain dapat bekerja melalui TRIM24 dan TRIM28 karena respons terhadap JQ1 dan IBET berkurang ketika TRIM24 atau TRIM28 dibungkam (Gbr. S4E ).
Secara bersamaan, data ini menunjukkan bahwa TRIM24 dan TRIM28 mungkin memiliki peran dalam mengatur respons sel yang tidak sensitif terhadap androgen terhadap enzalutamide dan bicalutamide, yang mencerminkan CRPC, dan bahwa menargetkan keduanya dapat membuat sel kanker kembali sensitif terhadap antiandrogen. Yang mengejutkan, dalam model lini sel kami yang tidak menunjukkan respons apoptosis terhadap enzalutamide, pengurangan TRIM 24 dan 28 secara bersamaan menyebabkan respons apoptosis yang nyata terhadap pengobatan enzalutamide.
3.5 Ekspresi TRIM24 dan TRIM28 berasosiasi dengan VEGFA, penanda endotel dan invasi vaskular pada sampel pasien
Neo-angiogenesis penting untuk perkembangan kanker secara umum dan telah diusulkan untuk memainkan peran dalam perkembangan CRPC [ [ 65 – 67 ] ]. Ini adalah proses yang dimediasi oleh protein VEGF yang diatur oleh androgen, dan di sini kami menunjukkan VEGF menjadi gen target dari TRIM24 dan TRIM28, serta AR. Data yang tersedia untuk umum menunjukkan interaksi kromatin AR, TRIM24, dan TRIM28 ke daerah H3K27ac di sekitar gen VEGFA (Gbr. 5A ), yang dikonfirmasi dengan eksperimen ChIP kandidat yang menunjukkan peningkatan pengayaan pengikatan AR, TRIM24 dan TRIM28 dengan DHT (Gbr. 5B ) dan mengkonfirmasi pengikatan pada jaringan pasien (Gbr. 5C ). Hubungan antara AR dan TRIM lebih lanjut disorot dengan eksperimen ChIP-reCHIP dengan pengikatan TRIM24 dan TRIM28 ke daerah yang ditarik ke bawah dengan AR-ChIP awal (Gbr. 5D ). Membungkam TRIM24 dan TRIM28 mengurangi pengikatan AR dan MYC (Gbr. 5E ). Membungkam TRIM24 atau TRIM28 mengurangi kemampuan DHT untuk meningkatkan mRNA dan protein VEGFA (Gbr. 5F ). Dalam ELISA, media terkondisikan dari sel C4-2B dengan TRIM24 dan TRIM28 yang dibungkam menunjukkan VEGFA yang disekresikan lebih sedikit, yang selanjutnya tidak lagi diregulasi oleh enzalutamide (Gbr. 5G ). Dalam model PDE dari 19 pasien, jaringan kanker prostat dengan ekspresi TRIM24 dan TRIM28 yang tinggi memiliki ekspresi mRNA VEGFA yang secara signifikan lebih tinggi (Gbr. 5H ), serta penanda proliferasi Ki67 dan PCNA (Gbr. S5A ), juga CDH5 , penanda sel endotel (Gbr. 5H ). Asosiasi ini terlihat pada ada atau tidaknya enzalutamide. Pada media terkondisikan dari sampel eksplan yang sama, kadar VEGFA yang disekresikan lebih tinggi pada sampel yang mengekspresikan kadar tinggi TRIM24 dan TRIM28 (Gbr. 5I ). RNA untuk CD45 , penanda sel endotel/pembuluh darah, juga meningkat pada sampel dengan kadar tinggi TRIM24 dan TRIM28 (Gbr. 5J ).

Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Ekspresi TRIM24 dan TRIM28 berasosiasi dengan VEGFA dalam jaringan pasien. (A) Contoh pengikatan H3K27ac (GSM1249448 [ [ 113 ] ]), AR (GSM3148986, GSM2480801 [ [ 111 ] ], GSM1868866 (C4-2B [ [ 34 ] ])), TRIM24 (GSM1697902 [ [ 22 ] ], GSM2891162 [ [ 25 ] ]), TRIM28 (GSM2480827 [ [ 111 ] ] dan GSM2891164, [ [ 25 ] ]) dalam eksperimen imunopresipitasi kromatin (ChIP)-seq yang diselesaikan dalam sel LNCaP. Area kuning menunjukkan primer region untuk ChIP-qPCR dirancang untuk (B) ChIP-qPCR dari gen kandidat dalam sel LNCaP yang diobati dengan Dihidrotestosteron (DHT) 10 nm atau kontrol kendaraan setara (VC). Imunopresipitasi (IP) dilakukan dengan AR, IgG, TRIM24 atau TRIM28 dan PCR untuk region target dalam gen seperti yang ditunjukkan. Data mewakili lima pengulangan yang dinormalkan ke input dan IgG. Batang galat menunjukkan SEM. (C) RT-qPCR dari ChIP AR, TRIM24 dan TRIM28 diselesaikan dalam empat sampel kanker prostat (rata-rata n = 4 ± SEM ditunjukkan) dinormalkan ke input dan IgG. (D) Hasil dari ChIP-reChIP dalam sel LNCaP yang diobati dengan DHT 10 nm atau VC setara, di mana IP pertama dilakukan dengan antibodi anti-AR atau IgG, kemudian IP kedua untuk AR, TRIM24, TRIM28 atau IgG. Disajikan sebagai rata-rata n = 3 ± SD. (E) Hasil dari CHIP dalam sel C4-2B untuk pengikatan AR, MYC, TRIM24 dan TRIM28 ke VEGFA. Sel C4-2B telah ditransfeksi dengan siRNA terhadap TRIM24 dan atau TRIM28. Data dinormalisasi ke kontrol Input dan mewakili tiga pengulangan biologis ± SD. (F) Ekspresi VEGFA dalam sel kanker LNCaP dan 22Rv1 yang ditransfeksi dengan siRNA terhadap TRIM24 dan atau TRIM28 dan diobati dengan DHT 10 nm atau kontrol pembawa yang setara (VC). Data RT-qPCR mewakili rata-rata N = 3, dinormalisasi ke VC, ±SD. Signifikansi ditentukan melalui uji- t yang membandingkan pengobatan DHT dengan VC, * = P < 0,05, ** = P < 0,01. (G) Data dari ELISA yang mendeteksi konsentrasi VEGFA dalam media terkondisi dari sel C4-2B yang ditransfeksi dengan siRNA terhadap TRIM24 dan TRIM28 dibandingkan dengan kontrol negatif. Sel juga diobati dengan Enzalutamide (ENZ) 10 μ m atau kontrol pembawa (VC). Data menunjukkan rata-rata tiga pengulangan biologis ± SD. Signifikansi ditentukan melalui uji- t Student . (H) Ekspresi VEGF dalam sampel PDE kanker prostat dibagi berdasarkan ekspresi TRIM, menjadi sampel dengan ekspresi TRIM24 dan TRIM28 tinggi (HighT24-HighT28, N = 8) dan sampel dengan ekspresi TRIM24 dan TRIM28 rendah (LowT24-LowT28,N = 8). Ekspresi gen dalam sampel yang diobati dengan 10 μ m enzalutamide (ENZ) atau kontrol kendaraan (VC) selama 72 jam. Hasilnya dinormalisasi ke VC sampel Rendah-Rendah. Digambarkan sebagai boxplot median, whisker mewakili kuartil ke-1 dan ke-4, dengan mean ditunjukkan sebagai persilangan. Signifikansi ditentukan dengan ANOVA. (I) VEGFA ELISA mendeteksi VEGFA yang disekresikan dalam media terkondisikan dari sampel eksplant yang diobati dengan 10 μ m enzalutamide (ENZ). Sampel dibagi dalam sampel yang mengekspresikan HighT24-HighT28 ( n = 8) dan LowT24-LowT28 ( N = 7). Data disajikan sebagai mean ± SEM. Signifikansi ditentukan melalui uji- t Student yang membandingkan ENZ dengan VC. (J) Ekspresi CDH5 (penanda sel endotel) dalam jaringan eksplant menggunakan sampel yang sama yang diuraikan dalam (H). Sampel dibagi dalam sampel yang mengekspresikan HighT24-HighT28 ( n = 8) dan LowT24-LowT28 ( N = 8). Data disajikan sebagai diagram kotak median, whisker mewakili kuartil ke-1 dan ke-4, dengan mean disajikan sebagai tanda silang. Signifikansi ditentukan melalui uji Mann–Whitney U. (K) Contoh pewarnaan VEGFA IHC pada jaringan PCa dalam jaringan mikroarray (TMA) 99 pasien. Area sel kanker (C) dan stroma (S) ditetapkan. Skala batang = 25 μm. (L) (i) Analisis ekspresi protein VEGFA di seluruh jaringan kanker dari berbagai jaringan bergradasi Gleason dan jaringan normal yang cocok dengan pasien. (ii) Ekspresi VEGFA pada pasien dikotomi berdasarkan kadar protein TRIM24 ( n rendah = 42, n tinggi = 56) atau TRIM28 ( n rendah = 42, n tinggi = 55). Data disajikan sebagai mean dari setiap kelompok, dengan batang galat yang menunjukkan SEM. Signifikansi ditentukan melalui Uji- T Independen . (M) Analisis Kaplan–Meier terhadap kekambuhan penyakit dalam kumpulan data TCGA dari 498 pasien yang dikelompokkan menurut ekspresi TRIM24, TRIM28, dan VEGF. (N) Ekspresi penanda sel endotel dalam kumpulan data TCGA pada pasien yang dibagi menjadi pasien yang mengekspresikan TRIM24 dan TRIM28 tinggi (Tinggi-Tinggi) dan TRIM24 dan TRIM28 rendah (Rendah-Rendah). Batang galat menunjukkan SEM. Signifikansi ditentukan oleh uji- t Student . (O) Korelasi ekspresi CDH5 dan TRIM24 atau TRIM28 dalam kumpulan data TCGA, sebagaimana ditentukan oleh korelasi Pearson dan nilai- P yang disesuaikan . (P) Korelasi TRIM24 dan TRIM28dengan tanda gen yang berasosiasi positif dengan vaskularisasi jaringan, dan tanda gen yang berasosiasi negatif dengan vaskularisasi jaringan. Tanda-tanda ini diteliti dalam empat kelompok pasien (setiap baris). Dalam setiap lingkaran terdapat koefisien Pearson, dan *, **, *** menggambarkan nilai- P < 0,05, < 0,01, < 0,001, secara berurutan. Warna lingkaran menggambarkan arah korelasi, merah = korelasi positif, biru = korelasi negatif.
Kami juga memeriksa ekspresi VEGFA dalam kelompok jaringan PCa yang beranggotakan 99 pasien (Gbr. 5K ). Ada intensitas imunopewarnaan VEGFA yang bervariasi dan, secara umum, peningkatan intensitas VEGFA dalam PCa dibandingkan dengan jaringan normal yang berdekatan (Gbr. S5Li ), dan korelasi yang kuat antara kadar VEGFA dalam sampel PCa dan perubahan lipatan dalam pewarnaan VEGFA antara kanker dan jaringan jinak (Gbr. S5Bi ). Ketika kami membandingkan kembali dengan skor pewarnaan untuk protein TRIM, kami menemukan korelasi positif yang signifikan antara VEGFA dan salah satu protein TRIM (Gbr. S5Bii ); lebih lanjut, pasien dengan TRIM24 tinggi atau TRIM28 tinggi memiliki intensitas imunopewarnaan VEGFA yang lebih tinggi (Gbr. S5Lii ). Untuk mendukung hal ini, dalam kumpulan data PCa yang dipublikasikan, kami menemukan ekspresi VEGFA meningkat pada CRPC dibandingkan dengan PCa primer ( P = 4.04E-11, Gambar S5C ) dan korelasi positif ekspresi RNA TRIM24 dan TRIM28 dengan VEGFA (Gambar S5D ). Korelasi serupa juga ditemukan untuk MYC , target TRIM24/TRIM28/AR serta menjadi pengatur VEGF yang diketahui [ [ 68-70 ] ] ( Gambar S5D ).
Lebih jauh lagi, dalam dataset TCGA PCa, jika kita mengelompokkan pasien berdasarkan ekspresi TRIM24 , TRIM28, dan VEGFA , pasien yang memiliki ekspresi tinggi dari ketiganya memiliki waktu tersingkat hingga penyakit kambuh (Gbr. 5M ). Lebih jauh lagi, dalam kohort TCGA ini, ekspresi penanda endotel CDH5 secara signifikan dikaitkan dengan ekspresi TRIM24 dan TRIM28 (Gbr. 5N,O ). Kami juga menilai dua tanda tangan gen vaskularisasi [ [ 40 ] ], tanda tangan gen yang berasosiasi positif dengan vaskularisasi (VI + ) dan tanda tangan gen yang berasosiasi negatif dengan vaskularisasi (VI− ) , dalam empat dataset, menemukan korelasi positif signifikan antara TRIM24 dan tanda tangan VI + dalam dua dari empat dataset (dua sisanya memiliki tren yang sama tetapi tidak signifikan) dan korelasi terbalik dengan tanda tangan VI− dalam dua dari empat dataset (Gbr. 5P dan Gbr. S6 ). Ekspresi TRIM28 berkorelasi signifikan dengan VI + dalam tiga kelompok, kelompok yang tersisa memiliki tren yang sama, dan kami melihat korelasi terbalik yang signifikan dengan tanda tangan VI − dalam dua dari empat kumpulan data (Gbr. 5P dan Gbr. S6 ). Mengingat peran VEGFA, data ini mendukung peran TRIM24 dan TRIM28 dalam angiogenesis.
3.6 Relevansi fungsional TRIM24 dan TRIM28 dalam mediasi VEGF terhadap pembentukan pembuluh darah dan sensitivitas terhadap antiandrogen
Untuk memeriksa hubungan fungsional potensial antara TRIM24/TRIM28 dan VEGFA serta angiogenesis, kami mengumpulkan media terkondisi (CM) dari sel PCa yang di dalamnya TRIM24 atau TRIM28, atau keduanya, telah dibungkam, serta dari sel kanker yang diobati dengan scr-siRNA (siNEG) sebagai kontrol. Kami menilai apakah pembungkaman TRIM memengaruhi kemampuan media terkondisi sel kanker untuk memengaruhi pembentukan tabung HUVEC. Pembungkaman TRIM24 dan TRIM28 dalam sel 22Rv1 yang digunakan untuk menghasilkan CM mengurangi jumlah struktur cincin yang dibentuk oleh sel HUVEC dan jumlah titik percabangan (Gbr. 6Ai,ii,iii ), keduanya merupakan ukuran angiogenesis. Efek ini dapat diselamatkan dengan penambahan VEGF eksogen ke media terkondisi (Gbr. 6Aii,iii ). Pada sel C4-2B, pembungkaman TRIM24 dan TRIM28 menghasilkan CM yang mengurangi jumlah jerat vaskular (Gbr. 6Aii ). Pembungkaman TRIM24 atau TRIM28, secara terpisah atau bersama-sama, mengurangi jumlah sambungan vaskular, yang dapat diselamatkan dengan VEGF eksogen (Gbr. 6Aiii ). Namun, pembungkaman TRIM24 atau TRIM28 pada sel LNCaP tidak mengubah pembentukan jerat atau sambungan vaskular secara signifikan (Gbr. 6Aii,iii ). Selain itu, ekspresi penanda kelangsungan hidup sel, Ki67 , juga berkurang pada sel HUVEC yang diobati dengan CM dari sel kanker yang dibungkam TRIM24 atau TRIM28 dibandingkan dengan sel yang ditransfeksi kontrol (Gbr. S5E ).
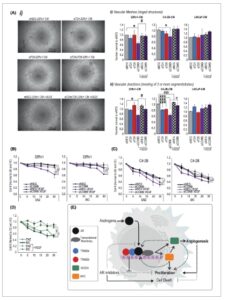
Gbr. 6
Buka di penampil gambar
Kekuatan Gambar
Ekspresi TRIM24 dan TRIM28 mengatur proliferasi sel endotel dan angiogenesis. (A) Uji pembentukan tabung, mengukur kemampuan sel HUVEC untuk membentuk struktur angiogenik setelah 6 jam dengan adanya media terkondisikan (CM) dari sel 22Rv1 yang ditransfeksi dengan siRNA terhadap TRIM24 (siT24), TRIM28 (siT28) atau siRNA kontrol negatif (siNEG). Efek penyelamatan diukur dengan adanya VEGF rekombinan. Kontrol dari inhibitor, no-ECM dan VEGF juga diukur. (i) Contoh gambar struktur angiogenik. Kontrol ditunjukkan pada Gambar. Skala batang = 200 μm. (ii) Analisis jumlah struktur mesh angiogenik yang terbentuk, dan (iii) jumlah sambungan antara tabung vaskular yang terbentuk. Data disajikan sebagai rata-rata dari tiga eksperimen yang dinormalisasi ke siNEG. Batang kesalahan menunjukkan SD. * = P < 0,05, *** = P < 0,001 dibandingkan dengan siNEG, # = P < 0,05, ### = P < 0,001 dibandingkan dengan penambahan VEGF. Statistik ditentukan melalui uji- t Student . Proliferasi sel (B) 22Rv1 dan (C) C4-2B yang ditransfeksi dengan siRNA terhadap TRIM24 dan TRIM28 (siComb) atau kontrol negatif (siNEG), diobati dengan peningkatan dosis enzalutamide atau bicalutamide dengan atau tanpa VEGF. Yang digambarkan adalah jumlah sel rata-rata setelah 3 hari paparan terhadap pengobatan, n = 3. Batang galat menunjukkan SD. Statistik digunakan untuk membandingkan pengobatan antiandrogen dengan VC dan VEGF. Signifikansi ditentukan melalui ANOVA, * = P < 0,05, ** = P < 0,01, *** = P < 0,001. (D) Proliferasi sel LNCaP yang terpapar peningkatan dosis enzalutamide (ENZ) atau bicalutamide (BIC) dengan atau tanpa VEGF. Disajikan sebagai rata-rata n = 4, dengan SEM. Signifikansi ditentukan melalui ANOVA, *** = P < 0,001. (E) Diagram mekanisme yang diusulkan untuk TRIM24 dan TRIM28 dalam pensinyalan AR dan CRPC. Sebagai koregulator, TRIM24 dan TRIM28 bergabung untuk berinteraksi dengan dan membantu regulasi AR terhadap proliferasi melalui peningkatan regulasi MYC, mengurangi kaspase terbelah yang diinduksi enzalutamide dan meningkatkan regulasi VEGFA dan angiogenesis.
Kami lebih lanjut menyelidiki hubungan antara TRIM, VEGF dan CRPC dalam konteks proliferasi sel kanker. Pensinyalan VEGF juga baru-baru ini diusulkan sebagai mekanisme yang memungkinkan PCa menjadi resistan terhadap terapi target AR [ [ 71 , 72 ] ]. Pada sel 22Rv1 dan C4-2B, membungkam TRIM24 dan TRIM28 bersama-sama meningkatkan sensitivitas terhadap enzalutamide dan bicalutamide, seperti pada percobaan sebelumnya. Yang mengejutkan, penambahan VEGF eksogen kembali memberikan resistensi sel 22Rv1 terhadap kedua antiandrogen (Gbr. 6B ) dan mengurangi respons sel C4-2B (Gbr. 6C ). VEGF sendiri tidak meningkatkan proliferasi secara signifikan (Gbr. S5G ). Pada sel LNCaP, penambahan VEGF juga mampu membuat sel secara signifikan kurang responsif terhadap enzalutamide dan bicalutamide, hampir menghilangkan respons mereka (Gbr. 6D ).
Secara bersamaan, data ini menunjukkan bahwa TRIM24 dan TRIM28 meningkatkan peningkatan regulasi AR pada sekresi VEGFA yang mungkin dapat merangsang pertumbuhan sel vaskular sehingga mendorong angiogenesis. Efek VEGFA tampaknya bercabang dua, dengan efek langsung juga pada proliferasi sel kanker, seperti yang diilustrasikan oleh kemampuannya untuk membalikkan resensitisasi (dengan pengurangan TRIM) sel kanker terhadap terapi antiandrogen.
4 Diskusi
Dari data yang disajikan dalam manuskrip ini, kami mengusulkan model di mana peningkatan ekspresi TRIM24 dan TRIM28 dalam CRPC memungkinkan pensinyalan AR yang berkelanjutan (Gbr. 6E ). Secara khusus, pensinyalan AR yang dipengaruhi TRIM24/28 ini meningkatkan gen onkogenik/proliferatif seperti MYC dan VEGFA, yang berpuncak pada peningkatan proliferasi sel PCa dan penurunan respons terhadap antiandrogen. Kami menunjukkan bahwa mengurangi TRIM24 dan TRIM28 dapat membuat model lini sel CRPC yang resistan terhadap terapi menjadi sensitif terhadap antiandrogen, yang sejalan dengan laporan yang menunjukkan bahwa MYC terlibat dalam sensitivitas androgen/resistensi pengebirian [ [ 42 , 68 , 69 , 73 , 74 ] ]. Persyaratan bagi TRIM24 dan TRIM28 untuk dibungkam agar hal ini terjadi menunjukkan beberapa redundansi fungsional antara kedua TRIM. Yang penting, kami menunjukkan bahwa efek resensitisasi ini dapat dibalikkan dengan penambahan VEGF. Sinyal AR yang dimediasi TRIM dan MYC keduanya mampu mengatur VEGF dan pembentukan pembuluh darah, serta ekspresi TRIM yang dikaitkan dengan skor vaskularisasi pada jaringan pasien.
Mengingat dampak klinis dari resistensi terapi pada PCa lanjut, telah terjadi gerakan yang berkembang untuk menargetkan pensinyalan AR yang diawetkan dalam CRPC melalui coregulator dan protein yang berinteraksi, setelah terapi yang diarahkan AR gagal. Dalam hal menargetkan coregulator, coregulator yang mengandung bromodomain telah menjadi perhatian khusus karena kemampuan obatnya [ [ 75 , 76 ] ]. Ada juga perkembangan dalam menargetkan protein TRIM secara lebih spesifik [ [ 20 , 77 – 80 ] ]. Dalam analisis kami terhadap data pasien, lini sel dan model hewan, kami menemukan peningkatan yang konsisten dalam ekspresi TRIM24 dan TRIM28 pada PCa dan perkembangannya, yang konsisten dengan laporan sebelumnya [ [ 22 , 25 , 81 ] ]. Penelitian sebelumnya telah menunjukkan interaksi antara TRIM24, TRIM28 dan AR [ [ 13 , 25 ] ], tetapi di sini kami menunjukkan untuk pertama kalinya bahwa interaksi ini terjadi antara protein endogen dalam sel kanker prostat dan terjadi pada kromatin untuk mengatur interaksi DNA dan transkripsi gen. Dalam model 22Rv1 dan C4-2B CRPC yang tidak sensitif terhadap androgen, menonaktifkan TRIM24 atau TRIM28 tidak membuat sel sensitif terhadap enzalutamide, tetapi menonaktifkan TRIM24 dan TRIM28 secara bersamaan membuat sel-sel yang resistan terhadap antiandrogen ini menjadi sensitif. Kami telah menunjukkan bahwa ada tumpang tindih antara target TRIM24 dan TRIM28, yang menunjukkan bahwa yang satu dapat mengimbangi yang lain dalam hal memengaruhi pensinyalan AR, kemungkinan penjelasan untuk redundansi ini dalam hal efek pada respons antiandrogen. Data kami mendukung paradigma yang berkembang untuk menargetkan interaksi antara coregulator utama dan AR sebagai sarana untuk lebih menghambat aktivitas AR saat merawat pasien dengan penyakit lanjut [ [ 82 – 86 ] ]. Hal ini juga menunjukkan bahwa redundansi barangkali merupakan mekanisme yang terabaikan dalam studi koregulasi: koregulator mungkin dapat dipertukarkan, sampai pada tingkat tertentu, dalam memediasi transkripsi yang dimediasi NR, dan menargetkan keluarga/subkelompok koregulator mungkin diperlukan untuk melihat efek penuh.
Secara mekanistis, efek penargetan TRIM24 dan TRIM28 mungkin melibatkan efek pada proliferasi. Di sini kami menemukan hubungan antara status TRIM sel dan jaringan dengan penanda proliferasi dan penggerak proliferasi seperti MYC dan targetnya cyclin D1, yang baik secara independen maupun sebagai faktor yang diatur oleh AR dapat mengendalikan proliferasi agresif dan kelangsungan hidup [ [ 87 – 90 ] ]. Menariknya, analisis MYC ChIP-seq dalam sel LNCaP menunjukkan ada pengikatan MYC di sekitar promotor gen TRIM24 dan TRIM28 [ [ 91 ] ], yang mungkin menunjukkan adanya loop regulasi/umpan balik. Kami juga melihat hubungan antara ekspresi TRIM24 dan TRIM28 dalam model eksplant dan pembungkaman gen, dengan respons caspase terbelah yang meningkat terhadap enzalutamide, yang mungkin melibatkan asosiasi TRIM dengan P53, karena apoptosis yang dimediasi P53 dilaporkan dipengaruhi secara independen oleh TRIM24 [ [ 92 – 94 ] ] atau TRIM28 [ [ 95 – 98 ] ], dengan hasil pelengkap kami menunjukkan bahwa memiliki ekspresi tinggi keduanya dapat melindungi sel PCa terhadap apoptosis yang diinduksi antiandrogen.
TRIM24 dan TRIM28 telah melaporkan peran dalam memediasi angiogenesis [ [ 99 – 101 ] ], dan pada jenis tumor lainnya, penghambatan protein bromodomain telah dikaitkan dengan penghambatan angiogenesis [ [ 102 ] ]. Di sini kita menemukan regulasi target AR dan faktor angiogenik VEGFA oleh TRIM24 dan TRIM28, yang menghasilkan efek selanjutnya pada proliferasi sel endotel dan pembentukan tabung. Androgen diketahui mengatur angiogenesis [ [ 65 , 103 ] ], dengan elemen respons androgen yang ada dalam promotor VEGFA [ [ 104 ] ]. MYC juga diketahui memengaruhi vaskularisasi tumor [ [ 105 ] ] dan hubungan antara TRIM dan MYC, TRIM dan VEGF, masing-masing, dapat mencerminkan hubungan fungsional dengan TRIM (±AR) yang menjadi bagian dari regulasi MYC pada VEGFA. Meskipun penargetan VEGF/reseptor VEGF memiliki hasil yang bertentangan dalam uji klinis [ [ 106 ] ], penargetan angiogenesis telah dilaporkan baru-baru ini sebagai cara yang layak untuk memblokir pertumbuhan pada model xenograft manusia CRPC [ [ 107 ] ]. Lebih jauh lagi, menggabungkan ADT dengan penghambat VEGF, Bevacizumab, telah dilaporkan meningkatkan kelangsungan hidup pasien PCa [ [ 108 ] ], yang menunjukkan bahwa penargetan angiogenesis mungkin memiliki peran penting dalam melawan CRPC. Baik TRIM24 dan TRIM28 telah dilaporkan memiliki peran nontranskripsi dalam jalur regulasi yang terlibat dalam angiogenesis termasuk memengaruhi respons kerusakan DNA [ [ 94 ] ], memengaruhi jalur pensinyalan transduksi [ [ 109 ] ], serta interaksi dengan SPOP [ [ 25 ] ], yang sendiri telah dilaporkan mengatur protein pensinyalan VEGF [ [ 110 ] ], sehingga ada peluang bagi efek TRIM24 dan TRIM28 pada vaskularisasi menjadi lebih luas. Mengingat temuan kami dalam penelitian ini, penyelidikan lebih lanjut diperlukan dalam bidang angiogenesis yang dimediasi oleh coregulator sebagai sarana untuk menghambat CRPC dan perkembangan kanker.
5 Kesimpulan
Koregulator AR, TRIM24 dan TRIM28, bekerja sama untuk memengaruhi angiogenesis dan respons terhadap pengobatan antiandrogen.
