Abstrak
Sarkoma pleomorfik tak berdiferensiasi (UPS) adalah kanker langka dengan pilihan pengobatan sistemik terbatas dan hasil yang buruk. Untuk mencari intervensi terapeutik baru, kami melakukan analisis mutasi pada 20 tumor pasien UPS, empat lini sel UPS yang mapan, dan tiga model xenograft turunan pasien (PDX). Gen yang sering bermutasi jarang terjadi; sebaliknya, peristiwa jumlah salinan (CN) umum terjadi dengan perolehan CN yang sering diamati pada gen termasuk JUN , EGFR , dan CDK6 serta kehilangan pada WNT8B , RB1 , dan PTEN . Analisis perubahan genom yang tumpang tindih antara tumor pasien dan model PDX atau lini sel mengungkapkan peristiwa yang dapat diobati. Panel obat terpilih yang menargetkan ini dianalisis dalam model UPS in vitro yang menunjukkan bahwa penghambat mitogen-activated protein kinase kinase (MEK) trametinib bersinergi dalam kombinasi dengan penghambat reseptor faktor pertumbuhan fibroblast (FGFR) infigratinib. Hal ini selanjutnya dikonfirmasi sebagai kemanjuran dalam model irisan tumor ex vivo . Secara keseluruhan, hasil kami menunjukkan alasan untuk menggunakan data genomik guna mengidentifikasi golongan obat yang menargetkan kejadian yang dapat diobati pada kanker dengan prevalensi rendah dan menunjukkan bahwa trametinib sendiri atau dalam kombinasi dengan infigratinib harus dieksplorasi lebih lanjut untuk manajemen UPS klinis.
Singkatan
CDK
kinase yang bergantung pada siklin
Bahasa Inggris
salinan nomor
FGFR
reseptor faktor pertumbuhan fibroblast
HCO
onkogenik berkeyakinan tinggi
INDELS
penyisipan dan penghapusan singkat
JAK
kinase Janus
MEK
mitogen-activated protein kinase kinase
PARP
poli (ADP-ribosa) polimerase
PCA
analisis komponen utama
PDX
xenograft yang berasal dari pasien
PI3K
fosfatidilinositol 3-kinase
RPPA
susunan protein fase terbalik
SNV (Nomor Identifikasi Nasional)
varian nukleotida tunggal
STS
sarkoma jaringan lunak
TMB
beban mutasi tumor
UPS
sarkoma pleomorfik tak berdiferensiasi
VEGFR
reseptor faktor pertumbuhan endotel vaskular
VUS
varian yang tidak diketahui signifikansinya
KAMI
pengurutan eksom secara keseluruhan
1 Pendahuluan
Sarkoma jaringan lunak (STS) adalah kelompok tumor heterogen asal mesenkim yang mencakup sekitar 1% dari semua kanker [ [ 1 ] ]. UPS, sebelumnya disebut sebagai histiositoma fibrosa ganas, mencakup sekitar 10–20% dari semua kasus STS dan terdiri dari tumor tanpa garis diferensiasi yang dapat diidentifikasi [ [ 2 ] ]. UPS ditandai dengan tingkat kelangsungan hidup 5 tahun yang buruk sebesar 30–50% setelah diagnosis dan tingkat metastasis sekitar 40% [ [ 3 – 5 ] ]. Manajemen klinis UPS berpusat di sekitar reseksi bedah margin-negatif dengan atau tanpa radioterapi adjuvan dan kemoterapi sistemik [ [ 6 , 7 ] ]. Meskipun tingkat respons terhadap pengobatan agen tunggal rendah, doksorubisin tetap menjadi terapi lini pertama, diikuti oleh ifosfamid sebagai pengobatan lini kedua [ [ 7 , 8 ] ]. Karena pasien dengan UPS tingkat tinggi yang kambuh dan mereka yang datang dengan penyakit lanjut memiliki prognosis yang buruk, ada kebutuhan untuk pendekatan baru yang akan meningkatkan hasil.
UPS dikarakterisasi oleh kariotipe yang kompleks dan kurangnya kejadian penggerak genetik yang terdefinisi dengan baik, dan heterogenitasnya dikarakterisasi oleh variasi CN daripada mutasi titik tunggal [ [ 9 – 14 ] ]. Meskipun demikian, mutasi berulang dalam sejumlah gen terpilih telah diidentifikasi. TP53 diidentifikasi sebagai gen yang paling sering bermutasi pada pasien UPS dengan prevalensi dilaporkan setinggi 69% [ [ 10 , 12 – 16 ] ]. Mutasi yang sering terjadi pada ATRX , RB1 , PTEN , CDKN2A dan KMT2C juga telah dilaporkan [ [ 10 , 12 – 14 , 17 ] ]. Kejadian fusi gen yang melibatkan RB1 dan PRDM10 hadir dalam sebagian kecil kasus UPS, meskipun signifikansi fungsionalnya tidak jelas [ [ 9 , 13 , 16 , 18 ] ]. Meskipun analisis genom UPS telah mengungkap perubahan yang berpotensi dapat ditindaklanjuti secara klinis, termasuk laporan kasus di mana pendekatan ini mengarah pada identifikasi terapi yang manjur pada model PDX tikus [ [ 19 ] ], tidak ada laporan yang menunjukkan bahwa hal ini mengarah pada perubahan dalam keputusan pengobatan klinis atau perekrutan pasien ke dalam uji klinis, seperti halnya subtipe STS lainnya [ [ 13 , 20 ] ].
Faktor pembatas lain dalam identifikasi pengobatan efektif untuk UPS adalah kurangnya model praklinis yang mencerminkan penyakit klinis yang dapat digunakan untuk mendukung evaluasi obat baru yang potensial. Di sini kami telah menggunakan panel lini sel UPS yang diberi anotasi dengan baik [ [ 21 , 22 ] ] dan menggambarkan pembuatan lini sel UPS turunan PDX yang baru, yang menunjukkan bahwa profil genomiknya mencerminkan yang terlihat pada sampel pasien. Kami juga menunjukkan kemampuan irisan tumor turunan PDX untuk memberikan pendekatan eks vivo alternatif untuk menilai respons obat. Data genomik digunakan untuk mengidentifikasi kejadian yang dapat diobati dan kelas obat yang berpotensi berkhasiat yang kemudian diuji dalam model UPS praklinis kami. Hasil in vitro dan eks vivo menunjukkan bahwa penghambat MEK trametinib, dalam kombinasi dengan penghambat FGFR infigratinib, harus diselidiki lebih lanjut sebagai pengobatan alternatif atau komplementer untuk terapi UPS yang saat ini disetujui.
2 Bahan dan Metode
2.1 Etika dan sampel klinis
Penelitian ini dilakukan sesuai dengan pedoman persetujuan umum untuk penggunaan jaringan yang diperoleh melalui pembedahan dan disetujui oleh NHS Lothian NRS BioResource dan Kantor Kesehatan Masyarakat dengan pemahaman dan persetujuan tertulis dari setiap subjek dan sesuai dengan standar yang ditetapkan oleh Deklarasi Helsinki. Lothian NRS BioResource adalah bank jaringan penelitian yang disetujui HRA (REC Ref: 20/ES/0061). Persetujuan diberikan oleh East of Scotland Research Ethics Service REC 1. Dua puluh sampel UPS dan jaringan normal yang berdekatan dikumpulkan saat pembedahan. Sebelum pengurutan eksom, potongan yang diwarnai H&E dari setiap sampel dievaluasi oleh ahli patologi (DMS) dan diverifikasi sebagai UPS.
2.2 Model PDX
Perbandingan morfologi dan pewarnaan vimentin, sitokeratin dan Ki67 antara tumor pasien asli dan model IEC-16 dan IEC-56 PDX ditunjukkan pada Gambar S1 . IEC-56 diperbanyak dengan implantasi subkutan bilateral dari fragmen tumor ke tikus betina CD-1 Nude (Charles River, Wilmington, MA, AS) dan Rag2-Il2rg double knock-out (R2G2; Inotiv, Lafayette, IN, AS) berusia 6–8 minggu. Tikus dipantau dua kali seminggu dan panjang dan lebar tumor diukur menggunakan jangka sorong; volume tumor dihitung menggunakan rumus ([ L × W 2 ]/2). Setelah mencapai diameter tumor 10 mm, tikus dimusnahkan, dan sebagian dari setiap tumor diangkat dan disimpan dalam larutan NBF 10% (Sigma-Aldrich, Saint Louis, MO, AS) untuk penanaman. Tumor yang tersisa disimpan dalam PBS untuk pemotongan jaringan atau kultur, ditanamkan kembali dalam keadaan segar atau beku sebagai fragmen untuk dipindahkan. Semua percobaan pada hewan telah disetujui oleh Badan Kesejahteraan Hewan dan Tinjauan Etika Universitas Edinburgh (PL05-21) dan dilakukan sesuai dengan pedoman yang ditetapkan oleh Peraturan Kementerian Dalam Negeri Inggris (Undang-Undang Hewan [Prosedur Ilmiah] 1986) dengan nomor lisensi PP7510272.
2.3 Pemotongan dan kultur tumor PDX
Compresstome™ VF-310-0Z (Instrumen Presisi; pengaturan kecepatan: 5, pengaturan osilasi: 9) digunakan untuk memperoleh irisan jaringan yang dipotong presisi (300 μm ) dari tumor IEC-56 PDX yang ditanamkan dalam gel agarosa 2% (Invitrogen, Waltham, MA, AS). Irisan jaringan dikulturkan di atas sisipan kultur sel Millicell 0,4 μm ( Millipore, Burlington, MA, AS) dalam pelat enam sumur. Irisan tersebut dikulturkan dalam Advanced DMEM (Gibco, Waltham, MA, AS) yang dilengkapi dengan 10% v/v FBS (Gibco), 1% v/v Penicillin–Streptomycin (Gibco) dan 1% v/v GlutaMAX (Gibco).
2.4 Generasi garis sel turunan PDX IEC-56
Tumor IEC-56 PDX segar dicacah menjadi fragmen kecil dan ditempatkan dalam inkubator pengocok pada suhu 37 °C selama 1 jam dalam medium disosiasi yang mengandung Advanced DMEM (Gibco), 5% v/v FBS, 1% v/v Penicillin–Streptomycin, 1% v/v ITS (Gibco), 10 ng·mL −1 EGF (PeproTech, Cranbury, NJ, AS), 10 μg·mL −1 Hidrokortison (Sigma-Aldrich), 0,5 mg·mL −1 Kolagenase (Sigma-Aldrich), 0,1 mg·mL −1 Hyaluronidase (Sigma-Aldrich) dan 0,1 mg·mL −1 DNase I (Sigma-Aldrich). Suspensi sel selanjutnya diinkubasi dalam RBC Lysis Buffer (Invitrogen), diikuti dengan inkubasi dengan 0,05% Trypsin/EDTA dan 1 mg·mL −1 DNase I sebelum melewati filter 70 μ m . Semua reagen dilengkapi dengan 10 μM Y27632 dihidroklorida (Tocris, Bristol, Inggris). Sel tikus dipisahkan dari suspensi dengan penyortiran sel yang diaktifkan secara magnetik menggunakan Mouse Cell Depletion Cocktail dan LS Columns (Miltenyi Biotec, Bergisch Gladbach, Jerman) sesuai dengan petunjuk pabrik. Untuk pembuatan lini sel, sel disemai dalam cawan kultur sel berukuran 10 cm yang dibiarkan tidak terganggu selama 5–7 hari sebelum perubahan media apa pun.
2.5 Kultur sel
Empat lini sel sarkoma UPS SHEF UPS01 ( RRID:CVCL_C8V9 ), SHEF UPS02 ( RRID:CVCL_C8VA ), SHEF UPS03 ( RRID:CVCL_C8VB ) [ [ 21 ] ] dan SHEF UPS04 ( RRID:CVCL_C8VI ) [ [ 22 ] ] dikulturkan seperti yang dijelaskan sebelumnya dan disediakan oleh Dr. Karen Sisley (Universitas Sheffield). Lini sel IEC-56 dibuat dan divalidasi (lihat Bagian 2.4 dan Gambar 2 ) sebagai bagian dari penelitian ini dan tidak memiliki Pengenal Sumber Daya Penelitian. Semua sel secara rutin diperiksa untuk mengetahui adanya kontaminasi mikoplasma, dan eksperimen dilakukan dengan sel bebas mikoplasma. Sel diverifikasi melalui profil pengulangan tandem pendek (STR) (dilakukan pada Agustus 2022 untuk lini sel IEC-56 dan Februari 2023 untuk lini sel SHEF UPS01-04 oleh Institut Genetika dan Layanan Teknis Kanker).
2.6 Studi kemanjuran obat pada titik akhir
Sel disemai ke pelat 384-well dengan dasar datar (Greiner, Kremsmünster, Austria) diikuti dengan penambahan senyawa (lihat daftar lengkap dan detail pada Tabel S1 ) 24 jam pasca penyemaian. Setelah pengobatan 72 jam, sel diwarnai dengan 1 μ M Hoechst 33342 (Thermo Scientific, Waltham, MA, AS) selama 1 jam dan dicitrakan menggunakan perangkat ImageXpress Micro XL (Molecular Devices, San Jose, CA, AS) dengan empat bidang pandang (objektif 10x) untuk mendapatkan jumlah inti di setiap well. Hasilnya dianalisis menggunakan perangkat lunak Metaxpress (Molecular Devices). Hasil studi kombinasi obat dianalisis menggunakan perangkat lunak Synergyfinder + [ [ 23 ] ] dan terutama model ZIP [ [ 24 ] ].
Spheroid 3D dibiarkan beragregasi selama 72 jam pasca-penyemaian dalam pelat 384-well dengan perlekatan sangat rendah (S-BIO, Hudson, NH, AS) dan selanjutnya diperlakukan dengan senyawa selama 72 jam berikutnya. Untuk pengukuran titik akhir, spheroid diinkubasi dengan PrestoBlue Cell Viability Reagent (Invitrogen) selama 3 jam pada suhu 37 °C, dan intensitas fluoresensi diukur menggunakan pembaca pelat Spark 20 M (Tecan, Männedorf, Swiss). Nilai IC50 untuk obat yang diuji dalam 2D dan 3D dihitung menggunakan perangkat lunak Prism 10 (GraphPad, San Diego, CA, AS).
Viabilitas awal irisan tumor diperoleh dengan menginkubasi irisan tersebut segera setelah diiris dengan PrestoBlue Cell Viability Reagent selama 1 jam pada suhu 37 °C. Media dipindahkan ke pelat dasar datar 96-sumur sebanyak tiga kali, dan intensitas fluoresensi diukur menggunakan pembaca pelat Spark 20 M (Tecan). Irisan dibiarkan mencapai keseimbangan selama 24 jam sebelum pengobatan obat dan diobati selama 120 jam dengan satu kali penggantian media pada 48 atau 72 jam setelah dimulainya pengobatan. Irisan tersebut kemudian diinkubasi dengan PrestoBlue Cell Viability Reagent selama 1 jam pada suhu 37 °C, dan intensitas fluoresensi diukur seperti di atas.
2.7 Analisis genomik
Untuk deskripsi lengkap dari seluruh prosedur sekuensing eksom, lihat Metode S1.1–S1.3 . Langkah-langkah pemrosesan genomik yang sama dilakukan pada sampel internal kami serta data UPS mentah (Fastq) yang dipublikasikan yang dihasilkan dalam proyek TCGA Sarkoma ( n = 44) [ [ 10 ] ]. Semua data yang diurutkan diselaraskan dengan genom referensi manusia GRCh38 menggunakan bwa-0.7.17 [ [ 25 ] ], duplikat ditandai dan skor kualitas dasar dikalibrasi ulang dengan Genome Analysis Toolkit (GATK) v4 [ [ 26 ] ] dalam alur kerja bcbio 1.0.6 (lihat Metode S1 : Pemetaan bacaan yang diurutkan). Mutasi didefinisikan sebagai peristiwa genomik yang mencakup SNV (varian nukleotida tunggal) dan INDEL (penyisipan dan penghapusan pendek). Mutasi dipanggil menggunakan sistem suara mayoritas dari tiga pemanggil varian: VarDict [ [ 27 ] ], Mutect2 [ [ 28 ] ] dan Freebayes [ [ 29 ] ] dan selanjutnya difilter untuk menghilangkan artefak teknis dan kemudian menghilangkan varian umum dan kemungkinan nonfungsional melalui pendekatan model berbasis skor (Metode S1 : Pemanggilan dan klasifikasi varian). Singkatnya, ini melibatkan mengikuti jalur yang diterbitkan sebelumnya untuk penilaian kumulatif menggunakan basis data kanker yang diberi anotasi dengan baik, polimorfisme nukleotida tunggal populasi dan pendekatan pemodelan prediktif untuk mengklasifikasikan varian sebagai jinak, kemungkinan jinak, varian dengan signifikansi tidak diketahui, kemungkinan onkogenik atau onkogenik [ [ 30 ] ]. Untuk fokus pada hasil yang dapat diterjemahkan, mutasi onkogenik dan kemungkinan onkogenik digabungkan menjadi satu kelompok yang didefinisikan sebagai mutasi ‘onkogenik keyakinan tinggi’ (HCO).
Data CN dihasilkan menggunakan CNVkit (V 0.9.3) menggunakan ambang batas default untuk menentukan ‘gain’ (CN = 3), ‘amplifikasi’ (CN > 3), ‘penghapusan dangkal’ (CN = 1) atau ‘penghapusan dalam’ (CN = 0) [ [ 31 ] ] dengan (a) tumor pasien dan model PDX: dataset tulang punggung genomik turunan darah normal yang cocok jika tersedia dan jika tidak, dataset normal sampel turun rata-rata yang dihasilkan dari sampel normal ini; (b) lini sel: data dari lini sel nontumor (HCC1143_BL) sebagai dataset normal latar belakang. Semua dataset normal diproses secara paralel dengan sampel tumor melalui penyelarasan dan jalur pemrosesan yang sama. Analisis beban mutasi tumor (TMB) dilakukan pada semua mutasi, sementara gen yang diinginkan untuk analisis SNV difokuskan pada gen yang ditetapkan sebagai kemungkinan patogenik dan patogenik saja. Analisis CN difokuskan pada gen dengan fungsi kanker terkait seperti yang ditentukan oleh set gen kanker yang diambil dari daftar gen yang ditentukan oleh OncoKB [ [ 32 ] ].
Analisis varian dilakukan menggunakan paket R maftools [ [ 33 ] ]. Data SNV TCGA digunakan sebagai pemeriksaan sense tumor padat Edinburgh, lini sel, dan model PDX. Analisis komponen utama (PCA) digunakan pada matriks biner kejadian untuk mutasi HOC atau gen kanker oncoKB yang mengandung kejadian CN, menggunakan fungsi prcomp di R. Peta panas untuk analisis CN diplot menggunakan skrip R kustom untuk melakukan pengelompokan hierarkis. Baris dan kolom dengan varians nol disaring, dan pengelompokan dilakukan menggunakan jarak Manhattan untuk baris dan jarak korelasi untuk kolom, keduanya dengan metode Ward.
2.8 Susunan protein fase terbalik
Sel-sel dilisiskan dalam buffer RIPA yang dilengkapi dengan cOmplete™ EDTA-free Protease Inhibitor Cocktail (Roche, Basel, Swiss), natrium fluorida, dan natrium ortovanadat. Konsentrasi protein diukur menggunakan Pierce™ BCA Protein Assay Kits (Thermo Scientific) sesuai dengan petunjuk pabrik. Sampel diencerkan menjadi 2 mg·mL −1 dan diprofilkan pada platform Quanterix dan Innopsys reverse-phase protein array (RPPA) oleh Host and Tumor Profiling Unit (University of Edinburgh) seperti yang dijelaskan sebelumnya [ [ 34 ] ]. Secara singkat, sampel didenaturasi pada 95 °C selama 5 menit dan diencerkan secara serial dari 1,5 mg·mL −1 menjadi 0,1875 mg·mL −1 . Keempat pengenceran sampel diteteskan ke slide nitrocellulose ONCYTE® SuperNOVA pad tunggal (Grace Bio-Labs, Bend, OR, AS) dengan platform 2470 Arrayer (Quanterix, Billerica, MA, AS). Larutan Kuat 1× Reblot Plus (Millipore) digunakan untuk pengambilan antigen diikuti dengan pemblokiran dalam SuperBlock T20 (TBS) (Thermo Scientific). Slide kemudian diinkubasi dengan antibodi primer (Tabel S4 ) yang diencerkan 1 : 250 dalam SuperBlock T20, diikuti dengan inkubasi dengan antibodi anti-spesies berlabel Dylight-800 (New England BioLabs, Ipswich, MA, AS) yang diencerkan 1 : 2500 dalam SuperBlock T20. Rangkaian tersebut dicitrakan dengan pemindai Innoscan 710 (Innopsys, Carbonne, Prancis) dan nilai intensitas fluoresensi relatif yang sesuai dengan kelimpahan protein dikuantifikasi menggunakan perangkat lunak Mapix (Innopsys).
3 Hasil
3.1 Lanskap genomik UPS di seluruh sampel pasien, model PDX, dan lini sel
Untuk mengkarakterisasi lanskap genom UPS dan menilai relevansi model laboratorium untuk pengujian in vitro , kami melakukan whole exome sequencing (WES) pada pasangan jaringan tumor-normal dari 20 pasien, empat lini sel mapan (SHEF UPS01, SHEF UPS02, SHEF UPS03 dan SHEF UPS04 [ [ 21 , 22 ] ]), dan tiga model PDX baru (IEC-16, IEC-56 dan SARC-395). WES mengidentifikasi median 175 total mutasi per sampel (SNV dan INDEL) di seluruh kohort (kisaran: 125–9037) (Gbr. S2A ). Model PDX menunjukkan mutasi total yang signifikan lebih banyak (median: 4464, 2,0% HCO) daripada lini sel (median: 218,5, 7,3% HCO) atau tumor pasien (median: 159,5, 8,5% HCO), kemungkinan besar karena tantangan yang terlibat dalam disambiguasi antara pembacaan manusia dan murine dalam model PDX sebagaimana tercermin dari persentase pembacaan yang lebih rendah yang didefinisikan sebagai HCO (Gbr. S2A,B ). Sebagai perbandingan, sampel tumor UPS dari TCGA Sarcoma Project ( n = 44) memiliki median 187,5 mutasi (8,1% HCO) (Gbr. S2 ).
Dengan berfokus pada peristiwa HCO, peristiwa mutasi serupa terlihat di seluruh sampel tumor yang berasal dari pasien dan model sel dan PDX, dengan PCA tidak mengungkapkan pengelompokan tumor yang independen berdasarkan sumber sampel (Gbr. S3 ). Meskipun gen yang sering bermutasi di seluruh kelompok itu tidak umum, hal ini terlihat pada tumor pasien dan model sel termasuk yang ada di TP53 (40% tumor pasien, 75% lini sel, 67% model PDX), ATRX (35% tumor pasien, 35% lini sel, 67% model PDX) dan RB1 (10% tumor pasien, 25% lini sel, 0% model PDX) (Gbr. 1A dan Gbr . S3 dan S4 ). Mutasi lain yang perlu diperhatikan termasuk JAK3 (10% tumor pasien, 25% lini sel, 33% model PDX) dan NF1 (10% tumor pasien, 0% lini sel, 25% model PDX) (Gbr. 1A ). Perbandingan mutasi onkogenik dengan mutasi dalam data TCGA yang diproses melalui jalur analisis kami menunjukkan frekuensi mutasi yang serupa dengan mutasi yang terdeteksi dalam sistem tumor padat dan model kami (Gbr. S4 ).

Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Gabungan bentang genomik tumor UPS, lini sel, dan model PDX. (A) Analisis genomik eksom utuh sampel UPS dari tumor padat (biru kehijauan), lini sel (ungu), dan model tikus PDX (emas; batang atas). SNV/INDEL: Semua mutasi yang terdeteksi diplot di bagian atas, dibagi menurut klasifikasi mutasi. Mutasi patogenik dan yang mungkin terdeteksi pada lebih dari satu sampel tumor dan sedikitnya satu sampel model ditunjukkan pada oncoplot dengan persentase kejadian tumor diplot di sebelah kanan. Plot batang jumlah sampel yang diubah ditunjukkan di sebelah kanan. Varian nomor salinan: plot jumlah total CN pada gen kanker diplot di atas. Kejadian nomor salinan yang sering diplot di bawah (biru = perolehan CN, merah = kehilangan CN) dengan plot batang persentase kejadian CN pada sampel tumor ditunjukkan di sebelah kanan. Gen yang diinginkan ( n = 3) tertentu juga diplot untuk perolehan dan kehilangan CN. Kode warna untuk kelas mutasi, jenis mutasi, dan jenis CN ditunjukkan di bawah. CN, nomor salinan; SNV, Varian nukleotida tunggal; TMB, Beban mutasi tumor. (B) Alur kerja skematis untuk interogasi data genom yang menghasilkan identifikasi agen terapeutik untuk pengujian in vitro .
Konsisten dengan penelitian sebelumnya [ [ 10 , 12 ] ], perubahan CN lebih prevalen daripada mutasi pada UPS, yang memengaruhi median 153 gen kanker yang terdefinisi dengan baik pada tumor pasien dan median 192 gen pada lini sel dan model PDX. Seperti yang diamati dengan data mutasi, PCA dan pengelompokan hierarkis gen kanker yang diubah CN tidak mengungkapkan pengelompokan spesifik sampel yang berbeda. Sebaliknya, pola CN menunjukkan beberapa kesamaan antara tumor padat dan sistem model (Gbr. S3B dan S5 ).
Di seluruh kelompok, kami mencatat gangguan gen yang sering terkait dengan beberapa jalur termasuk regulasi siklus sel, reseptor tirosin kinase (RTK)-RAS, NOTCH, dan pensinyalan WNT. Peningkatan CN yang sering diamati pada JUN (70% tumor pasien, 50% lini sel, 66% model PDX), EGFR (55% tumor pasien, 25% lini sel, 33% model PDX) dan CDK6 (45% tumor pasien, 75% lini sel, 66% model PDX) dengan peningkatan penting juga terlihat pada MET (40% tumor pasien, 50% lini sel, 66% model PDX; Gambar 1A ). Kehilangan CN umumnya terdeteksi pada WNT8B (60% tumor pasien, 50% lini sel, 66% model PDX), RB1 (60% tumor pasien, 50% lini sel, 66% model PDX) dan PTEN (60% tumor pasien, 0% lini sel, 100% model PDX) dengan kehilangan penting juga terlihat pada CDKN2A (25% tumor pasien, 75% lini sel, 66% model PDX; Gambar 1A ).
3.2 Identifikasi perubahan yang dapat ditindaklanjuti
Berdasarkan perubahan genomik umum yang ada dalam sampel pasien, model PDX dan lini sel, kami menggunakan basis data Interaksi Obat-Gen ( www.dgidb.org ) untuk mengidentifikasi target obat yang berpotensi dapat ditindaklanjuti yang dibawa ke pengujian (Gbr. 1B dan Tabel 1 ). Karena frekuensi kejadian SNV yang rendah, senyawa dipilih untuk menargetkan terutama perubahan CN, termasuk perolehan CDK6 , MET , KIT , PIK3R1/3, KMT2A , NOTCH1/3 dan FGFR1/3 , dan kerugian pada TP53 dan PTEN serta satu SNV ( JAK3 ). Menariknya, beberapa obat yang menargetkan perubahan di atas sebelumnya telah dipelajari dalam STS. Ini termasuk: inhibitor cyclin-dependent kinase (CDK)4/6 abemaciclib [ [ 35 ] ] dan palbociclib [ [ 36 ] ], inhibitor vascular endothelial growth factor receptor (VEGFR) dan KIT anlotinib [ [ 37 , 38 ] ], inhibitor γ-secretase nirogacestat [ [ 39 ] ], inhibitor poly (ADP-ribose) polymerase (PARP) olaparib [ [ 40 ] ] dan inhibitor MEK trametinib [ [ 41 ] ]. Obat-obatan berikut yang telah menunjukkan hasil yang menjanjikan dalam model STS praklinis juga dipilih: inhibitor FGFR erdafitinib dan infigratinib, inhibitor PARP niraparib dan inhibitor pan-phosphatidylinositol 3-kinase (PI3K) ZSTK474 [ [ 42 – 44 ] ]. Ini dilengkapi dengan obat-obatan yang sebelumnya tidak dipelajari dalam STS: inhibitor spesifik (JAK)3 FM-381 dan inhibitor JAK spektrum luas tofacitinib, yang terakhir telah disetujui untuk pengobatan artritis reumatoid [ [ 45 ] ]. Amplifikasi KMT2A dapat ditargetkan melalui penghambatan komponen kompleks COMPASS yang diperlukan untuk fungsi metiltransferase KMT2A, yaitu menin [ [ 46 ] ] dengan revumenib dan WDR5 [ [ 47 ] ] dengan OICR-9429. Secara keseluruhan, panel yang terdiri dari 14 senyawa dipilih untuk penyaringan primer dalam lini sel UPS.
Tabel 1. Obat-obatan yang dipilih untuk penyaringan berdasarkan analisis pengurutan eksom keseluruhan dari biopsi pasien UPS, lini sel, dan model PDX.

3.3 Pembuatan lini sel UPS IEC-56 turunan PDX yang baru
Terdapat sejumlah terbatas lini sel UPS yang diberi anotasi dengan baik yang tersedia untuk skrining obat [ [ 48 – 51 ] ] dan karena tumor UPS dicirikan oleh perubahan genomik yang kompleks dan bervariasi, hal ini menyoroti perlunya menggunakan berbagai lini sel dengan latar belakang genomik yang beragam untuk pengujian obat. Kami dapat memperoleh lini sel UPS baru dari model IEC-56 PDX untuk melengkapi empat lini sel UPS (SHEF UPS01-UPS04) dalam percobaan skrining obat.
Populasi sel manusia diperoleh dengan menipiskan sel tikus yang baru saja terdisosiasi dengan penyortiran sel yang diaktifkan secara magnetik (Gbr. 2A,B ). Lini sel IEC-56 diprofilkan STR (Gbr. 2C ), dan tidak adanya sel tikus dalam populasi lini sel dikonfirmasi oleh imunofluoresensi (Gbr. 2D ). Kemurnian lini sel IEC-56 selanjutnya divalidasi oleh RT-PCR menggunakan primer gen referensi khusus manusia dan tikus (Gbr. 2E ). Sel-sel IEC-56 bersifat tumourigenik ketika disuntikkan ke tikus yang mengalami gangguan kekebalan (Gbr. 2F ) dan pewarnaan H&E representatif dari tumor yang dihasilkan ditunjukkan pada Gbr. 2G . Tumor tersebut positif vimentin (Gbr. 2H ) dan negatif untuk sitokeratin (Gbr. 2I ) dan aktin otot polos (Gbr. 2J ). Tumor menunjukkan tanda-tanda berkembangnya pembuluh darah (Gbr. 2K ) dan mengandung proporsi sel yang berproliferasi tinggi seperti yang ditunjukkan oleh pewarnaan Ki67 positif (Gbr. 2L ).
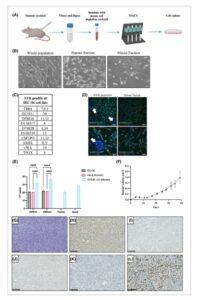
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Karakterisasi lini sel IEC-56 turunan PDX yang baru. (A) Diagram skema proses derivasi lini sel IEC-56. (B) Gambar brightfield representatif sel dari keseluruhan populasi (kiri), fraksi manusia (tengah) dan fraksi tikus (kanan) yang diperoleh dari tumor IEC-56 yang terdisosiasi dan terdeplesi tikus ( n = 1). Skala batang = 100 μ m . (C) Profil STR dari lini sel UPS IEC-56. (D) Gambar representatif pewarnaan imunofluoresensi sel dari keseluruhan populasi (kiri) dan fraksi manusia (kanan) yang diperoleh dari tumor IEC-56 yang terdisosiasi dan terdeplesi tikus untuk mitokondria manusia, vimentin dan aktin (phalloidin) manusia dan tikus ( n = 3). Gambar diambil dengan perbesaran 10x (baris atas) dan 40x (baris bawah). Panah putih menunjuk ke gugus sel tikus yang ditandai dengan tidak adanya pewarnaan vimentin dan mitokondria manusia. Batang skala = 200 μ m (baris atas) dan 50 μ m (baris bawah). (E) Validasi qRT-PCR dari kemurnian lini sel IEC-56 manusia. Primer yang menargetkan dua gen referensi manusia ( RPS13 dan YWHAZ ) dan tikus ( Polr2a dan Gusb ) yang banyak digunakan digunakan. Batang kesalahan menunjukkan deviasi standar dari mean ( n = 3). Hasilnya dianalisis menggunakan ANOVA dua arah dengan uji perbandingan berganda Tukey (**** P < 0,0001). (F) Pertumbuhan lini sel IEC-56 pada tikus setelah injeksi subkutan. Batang kesalahan menunjukkan deviasi standar dari volume tumor mean pada setiap titik waktu ( n = 10 dari lima tikus). (G–M) Pewarnaan H&E (G) dan imunohistokimia representatif dari tumor yang dibentuk oleh suntikan subkutan sel IEC-56 untuk vimentin (H), sitokeratin (I), aktin otot polos (J), CD31 (K) dan Ki67 (L) (semua n = 3). Skala batang = 100 μ m .
3.4 Inhibitor CDK4/6, FGFR, MEK dan PI3K menunjukkan kemanjuran tertinggi pada lini sel UPS
Hasil lengkap dari penyaringan primer yang dilakukan pada lima lini sel UPS dirangkum dalam Tabel S5 dan S6. Inhibitor CDK4/6 abemaciclib adalah obat paling berkhasiat yang diuji dalam 2D sebagaimana diukur dengan jumlah nuklei dengan IC 50 rata-rata 0,335 μM (rentang: 0,088–0,670 μM ) (Gbr. 3A dan Tabel S5 ). Palbociclib, inhibitor CDK4/6 lainnya, memiliki kinerja yang mirip dengan abemaciclib dalam lini sel SHEF UPS02, SHEF UPS04 dan IEC-56, tetapi memiliki nilai IC 50 yang jauh lebih tinggi dalam SHEF UPS01 (5,161 μM ) dan SHEF UPS03 (6,263 μM). Trametinib memiliki nilai IC 50 rata-rata terendah kedua dalam skrining (0,568 μ M ; kisaran: 0,107–1,751 μ M ) meskipun lini sel SHEF UPS03 resisten terhadap trametinib ( nilai IC 50 di atas 10 μ M ) (Gbr. 3A dan Tabel S5 ). Sensitivitas, didefinisikan sebagai nilai IC 50 di bawah 1 μ M , terhadap ZSTK474, infigratinib, dan erdafitinib terlihat pada setidaknya satu lini (Gbr. 3A dan Tabel S5 ).

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Inhibitor CDK4/6, FGFR, MEK, dan PI3K menunjukkan efikasi tertinggi pada lini sel UPS. (A) Kurva respons dosis-log senyawa dari skrining primer yang sedikitnya satu lini sel UPS sensitif pada 2D (dua baris teratas; batang galat menunjukkan deviasi standar dari rata-rata n = 3 replikasi biologis). Tabel di bawah merangkum nilai IC50 rata-rata lini sel yang nilai IC50-nya dapat ditentukan secara tepat dan nilai IC50 individual untuk setiap lini sel dalam kultur 2D dan 3D. (B) Kurva respons dosis-log senyawa berkhasiat yang diidentifikasi dalam skrining sekunder yang diuji pada lini sel UPS yang tumbuh dalam kultur 2D (batang galat menunjukkan deviasi standar dari rata-rata n = 3 replikasi biologis). Tabel di bawah merangkum nilai IC50 rata-rata lini sel yang nilai IC50-nya dapat ditentukan secara tepat dan nilai IC50 individual untuk setiap lini sel. Buparlisib dan ribociclib tidak diuji dalam kultur 3D.
Dalam kultur sferoid 3D, infigratinib dan erdafitinib merupakan senyawa paling berkhasiat yang diuji sebagaimana diukur dengan reduksi reagen PrestoBlue, dengan nilai IC50 rata-rata masing-masing sebesar 0,632 dan 0,839 μ M ( rentang: masing-masing 0,022–1,490 μ M dan 0,020–2,457 μ M ) (Gbr. S6 dan Tabel S6 ). Pada sebagian besar lini sel UPS, kedua obat lebih poten dalam sferoid 3D dibandingkan dalam kultur 2D (Gbr. 3 dan Tabel S5 dan S6 ). Sejalan dengan hasil 2D, SHEF UPS03 resistan terhadap trametinib sementara SHEF UPS02, SHEF UPS04 dan IEC-56 memiliki nilai IC 50 3D yang lebih rendah (masing-masing 0,181, 0,009 dan 0,020 μ M ) dibandingkan dengan kultur 2D. Abemaciclib berkinerja buruk dalam skrining 3D dengan nilai IC 50 sedikit di bawah 10 μ M pada lini sel SHEF UPS02 dan SHEF UPS03 dengan lini sel lainnya memiliki nilai IC 50 > 10 μ M .
Berdasarkan hasil di atas, inhibitor CDK4/6, MEK dan PI3K tambahan dipilih untuk penilaian lebih lanjut dalam penyaringan sekunder dalam 2D (Tabel S7 ). Beberapa perubahan genomik dalam jalur PI3K/AKT diidentifikasi dalam sampel UPS (Gbr. 1 ) yang memberikan dasar pemikiran di balik pengujian inhibitor PI3K lebih lanjut meskipun ZSTK474 kurang berkhasiat pada sebagian besar lini sel (Tabel S5 dan S6 ). Selain itu, inhibitor yang spesifik terhadap satu atau lebih dari empat subunit PI3K disertakan untuk menilai apakah menargetkan subunit PI3K yang berbeda berkhasiat pada lini sel UPS. Inhibitor CDK nonspesifik alvocidib dan inhibitor pan-PI3K copanlisib adalah dua senyawa yang diidentifikasi dalam penyaringan sekunder yang sensitif terhadap lini sel UPS (Gbr. 3B ). Alvocidib memiliki nilai IC 50 rata-rata terendah dari semua obat yang diuji dalam 2D (0,208 μ M , kisaran: 0,144–0,327 μ M ) dan lebih berkhasiat daripada abemaciclib dalam kultur 3D. Demikian pula, copanlisib mengungguli inhibitor pan-PI3K ZSTK474 yang diuji dalam skrining primer baik dalam 2D maupun 3D, meskipun hanya SHEF UPS02 dan SHEF UPS03 yang memiliki nilai IC 50 di bawah 10 μ M dalam kultur spheroid. Inhibitor spesifik subunit PI3K berkinerja buruk dalam skrining sekunder dan tidak ada inhibitor MEK yang menunjukkan kemanjuran yang serupa dengan trametinib (Tabel S8 ). Tabel S9 menyediakan ringkasan profil sensitivitas setiap lini sel bersama dengan perubahan genomik terkait.
3.5 Kombinasi trametinib dan infigratinib bersifat sinergis pada sebagian besar lini sel UPS yang diuji
Abemaciclib, copanlisib, dan trametinib selanjutnya diuji dalam kombinasi satu sama lain untuk menilai apakah mereka akan menunjukkan efek aditif atau sinergis. Abemaciclib dipilih daripada alvocidib berdasarkan penggunaan sebelumnya dalam uji klinis STS. Trametinib juga dikombinasikan dengan infigratinib berdasarkan bukti terbaru tentang sinergi mereka dalam model kanker dengan penyebab primer yang tidak diketahui [ [ 52 ] ]. Dari kombinasi obat yang diuji, hanya infigratinib yang dipasangkan dengan trametinib dosis rendah (0,01 dan 0,03 μ M ) yang menunjukkan sinergi, didefinisikan sebagai skor sinergi di atas 10 [ [ 53 ] ], di sebagian besar lini sel UPS (Gbr. 4A ) dengan skor ZIP rata-rata tertinggi dan skor ZIP maksimum (ZIP maks ) terlihat untuk SHEF UPS02 (15,97; ZIP maks = 21,07) dan SHEF UPS04 (17,42; ZIP maks = 22,83). SHEF UPS03 memiliki skor rata-rata terendah dari lima lini sel UPS (3,84; ZIP maks = 5,59), yang menunjukkan bahwa infigratinib tidak mampu mengatasi resistensi SHEF UPS03 terhadap trametinib. Sinergi infigratinib dan trametinib pada dosis rendah trametinib yang diidentifikasi oleh model ZIP dalam lini sel SHEF UPS02, SHEF UPS04 dan IEC-56 konsisten di ketiga model sinergi lainnya (Gbr. 4A ). Model HSA juga menunjukkan sinergi (skor rata-rata 10,99) dalam lini sel SHEF UPS01; namun, hasil ini tidak didukung oleh ketiga model lainnya. Skor sinergi untuk seluruh matriks dosis kombinasi infigratinib dan trametinib ditunjukkan pada Tabel S10 .
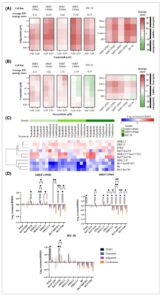
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Kombinasi trametinib dan infigratinib bersifat sinergis dalam lini sel UPS. (A) Peta panas yang merangkum skor sinergi ZIP (kiri) dan keempat skor sinergi (kanan) dari dosis infigratinib dan trametinib terpilih dalam lini sel UPS yang tumbuh dalam 2D ( n = 3 replikasi biologis). Skor sinergi ZIP rata-rata untuk matriks dosis terpilih ditunjukkan di atas setiap peta panas. (B) Peta panas yang merangkum skor sinergi ZIP (kiri) dan keempat skor sinergi (kanan) dari dosis doksorubisin dan trametinib terpilih dalam lini sel UPS yang tumbuh dalam 2D ( n = 3 replikasi biologis). Skor sinergi ZIP rata-rata untuk matriks dosis terpilih ditunjukkan di atas setiap peta panas. (C) Ringkasan perubahan kadar protein terpilih dari uji RPPA setelah periode pengobatan 24 jam ( n = 3 replikasi biologis). Perubahan kadar protein dikelompokkan secara hierarkis menggunakan jarak Euklides. (D) Representasi grafis dari hasil yang ditunjukkan pada (C). Batang kesalahan mewakili deviasi standar dari rata-rata ( n = 3 replikasi biologis). Hasilnya dianalisis menggunakan ANOVA dua arah dengan uji perbandingan ganda Dunnett (* P < 0,05; ** P < 0,01).
Kami kemudian mengamati kemungkinan sinergi antara trametinib dan doksorubisin standar perawatan UPS. Tidak ada sinergi yang diidentifikasi menggunakan model ZIP dengan hanya 3 μ M trametinib yang dikombinasikan dengan 0,03 μ M doksorubisin dalam lini sel SHEF UPS03 yang menunjukkan skor sinergi di atas 10 (Gbr. 4B ). Skor sinergi ZIP rata-rata untuk matriks dosis terpilih yang ditunjukkan dalam Gbr. 4B berkisar dari -4,37 (IEC-56) hingga 5,03 (SHEF UPS02). Model HSA dan Loewe menunjukkan bahwa doksorubisin dan trametinib bersifat sinergis dalam SHEF UPS02 (skor rata-rata 16,75 dan 12,4, masing-masing) dengan model terakhir juga menunjukkan sinergi dalam SHEF UPS01 (12,49) dan SHEF UPS03 (10,1). Karena kurangnya konsistensi di seluruh model dan skor sinergi yang rendah, kami memutuskan untuk melihat lebih jauh pada sinergi yang diamati antara trametinib dan infigratinib daripada kombinasi dengan doksorubisin.
Untuk mengidentifikasi efek trametinib dan infigratinib pada jalur pensinyalan yang berbeda di lini sel, kami melakukan eksperimen RPPA (Gbr. 4C dan hasil lengkap pada Gbr. S7 ). Lini sel SHEF UPS03, SHEF UPS04 dan IEC-56 diobati dengan trametinib 10 nM dan infigratinib 100 nM, baik sebagai monoterapi atau dalam kombinasi. Dosis-dosis ini dipilih karena kombinasinya memberikan skor sinergi ZIP tertinggi di antara kelima lini sel UPS (Gbr. 4A ). Pengobatan trametinib menyebabkan penurunan regulasi pERK di ketiga lini sel, meskipun itu hanya signifikan pada lini sel SHEF UPS04. Pengobatan gabungan dengan infigratinib tidak menghasilkan penurunan lebih lanjut pada pERK. Penurunan pERK disertai dengan peningkatan regulasi pMEK seperti yang telah dijelaskan sebelumnya setelah pengobatan trametinib [ [ 54 , 55 ] ]. Namun, peningkatan ini tidak terlalu mencolok ketika trametinib dikombinasikan dengan infigratinib. Selain itu, peningkatan fosforilasi Raf (S338) terlihat pada sel yang diobati dengan trametinib yang berkurang pada sel yang diobati dengan kombinasi. Seperti yang diharapkan, kadar MEK tidak berubah pada semua lini sel setelah pengobatan dan ERK sedikit meningkat oleh pengobatan kombinasi pada SHEF UPS03 dan oleh pengobatan trametinib dan kombinasi pada SHEF UPS04.
Ketiga perawatan tersebut menghasilkan kadar RB yang lebih rendah pada lini sel SHEF UPS04 dengan trametinib dan perawatan kombinasi juga menyebabkan penurunan kadar pRB (Gbr. 4D ). Perawatan kombinasi menghasilkan kadar RB dan pRB (S780) yang secara signifikan lebih rendah dibandingkan dengan trametinib ( masing-masing P = 0,0002 dan P = 0,03) dan infigratinib ( masing-masing P = 0,03 dan P = 0,01), yang menunjukkan bahwa beberapa sinergi yang terlihat dengan perawatan kombinasi dapat disebabkan oleh peningkatan penangkapan siklus sel. Ini juga diamati pada lini sel SHEF UPS03 dengan perawatan kombinasi yang mengurangi kadar RB dan pRB (S807, S811) secara signifikan lebih banyak daripada trametinib ( masing-masing P = 0,006 dan P = 0,04) dan infigratinib ( masing-masing P = 0,01 dan P = 0,02). Trametinib dan pengobatan kombinasi menurunkan kadar pRB di semua lokasi dalam sel SHEF UPS03 dengan kombinasi tersebut juga menurunkan kadar RB. Hal ini menunjukkan bahwa resistensi bawaan terhadap trametinib pada sel SHEF UPS03 meniadakan efek pengobatan pada RB dan fosforilasinya. Pada lini sel IEC-56, perubahan kadar RB dan pRB mengikuti pola yang sama dengan dua lini sel lainnya tetapi ini ditemukan tidak signifikan, kemungkinan didorong oleh variabilitas yang lebih tinggi dalam respons terhadap pengobatan yang terlihat pada lini sel ini (Gbr. 4D ). Analisis perubahan kadar protein lain dalam uji RPPA tidak mengungkapkan perubahan yang konsisten setelah pengobatan agen tunggal atau kombinasi (Gbr. S7 ).
3.6 Irisan tumor UPS sebagai model yang layak untuk validasi kemanjuran obat
Bahasa Indonesia: Untuk menjembatani kesenjangan antara pengujian obat in vitro dan in vivo dalam UPS, protokol untuk kultur irisan tumor ex vivo yang berasal dari model IEC-56 PDX telah ditetapkan (Gbr. 5A ). Selama periode kultur tujuh hari, irisan mempertahankan morfologinya (Gbr. 5B ) meskipun menjadi kurang padat sebagaimana dibuktikan oleh ruang antar sel yang lebih besar. Irisan tidak menunjukkan peningkatan apoptosis (Gbr. 5C ) dan tetap proliferatif (Gbr. 5D ), meskipun proporsi sel yang berproliferasi berkurang pada hari ke-7 dibandingkan dengan tumor yang baru diiris. Viabilitas irisan tidak berubah secara signifikan selama 1 minggu kultur (Gbr. 5E ). Untuk menguji apakah sinergi antara trametinib dan infigratinib dipertahankan dalam sistem kultur ex vivo yang lebih kompleks, irisan tersebut diobati dengan dua dosis trametinib, infigratinib, dan kombinasinya (Gbr. 5F ). Pengobatan dengan staurosporin 10 μ M digunakan sebagai kontrol positif dan menunjukkan bahwa kehilangan viabilitas hampir lengkap hingga 3,2% relatif terhadap kontrol DMSO (kisaran: 0,0–9,8%). Kombinasi trametinib 100 nM dan infigratinib 1 μ adalah satu-satunya pengobatan yang secara signifikan mengurangi viabilitas irisan (viabilitas rata-rata 66,2%) relatif terhadap kontrol DMSO. Setelah pengobatan dengan kombinasi ini, viabilitas irisan juga secara signifikan lebih rendah dibandingkan dengan kedua pengobatan senyawa tunggal. Dosis yang lebih tinggi dari kedua obat yang diperlukan untuk mengamati kemanjuran dalam irisan dibandingkan dengan kultur 2D kemungkinan mencerminkan arsitektur jaringan yang lebih kompleks dari model irisan tumor dan gradien konsentrasi obat di seluruh bagian jaringan. Hasil ini selanjutnya menunjukkan peningkatan kemanjuran trametinib ketika dikombinasikan dengan infigratinib dalam model UPS praklinis.
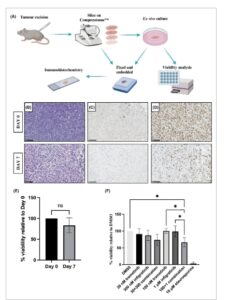
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Penggunaan kultur irisan tumor UPS PDX ex vivo untuk validasi efikasi obat. (A) Garis besar proses irisan tumor dan analisis hilir. (B–D) Pewarnaan H&E (B) dan imunohistokimia representatif dari irisan tumor IEC-56 PDX untuk caspase-3 yang terbelah (C) dan Ki67 (D) pada dua titik waktu pasca-irisan. Batang skala = 100 μ m . (E) Viabilitas irisan tumor IEC-56 PDX relatif terhadap awal kultur. Hasilnya dianalisis menggunakan uji- t dua sisi (ns = tidak signifikan). Batang galat menunjukkan deviasi standar dari mean ( n = 4 replikasi biologis dari 4 tumor berbeda). (F) Efek pengobatan dengan trametinib, infigratinib, dan kombinasinya pada viabilitas irisan jaringan. Pengobatan staurosporin (10 μ M ) digunakan sebagai kontrol positif. Batang kesalahan menunjukkan deviasi standar dari rata-rata ( n = 4 replikasi biologis). Hasilnya dianalisis menggunakan ANOVA satu arah dengan uji perbandingan berganda Tukey (* P < 0,05).
4 Diskusi
Dalam studi ini, kami berupaya mendorong pemilihan dan pengujian senyawa obat yang rasional baik dalam model turunan sel maupun PDX, berdasarkan analisis genomik dari kelompok tumor pasien UPS lokal. Untuk melakukannya, kami menggunakan analisis komprehensif lanskap genomik dalam 4 lini sel dan 3 model PDX dan mengaitkannya dengan temuan analisis 20 pasien UPS dengan metode penyaringan onkogenik terapan untuk menilai kejadian SNV dan CN yang berpotensi dapat ditargetkan secara terapeutik.
Seperti pada penelitian sebelumnya, sampel tumor UPS, lini sel dan model PDX kami didominasi oleh gangguan genomik kompleks seperti perubahan CN, bukan kejadian SNV [ [ 10 , 14 ] ]. Meskipun demikian, sejumlah kecil gen menunjukkan kejadian SNV yang sering. Yang paling umum adalah gen penekan tumor TP53 dan ATRX . TP53 telah banyak dilaporkan sebagai perubahan genomik yang paling umum pada UPS [ [ 10 , 12 – 16 ] ]. TP53 juga sering diubah melalui kejadian kehilangan CN pada sampel tumor, biasanya pada tumor tanpa SNV TP53 . Mutasi dan kejadian CN yang serupa juga terlihat di seluruh lini sel dan model PDX. Kelompok pasien kami juga memiliki prevalensi mutasi ATRX yang serupa dengan sejumlah studi UPS sebelumnya termasuk yang dilaporkan oleh Zheng dan rekannya ( n = 16, 31% kasus) [ [ 16 ] ] serta yang diamati dalam sampel UPS dalam studi besar seperti analisis data MSK-IMPACT ( n = 145, 21% kasus [ [ 14 ] ]) dan studi TCGA Adult Soft Tissue Sarcoma ( n = 44, 29,5% kasus [ [ 10 ] ]).
Penelitian sebelumnya juga telah melaporkan perubahan genomik pada RB1 di UPS [ [ 10 , 14 ] ]. Pada tumor pasien kami, kami mencatat bahwa 10% kasus memiliki mutasi dan 60% memiliki perubahan CN, dengan kejadian serupa juga terlihat pada lini sel dan model PDX. Kami juga melaporkan frekuensi hilangnya gen CDKN2A yang sebanding (25% pada kelompok tumor kami) dengan yang dijelaskan oleh Bui dan rekan-rekannya dengan menganalisis basis data Foundation One Medicine ( n = 372, 21% kasus) [ [ 15 ] ] dan yang dilaporkan dalam studi TCGA Adult Soft Tissue Sarcoma ( n = 44, 20,5% kasus) [ [ 10 ] ]. Gen bermutasi lain yang dilaporkan sebelumnya dalam UPS seperti NF1 , PTEN dan KMT2C [ [ 14 , 16 ] ] juga ditemukan bermutasi dalam sampel kami.
Perubahan CN yang sering ditemukan pada gen yang terkait dengan beberapa jalur termasuk siklus sel, RTK-RAS, NOTCH dan pensinyalan WNT. Kami mengamati peningkatan jumlah salinan yang sering terjadi pada JUN , EGFR dan CDK6 . Sebaliknya, kehilangan CN umumnya terdeteksi pada WNT8B , RB1 dan PTEN . Perubahan ini selaras dengan temuan dari TCGA. Secara kolektif, temuan ini memperkuat gagasan bahwa UPS menunjukkan ketidakstabilan genomik yang kompleks dan tersebar luas, dengan perubahan pada jalur onkogenik dan penekan tumor utama. Khususnya, sistem model kami tampaknya merangkum kompleksitas genomik ini, menjadikannya alat yang berharga untuk penelitian lebih lanjut dan pengembangan terapi.
Inhibitor CDK4/6 secara rutin digunakan dan ditoleransi dengan baik pada kanker payudara lanjut yang positif terhadap reseptor hormon dan negatif HER2 [ [ 56 ] ] dan telah dievaluasi dalam sejumlah uji klinis yang merekrut pasien dengan STS. Studi klinis ini terutama difokuskan pada pasien liposarkoma karena amplifikasi CDK4 yang ditemukan pada hampir semua kasus [ [ 57 , 58 ] ]. Namun, baru-baru ini Martin-Broto et al melaporkan aktivitas pada subtipe STS lainnya dan mengamati kelangsungan hidup bebas perkembangan (PFS) di atas median dalam satu kasus UPS yang diobati dengan palbociclib sebagai bagian dari uji coba fase II yang merekrut pasien yang mengekspresikan CDK4 secara berlebihan dan tanpa mengekspresikan CDKN2A secara berlebihan [ [ 36 ] ]. Di sini, kami melihat aktivitas dengan sejumlah penghambat CDK4/6 di seluruh lini sel dengan abemaciclib menunjukkan aktivitas yang lebih unggul daripada palbociclib dan ribociclib, konsisten dengan potensi abemaciclib yang lebih besar [ [ 59 ] ]. Sensitivitas terhadap abemaciclib di seluruh lini sel dikaitkan dengan perubahan genom yang berbeda termasuk amplifikasi CDK4 dan RB1 dan hilangnya CDKN2A (Tabel S9 ). Sebuah studi terhadap 560 lini sel kanker menunjukkan bahwa secara keseluruhan, mutasi TP53 dikaitkan dengan ketidakpekaan relatif terhadap abemaciclib tetapi beberapa lini sel yang sangat sensitif memang memiliki mutasi TP53 [ [ 60 ] ]. Menariknya, mutasi TP53 tidak memberikan resistensi pada lini sel SHEF UPS03 dan IEC-56 dan menyoroti perlunya mempertimbangkan beberapa perubahan genom karena lini ini memiliki perubahan pada gen terkait lainnya termasuk hilangnya CDKN2A dan mutasi patogenik pada RB1 .
Skrining sekunder mengidentifikasi alvocidib, inhibitor CDK nonspesifik, sebagai obat yang paling mujarab di seluruh lini sel UPS yang diuji. Menariknya, sebuah studi baru-baru ini oleh Mendiola dan rekan-rekannya mengidentifikasi alvocidib sebagai salah satu senyawa yang paling mujarab dalam skrining obat yang dilakukan pada dua lini sel angiosarkoma [ [ 61 ] ]. Alvocidib juga telah terbukti mengurangi proliferasi dan potensi metastasis sel osteosarkoma [ [ 62 ] ]. Kami menemukan alvocidib berkhasiat dalam kultur 3D lini sel SHEF UPS02, SHEF UPS04 dan IEC-56, sangat kontras dengan abemaciclib dan palbociclib yang tidak menunjukkan aktivitas dalam spheroid 3D. Hal ini bisa jadi disebabkan oleh penghambatan tambahan CDK2 oleh alvocidib, karena aktivasi jalur CDK2-siklin E telah diusulkan sebagai salah satu mekanisme resistensi terhadap penghambatan CDK4/6 [ [ 63 ] ] dan penargetan CDK2 selain CDK4/6 mengatasi resistensi terhadap penghambat CDK4/6 pada kanker payudara [ [ 64 , 65 ] ].
Sementara inhibitor PI3K ZSTK474 hanya berkhasiat pada lini sel IEC-56, kelima kultur 2D lini sel UPS sensitif terhadap inhibitor PI3K copanlisib yang disertakan dalam skrining sekunder. Sejauh pengetahuan kami, copanlisib belum pernah dipelajari sebelumnya dalam UPS sementara dalam konteks sarkoma yang lebih luas, copanlisib menunjukkan kurangnya aktivitas in vivo dalam model osteosarkoma [ [ 66 ] ] dan kemanjuran pada sel sarkoma sinovial yang berasal dari pasien in vitro [ [ 67 ] ] dan model tumor stroma gastrointestinal in vivo [ [ 68 ] ]. Oleh karena itu, hal ini merupakan kandidat potensial yang menarik untuk studi lebih lanjut dalam UPS, baik sebagai monoterapi atau dalam kombinasi dengan agen lain.
Inhibitor MEK sekarang banyak digunakan dalam kombinasi dengan inhibitor RAF untuk pasien dengan mutasi RAS atau RAF terutama pada melanoma dan kanker paru nonsel kecil [ [ 69 ] ]. Di sini kami menemukan 3/5 lini sel UPS sensitif terhadap trametinib tanpa adanya mutasi pengaktifan pada jalur RAS/RAF/MEK. Meskipun amplifikasi dan delesi RAF1 terdeteksi pada lini sel, hal ini tidak berkorelasi dengan sensitivitas lintas lini. Trametinib ditemukan berkhasiat hanya pada sebagian kecil lini sel sarkoma yang diuji oleh Teicher et al . beberapa di antaranya memiliki mutasi pengaktifan RAS [ [ 70 ] ]. Hasil serupa juga diperoleh dalam skrining dengan panel luas organoid sarkoma yang berasal dari pasien [ [ 71 ] ] yang menunjukkan bahwa sensitivitas terhadap trametinib jarang terjadi pada sarkoma. Hal ini didukung oleh uji coba Fase II selumetinib pada pasien STS yang tidak menunjukkan perbedaan dalam kelangsungan hidup bebas perkembangan—meskipun status mutasi RAS dan RAF tidak ditentukan [ [ 72 ] ].
Resistensi terhadap inhibitor MEK merupakan tantangan klinis utama dan dapat berkembang karena umpan balik aktivasi jalur pensinyalan tambahan yang mengakibatkan reaktivasi aktivitas ERK [ [ 69 ] ]. Karena alasan ini, uji klinis telah menyelidiki kombinasi inhibitor MEK dengan agen lain dalam berbagai jenis tumor termasuk satu studi di STS di mana trametinib dikombinasikan dengan inhibitor multi-kinase pazopanib yang menargetkan VEGFR. Kombinasi tersebut tidak meningkatkan PFS meskipun penulis menyarankan bahwa trametinib harus diselidiki lebih lanjut pada pasien STS dengan jalur MAPK yang terlalu aktif [ [ 41 ] ]. Meskipun mutasi aktivasi dalam jalur di UPS sangat jarang, satu studi telah mengidentifikasi ekspresi tinggi pERK di sekitar 30% sampel UPS dengan ekspresi menjadi prediktor independen kelangsungan hidup [ [ 73 ] ]. Memahami jalur yang mengarah pada aktivasi jalur MAPK di UPS akan menjadi penting untuk menentukan terapi kombinasi baru dan di sini kami telah menunjukkan bahwa menggabungkan trametinib dengan inhibitor FGFR infigratinib bersifat sinergis. Analisis genomik kami menunjukkan gangguan jumlah salinan FGFR1/2 di seluruh lini sel; sebuah hasil tercermin dalam kumpulan data tumor UPS manusia kami di mana FGFR1 diubah CN dalam 60% kasus dan FGFR2 dalam 50%. Memang, baik infigratinib dan erdafitinib terbukti berkhasiat dalam lini sel UPS yang berasal dari subkelompok pasien yang membawa amplifikasi FGFR2 , sementara erdafitinib juga mengurangi pertumbuhan tumor in vivo yang dibentuk oleh salah satu lini sel yang diperkuat FGFR2 [ [ 42 ] ]. Cavazzoni dan rekan-rekannya juga melaporkan dalam kanker primer yang tidak diketahui dengan amplifikasi FGFR2 bahwa kombinasi infigratinib dan trametinib bersifat sinergis dan mengurangi aktivitas jalur AKT/mTOR/p70S6K dan MAPK di luar efek monoterapi [ [ 52 ] ]. Hasil kami menunjukkan bahwa pada UPS sebagian efek sinergis kombinasi tersebut dapat disebabkan oleh kemampuan infigratinib untuk mencegah umpan balik aktivasi RAF/MEK setelah pengobatan dengan trametinib yang mengakibatkan terhentinya perkembangan siklus sel.
Kami juga menunjukkan kelayakan penggunaan irisan tumor ex vivo untuk memvalidasi hasil skrining obat in vitro . Sementara irisan tumor telah berhasil digunakan untuk studi obat sebelumnya [ [ 74 ] ], ini adalah penggunaan irisan tumor UPS yang pertama kali dilaporkan untuk tujuan skrining obat. Irisan tumor menjembatani kesenjangan antara eksperimen in vivo yang lebih mahal, berthroughput rendah, dan memakan waktu dengan model in vitro yang tidak merangkum arsitektur jaringan dan kompleksitas terkait tumor. Kami menunjukkan bahwa irisan tumor UPS dapat disimpan dalam kultur selama 7 hari tanpa kehilangan viabilitas, sejalan dengan temuan sebelumnya [ [ 75 ] ]. Kelemahan potensial dari irisan tumor UPS adalah penurunan laju proliferasi sel dalam jaringan dari waktu ke waktu, yang dapat meremehkan kemanjuran senyawa yang menargetkan siklus sel, seperti penghambat CDK4/6. Namun demikian, hasil kami menunjukkan bahwa trametinib dan infigratinib dalam kombinasi harus diselidiki lebih lanjut dalam UPS dan irisan tumor dapat menjadi model yang berharga untuk validasi senyawa dalam UPS sebelum eksperimen in vivo .
5 Kesimpulan
Sebagai kesimpulan, kami menunjukkan bahwa model in vitro kami merangkum perubahan genomik yang terlihat pada pasien UPS. Empat dari 10 kelas obat yang disertakan dalam penyaringan primer yang diinformasikan oleh data genomik mengandung senyawa dengan khasiat pada beberapa lini sel UPS yang diuji termasuk penghambat CDK dan penghambat PI3K copanlisib. Kami mengidentifikasi kombinasi sinergis yang menjanjikan dari penghambat MEK trametinib dan penghambat FGFR infigratinib yang memerlukan pengujian lebih lanjut. Hasil di atas menyoroti kegunaan pendekatan yang dipimpin genomik kami untuk mengidentifikasi obat yang manjur pada jenis tumor yang langka dan kurang dipelajari tanpa penggerak genetik yang jelas.
