Abstrak
Sel merasakan isyarat fisik dari lingkungannya dan mengubahnya menjadi respons biokimia melalui mekanotransduksi. Tidak seperti tumor padat, peran gaya tersebut dalam kanker hematologi belum banyak dieksplorasi. Dalam konteks ini, sel imun mengalami rangsangan mekanis dinamis saat bermigrasi, keluar dari pembuluh darah, dan menuju jaringan tertentu. Memahami bagaimana gaya ini membentuk fungsi dan keganasan sel B merupakan bidang penelitian yang inovatif. Tinjauan ini meneliti jalur dan molekul mekanosensori utama yang terlibat dalam mekanotransduksi limfosit, dimulai dengan protein mekanosensori di membran plasma, diikuti oleh propagasi sinyal intraseluler melalui sitoskeleton, yang akhirnya menyoroti nukleus sebagai ‘aktuator sinyal’. Selanjutnya, kami membahas beberapa pendekatan pengukuran dan sistem canggih untuk menyelidiki biomekanik tumor, yang menyoroti penerapannya dalam konteks sel B. Terakhir, kami fokus pada implikasi mekanobiologi dalam leukemia, mengidentifikasi molekul yang terlibat dalam keganasan sel B yang dapat berfungsi sebagai ‘mekano-target’ potensial untuk terapi yang dipersonalisasi. Tinjauan ini menekankan perlunya memahami bagaimana limfosit menghasilkan, merasakan, dan merespons rangsangan mekanis, yang dapat membuka jalan bagi inovasi biomedis di masa depan.
Pernyataan dampak
Tinjauan kami sangat berharga dalam menyoroti peran mekanobiologi yang belum banyak dieksplorasi dalam fungsi sel B dan keganasan, sekaligus membahas teknik-teknik baru yang dapat memajukan bidang penelitian ini. Tinjauan ini menjembatani mekanotransduksi, imunologi, dan biologi kanker dengan cara yang akan menarik bagi para peneliti di ketiga bidang utama ini.
Singkatan
2D , dua dimensi
3D , tiga dimensi
AFM , mikroskopi gaya atom
AKT , protein kinase B
ALL , leukemia limfoblastik akut
AML , leukemia myeloid akut
APC , sel penyaji antigen
ARP 2/3 , kompleks protein terkait aktin 2/3
BCR , Reseptor sel B
BCR-ABL1 , wilayah klaster titik henti-abelson
CAM-DR , resistensi obat yang dimediasi adhesi sel
CD19 , gugus diferensiasi 19
CD34 , gugus diferensiasi 34
CD8 , gugus diferensiasi 8
CK1 , kasein kinase 1
CLL , leukemia limfositik kronis
CML , leukemia myeloid kronis
CpG , sitosin–fosfat–guanin
DLBCL , limfoma sel B besar difus
ECM , matriks ekstraseluler
FAK , kinase adhesi fokal
FOXO1 , protein kotak bercabang O1
HL-60 , leukemia manusia 60
ICAM-1 , molekul adhesi intraseluler 1
IgHV , imunoglobulin rantai berat daerah variabel
IgM , imunoglobulin kelas M
IL-1β , interleukin 1 beta
IS , sinapsis imun
KD , jatuh
KO , KO
LATS1 , kinase penekan tumor besar 1
LFA-1 , antigen terkait fungsi limfosit 1
LMNA , lamin A
LMNB , lamin B
LMNB1 , lamin B1
LMNB2 , lamin B2
LMNC , lamin C
MHC , kompleks histokompatibilitas mayor
MST1 , kinase 1 steril mirip mamalia 20
MYO1G , gen miosin I
NF-kB , faktor nuklir kappa, rantai ringan, penambah sel B yang diaktifkan
NHL , limfoma non-Hodgkin
NSK , nukleoskeleton
N-WASP , protein sindrom Wiskott–Aldrich saraf
OS , tandu optik
OT , penjepit optik
PA , poliakrilamida
PDMS , polidimetilsiloksan
PI3K , fosfoinositida-3-kinase
PIEZO1 , komponen saluran ion mekanosensitif tipe piezo 1
PM , membran plasma
PYK2 , tirosin kinase 2 kaya prolin
RT-DC , sitometri deformabilitas waktu nyata
STK4 , serin/treonin kinase 4
Protein yang mengandung domain SUN , Sad1 dan UNC-84
SYK , tirosin kinase limpa
TAZ , pengatur transkripsi yang mengandung domain WW 1
TCR , Reseptor sel T
TEAD2 , faktor transkripsi domain TEA 2
TFM , mikroskopi gaya traksi
Treg , sel T regulator
Tyr , tirosin
VLA-4 , antigen-4 yang sangat terlambat
WASP , protein sindrom Wiskott–Aldrich
YAP1 , protein terkait ya 1
Sel B dicirikan oleh ekspresi reseptor sel B permukaan sel (BCR) yang beragam secara klonal, yang memungkinkan pengenalan epitop antigen [ [ 1 ] ]. Perkembangannya terjadi dalam tahap-tahap yang berbeda, dimulai pada organ limfoid primer (sumsum tulang pada manusia dewasa) dan berlanjut dengan resirkulasi konstan antara organ limfoid sekunder (seperti kelenjar getah bening dan limpa) dan aliran darah hingga mereka bertemu dengan antigen tertentu. Setelah ini terjadi, sel B tertahan di kelenjar getah bening, tempat mereka berkembang biak dan berdiferensiasi menjadi sel B efektor atau memori [ [ 2 ] ]. Resirkulasi sel B yang berkelanjutan antara organ limfoid dan nonlimfoid bergantung pada pembuluh darah dan sistem limfatik sebagai rute perdagangan. Proses ini membuat sel B mengalami deformasi seluler yang berkelanjutan saat mereka menyempit di antara sel-sel endotel, keluar dari aliran darah dan dengan cepat beradaptasi dengan kompartemen jaringan yang berbeda [ [ 1 , 3 , 4 ] ]. Baik sel B yang sehat maupun yang ganas mengalami resirkulasi dan deformasi, meskipun perbedaan spesifik di antara mereka masih dalam penyelidikan.
Sel B mengalami dan merespons berbagai macam gaya mekanis yang bekerja pada tingkat seluler, organel, dan molekuler, yang memengaruhi perilakunya [ [ 5 – 7 ] ]. Mereka melakukannya dengan mengubah rangsangan mekanis menjadi respons biokimia intraseluler dalam suatu proses yang dikenal sebagai mekanotransduksi [ [ 8 ] ]. Proses ini, yang universal untuk sebagian besar jenis sel, sangat penting untuk mengatur berbagai fungsi seperti deformasi sel [ [ 9 ] ], pergerakan [ [ 10 ] ], kekakuan [ [ 11 ] ], respons imun [ [ 9 , 12 ] ], homeostasis jaringan, dan mekanosensing di lingkungan mikro tumor. Mekanotransduksi terjadi melalui proses multi-langkah yang dimulai di membran plasma, tempat protein mekanosensori mendeteksi perubahan mekanis di lingkungan eksternal [ [ 13 ] ]. Sinyal mekanis kemudian ditransmisikan melalui kompartemen intraseluler, yang menyebabkan reorganisasi sitoskeletal [ [ 9 ] ], regulasi ekspresi gen [ [ 14 ] ], perpindahan intraseluler [ [ 15 ] ] dan perombakan kromatin [ [ 16 ] ].
Rangsangan mekanis dapat secara luas dikategorikan menjadi (a) gaya yang diberikan, yang berasal dari lingkungan ekstraseluler, dan (b) gaya endogen, yang muncul dari dalam sel [ [ 17 ] ]. Mengenai yang pertama, sel B terkena tekanan hidrostatik, tegangan geser, aliran interstisial [ [ 18 , 19 ] ], dan gaya tarik dan tekan saat melintasi jaringan dan aliran darah, di mana mereka berinteraksi erat dengan lingkungan mikro mereka [ [ 5 , 6 , 20 ] ] (Gbr. 1 ). Gaya geser fluida ini secara signifikan memengaruhi perilaku dan morfologi sel B. Dalam sirkulasi, tegangan geser bervariasi tergantung pada jenis pembuluh darah, berkisar antara 10 hingga 60 dyn/cm 2 di arteri hingga 1 hingga 10 dyn/cm 2 di vena [ [ 21 ] ]. Pada jaringan seperti kelenjar getah bening, sel B juga terpapar aliran interstisial, di mana tegangan geser fluida puncak berkisar antara 0,8 dan 1,3 dyn/cm 2 [ [ 22 ] ]. Namun, efek spesifik dari gaya-gaya ini pada perilaku sel B individu masih harus dijelaskan sepenuhnya. Untuk mengakomodasi gaya mekanis ini, sel B memanfaatkan gaya endogen untuk mengatur bentuk, elastisitas, kekakuan, viskositas, dan gesekannya secara dinamis [ [ 7 , 23 , 24 ] ].
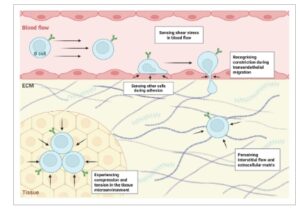
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Kekuatan mekanis yang bekerja pada limfosit yang bersirkulasi dan yang keluar dari pembuluh darah. Selama sirkulasi dalam darah tepi, sel B terpapar pada tekanan geser yang dihasilkan oleh aliran darah (atas). Selama keluar dari pembuluh darah ke jaringan, sel B mengalami penyempitan saat bermigrasi keluar dari aliran darah. Di dalam kompartemen interstisial, sel B menghadapi tekanan hidrostatik dan, akhirnya, kompresi dan ketegangan yang dihasilkan oleh lingkungan mikro di sekitarnya (bawah).
Sitoplasma berperan penting dalam adaptasi ini, menyediakan dukungan struktural dan memungkinkan fleksibilitas mekanis yang diperlukan untuk pergerakan dan fungsi. Misalnya, sel B dapat mengubah posisi sitoplasmanya untuk mendeteksi antigen eksogen, memicu aktivasi, pembentukan pusat germinal, dan produksi antibodi afinitas tinggi dalam respons imun adaptif [ [ 25 ] ].
Dalam tinjauan ini, kami akan memberikan pemeriksaan mendalam tentang mekanotransduksi dalam sel B. Kami mulai dengan menjelajahi membran plasma, tempat molekul mekanosensori utama memainkan peran penting dalam mekanosensor sel B. Dari titik ini, kami memeriksa mekanisme intraseluler dari perambatan gaya mekanis, dengan fokus pada sitoskeleton dan peran pentingnya dalam transmisi gaya. Bergerak lebih dalam, kami menyelidiki nukleus dan komponen-komponennya yang terlibat dalam respons mekano, menyelidiki bagaimana struktur ini berkontribusi pada adaptasi seluler terhadap rangsangan mekanis. Akhirnya, kami membahas teknologi utama yang digunakan untuk mengukur sifat mekanis seluler dan pendekatan in vitro terkini yang digunakan untuk mempelajari mekanoadaptasi seluler terhadap gaya yang dipaksakan. Secara keseluruhan, kami bertujuan untuk menjelaskan hubungan antara molekul terkait mekanis sel B dan implikasinya dalam perkembangan kanker hematologi, serta potensinya sebagai target terapeutik. Jika tidak ada informasi yang tersedia untuk sel B, kami memberikan contoh yang terkait dengan limfosit lain jika sesuai.
Mekanotransduksi pada limfosit sehat dan ganas
Mekanotransduksi memungkinkan limfosit untuk merasakan dan merespons gaya mekanis, yang memengaruhi migrasi, aktivasi, dan fungsi keseluruhannya. Bagian ini mengkaji komponen utama proses ini pada limfosit sehat dan ganas, dimulai dengan sifat mekanis membran plasma, diikuti oleh peran sitoskeleton dan nukleus dalam mentransmisikan dan mengintegrasikan sinyal mekanis.
Membran plasma: dari komposisi hingga sifat mekanosensorinya
Membran plasma (PM) adalah lapisan lipid dinamis yang terdiri dari sphingolipid, fosfolipid, kolesterol dan protein, yang memisahkan kompartemen seluler bagian dalam dan luar [ [ 26 ] ]. Membran plasma membentuk daerah khusus, seperti rakit lipid, dan mempertahankan fluiditas, asimetri dan integritas, yang memungkinkan proses seluler utama termasuk endositosis, eksositosis, migrasi dan pembelahan sel [ [ 27 , 28 ] ]. Sifat mekanis membran bergantung pada komposisi lipid dan protein spesifiknya. Misalnya, sel B yang belum matang memiliki kadar kolesterol membran yang lebih rendah daripada sel B yang matang, yang ditemukan terkait dengan gangguan agregasi BCR. Karena sel-sel ini harus mengenali dan merespons antigen secara efisien untuk aktivasi imun yang tepat, temuan ini menunjukkan bahwa kandungan kolesterol dapat memengaruhi respons antigen [ [ 29 ] ]. Selain kolesterol, lipid lain dalam PM ditemukan mengatur berbagai proses seluler. Misalnya, perubahan dalam distribusi fosfatidilserin dalam PM diamati untuk mengatur transduksi sinyal dalam sel T. Sinyal-sinyal tersebut mencakup aktivasi hilir respons inflamasi terkait IL-1β dan CD62L, serta migrasi limfosit dan proses adhesi [ [ 30 ] ]. Selain komposisinya, PM dicirikan oleh beberapa molekul mekanosensori, termasuk molekul adhesi, saluran ion, dan reseptor [ [ 8 ] ] (Gbr. 2A ).
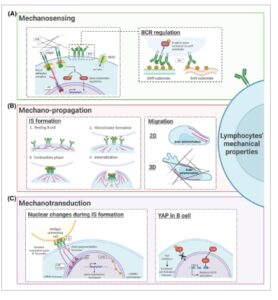
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Komponen utama yang terlibat dalam mekanosensing sel B, mekano-propagasi, dan mekanotransduksi. (A) Molekul mekanosensori: peran reseptor sel B (BCR) sebagai mekanosensor selama aktivasi sel B. (B) Mekano-propagasi intraseluler: pengaruh dinamika sitoskeletal dalam pembentukan sinaps imunologi (IS) dan migrasi sel B dalam lingkungan 2D dan 3D. (C) Mekanotransduksi: pengaruh BCR dalam orientasi nuklir, fungsi kompleks LINC, regulasi nukleoskeleton lamin, dan fungsi YAP.
Molekul pensinyalan reseptor sel B/T
Reseptor pada PM mencakup reseptor sel B dan T (BCR/TCR) yang mendeteksi antigen spesifik dan memicu perkembangan limfosit dan aktivasi imun [ [ 31 , 32 ] ]. Studi terbaru telah menunjukkan bahwa aktivasi TCR bergantung pada rangsangan mekanis dari lingkungan ekstraseluler [ [ 33 , 34 ] ]. Misalnya, Blumenthal et al . menunjukkan bahwa priming sel T oleh sel penyaji antigen (APC) dipengaruhi oleh sinyal mekanis, dimana kekuatan interaksi antara TCR dan MHC meningkat secara proporsional dengan kekakuan APC [ [ 35 ] ].
Peran BCR sebagai mekanosensor kurang dipelajari secara ekstensif dibandingkan dengan TCR, tetapi ditunjukkan bahwa aktivasi BCR juga dipengaruhi oleh kekakuan APC [ [ 5 ] ]. Wan et al . menyelidiki aktivasi sel B primer setelah mengikat antigen yang diikatkan pada gel polidimetilsiloksan (PDMS) dengan kekakuan yang bervariasi. Dengan menggunakan mikroskopi resolusi super, mereka mengukur akumulasi BCR dan indikator utama pensinyalan dan aktivasi BCR awal seperti molekul tirosin kinase limpa terfosforilasi (pSYK) dan tirosin terfosforilasi (pTyr) di sinaps imunologis (IS). Sel B yang berinteraksi dengan substrat dengan kekakuan tinggi menunjukkan peningkatan akumulasi BCR dan peningkatan ekspresi penanda aktivasi dibandingkan dengan yang berada pada substrat yang lebih lunak [ [ 36 ] ]. Penulis yang sama juga menunjukkan bahwa IgM-BCR dan IgG serta IgE-BCR yang berganti kelas memerlukan ambang energi mekanik yang berbeda untuk aktivasi [ [ 37 ] ].
Yang lain telah mengkonfirmasi bahwa substrat yang lebih kaku meningkatkan aktivasi sel B [ [ 38 ] ], dan bahwa proliferasi sel B lebih tinggi pada substrat yang lebih lunak, kemungkinan karena keterlibatan BCR dan fosforilasi molekul PI3K, AKT dan FOXO1 berikutnya. Temuan ini menyoroti kompleksitas mekanosensing dan mekanotransduksi dalam sel B. Kemudian, Wang et al . menggunakan mikroskopi gaya traksi untuk menetapkan korelasi langsung antara gaya traksi yang diberikan selama aktivasi sel B dan kekakuan substrat penyaji antigen. Selain itu, mereka mengidentifikasi hubungan positif antara kekuatan gaya traksi dan pembentukan mikro-kluster BCR [ [ 39 ] ]. Secara keseluruhan, studi-studi ini menyoroti peran mendasar gaya mekanis dalam mengatur fungsi sel B. Karena pengenalan antigen oleh sel B diatur secara mekanis oleh kekakuan substrat, aspek ini dapat relevan dalam konteks pengembangan vaksin dan penyakit yang disebabkan oleh hiper- atau hipo-aktivasi limfosit B.
Integrin
Kelas penting lain dari protein mekanosensori adalah integrin [ [ 7 ] ], keluarga molekul kompleks secara struktural yang penting untuk adhesi sel-sel dan sel-matriks ekstraseluler [ [ 40 ] ]. Dua integrin utama diekspresikan oleh sel B dan T: antigen terkait fungsi leukosit 1 (LFA-1) dan antigen sangat akhir 4 (VLA-4). Integrin ini memiliki peran penting dalam adhesi, aktivasi, dan pengangkutan leukosit [ [ 41 ] ]. Setelah pengikatan protein matriks ekstraseluler (ECM), integrin mengelompok untuk membentuk kompleks multi-protein adhesi fokal (FA) yang berfungsi sebagai hub pensinyalan dengan berinteraksi dengan protein adaptor (seperti paxillin, talin, dan vinculin [ [ 8 ] ]) untuk memfasilitasi transmisi sinyal mekanis melalui sitoskeleton [ [ 42 ] ]. Focal adhesion kinase (FAK) adalah salah satu molekul pertama yang direkrut setelah rangsangan eksternal [ [ 43 ] ], memicu jalur pensinyalan hilir, termasuk protein terkait-Yes 1 (YAP1) [ [ 44 ] ]. Shaheen et al . menunjukkan peran penting FAK dalam mekanosensing sel B, dengan hilangnya FAK menghilangkan diskriminasi kekakuan substrat dan aktivasi [ [ 45 ] ].
Saluran ion
Saluran ion juga berfungsi sebagai molekul mekanosensori. Mereka memfasilitasi masuknya kalsium, memicu jalur pensinyalan hilir yang terutama terlibat dalam reorganisasi sitoskeletal dan pergerakan sel [ [ 46 ] ]. Di antara ini, PIEZO1 adalah salah satu saluran ion mekanosensitif yang paling berkarakterisasi dan diekspresikan secara luas. PIEZO1 adalah protein heterodimerik yang mendeteksi dan merespons regangan mekanis eksternal dan tekanan geser, yang menyebabkan masuknya kalsium [ [ 47 ] ]. Saluran ini telah terlibat dalam berbagai konteks fisiologis dan patologis, termasuk potensi sitotoksik sel T dan aktivasi sel B [ [ 48 ] ]. Menariknya, para peneliti telah menunjukkan bahwa stres mekanis saja sudah cukup untuk mengaktifkan imunitas bawaan melalui PIEZO1. Temuan ini sangat relevan, karena perubahan mekanis dalam lingkungan mikro dapat menghasilkan energi mekanis yang cukup untuk menginduksi aktivasi saluran ion, sehingga berkontribusi pada perkembangan penyakit dan autoinflamasi. Oleh karena itu, proses mekanotransduksi ini merupakan target potensial untuk intervensi terapeutik [ [ 15 ] ]. Akhirnya, peran PIEZO1 dalam priming sel T, aktivasi dan produksi sitokin telah dieksplorasi lebih lanjut [ [ 49 , 50 ] ].
Sebuah studi baru-baru ini oleh Kwak et al . menyelidiki PIEZO1 dalam sel B, menunjukkan bahwa gangguan tegangan PM, seperti kontak dengan permukaan padat, cukup untuk mengaktifkan PIEZO1, yang memungkinkan masuknya Ca 2+ . Menariknya, masuknya ini tidak bergantung pada ikatan silang BCR. Sebaliknya, tampaknya mekanosensing PM melalui PIEZO1 mendahului aktivasi sel B yang bergantung pada BCR. Para peneliti mengusulkan bahwa mekanisme ini mungkin menjelaskan mengapa sel B sebagian besar merespons antigen yang disajikan membran daripada antigen yang larut secara in vivo dan menyarankan bahwa hal itu mungkin relevan untuk meningkatkan kemanjuran vaksin [ [ 51 ] ].
Mekano-propagasi intraseluler melalui ketegangan sitoskeletal
Transmisi sinyal mekanis, baik didorong oleh gaya ekstraseluler atau yang dihasilkan sel, bergantung pada penataan ulang sitoskeletal utama, khususnya dalam sitoskeleton aktin [ [ 8 ] ]. Di pinggiran sel, di bawah PM, aktin diatur menjadi jaringan tiga dimensi yang dikenal sebagai korteks aktin. Pada limfosit, korteks ini terdiri dari jaringan kontraktil filamen aktin yang terdistribusi secara acak dan protein motor miosin II, yang menghasilkan gaya kontraktil dan tarik yang penting untuk mengatur bentuk sel, kontraksi, pembelahan, dan migrasi [ [ 24 , 52 ] ]. Ketegangan aktin-miosin di tepi terdepan, bersama dengan adhesi yang dimediasi integrin, menghasilkan gaya dorong yang diperlukan untuk pergerakan sel [ [ 53 ] ].
Bentuk sel dan migrasi
Sel B mengadopsi mode migrasi amoeboid, yang ditandai dengan adhesi fokal yang belum matang, yang memungkinkan mereka untuk berubah bentuk dengan cepat dalam lingkungan dua dimensi (2D) yang sederhana [ [ 54 ] ]. Menariknya, migrasi amoeboid leukosit saja tidak cukup untuk pergerakan yang efisien melalui kompartemen tubuh, yang menunjukkan adanya mekanisme tambahan yang berperan [ [ 55 ] ]. Memang, sebuah penelitian menggunakan sel dendritik sebagai model untuk migrasi leukosit interstisial dalam lingkungan tiga dimensi (3D) [ [ 56 ] ] menunjukkan adanya aliran aktin retrograde—pergerakan aktin dari depan ke belakang badan sel—selama migrasi [ [ 57 ] ]. Aliran retrograde ini menghasilkan gesekan dengan lingkungan mikro di sekitarnya, di mana fitur topografi memiliki peran utama dalam transmisi gaya selama migrasi bebas adhesi [ [ 53 , 56 ] ].
Studi pada sel T menunjukkan bahwa mereka dapat mengganti mode dan kecepatan migrasi melalui interaksi LFA1/ICAM-1 [ [ 58 ] ]. Khususnya, LFA-1 telah diusulkan untuk bertindak sebagai antarmuka gesekan di ruang terbatas, memungkinkan pergerakan sel tanpa adhesi [ [ 59 ] ]. Mekanisme serupa telah diusulkan untuk sel B, tetapi data tentang proses ini masih terbatas [ [ 53 ] ]. Temuan ini menyoroti hubungan timbal balik antara sel dan lingkungan mikronya, sebuah fenomena yang umumnya disebut sebagai ‘mekanoresiprositas’ [ [ 60 ] ].
Kegiatan BCR
Sitoplasma aktin juga memainkan peran langsung dan serbaguna dalam memodulasi aktivitas reseptor antigen, menjembatani respons fisik dan biokimia, dan memfasilitasi deformasi seluler utama (Gbr. 2B ) [ [ 61 ] ]. Pada sel B yang beristirahat, BCR ada sebagai monomer dalam ruang terbatas, dengan motilitas lateral dibatasi oleh korteks aktin [ [ 62 ] ]. Depolymerisasi aktin sementara dan pelepasan korteks aktin dari membran plasma diperlukan untuk pembentukan mikro-kluster BCR, yang memulai kaskade pensinyalan [ [ 63 ] ]. Menghambat polimerisasi aktin (menggunakan latrunculin B) menyebabkan mikro-kluster dan aktivasi BCR spontan, sedangkan menginduksi polimerisasi aktin (menggunakan jasplakinolide, penginduksi dan penstabil filamen aktin yang sudah ada sebelumnya) memiliki efek sebaliknya [ [ 64 ] ].
Untuk meningkatkan jumlah hub pensinyalan ini, sel B menyebarkan membrannya melintasi sel penyaji dalam sebuah proses yang dinamakan penyebaran sel, yang memungkinkan kontak dengan jumlah antigen yang lebih besar [ [ 65 ] ]. Sementara sel B menyebar, aktin mengalami reorganisasi yang signifikan. Zona kontak antara sel B dan APC membutuhkan aktivasi kompleks ARP2/3 melalui protein WASP dan/atau N-WASP. Knockout dari protein-protein ini telah terbukti mengurangi penyebaran sel, yang mengonfirmasi peran mereka dalam proses ini [ [ 66 ] ]. Peregangan penyebaran sel bergantung pada afinitas dan jumlah antigen pada APC. Menariknya, dengan menggunakan platform dengan ligan yang diimobilisasi dan gaya mekanis yang dapat disetel, Wan et al . mengamati bahwa gaya mekanis yang lebih tinggi umumnya menyebabkan penyebaran sel yang lebih kuat dan meningkatkan akumulasi BCR di IS. Ini menunjukkan bahwa sifat mekanis APC sangat mengatur aktivasi BCR dan bahwa BCR-IgM sendiri dapat berfungsi sebagai mekanosensor, seperti yang dibahas sebelumnya [ [ 37 ] ]. Setelah penyebaran maksimal tercapai, sel B memulai fase kontraksi, di mana aliran aktin retrograde, didorong oleh kontraksi myosin II, mendorong pergerakan mikro-kluster BCR menuju pusat area kontak [ [ 67 ] ]. Penghambatan aktivitas myosin II mengganggu pembentukan IS dan pensinyalan BCR [ [ 52 ] ].
Bahasa Indonesia: Setelah pengikatan antigen, kompleks BCR mengalami internalisasi melalui berbagai mekanisme yang bergantung pada aktin, yang merupakan proses yang menuntut secara mekanis yang memerlukan polimerisasi aktin [ [ 68 ] ]. Jalur yang paling terkarakterisasi dengan baik adalah endositosis yang dimediasi clathrin, yang telah diusulkan sebagai mekanisme yang bergantung pada tegangan membran [ [ 69 ] ]. Knockout clathrin secara signifikan mengganggu internalisasi BCR. Namun, telah juga ditunjukkan bahwa sel B dapat menginternalisasi BCR spesifik antigen melalui mekanisme yang tidak bergantung pada clathrin yang masih memerlukan remodeling aktin [ [ 70 ] ]. Wawasan terkini menunjukkan bahwa peralihan antara mode internalisasi ini ditentukan oleh ukuran klaster BCR [ [ 71 ] ].
Properti mekano-aktuator inti
Sinyal mekanis yang dideteksi oleh molekul mekanosensori di PM ditransmisikan ke nukleus melalui modifikasi sitoskeletal. Bukti terbaru menunjukkan bahwa nukleus tidak hanya menerima sinyal dari sitosol tetapi juga berfungsi sebagai mekanosensor dengan sendirinya [ [ 72 ] ]. Mengingat bahwa nukleus adalah organel terbesar dan terkuat, menempati sebagian besar volume sel dalam sel B (Gbr. 2C ) [ [ 1 , 7 ] ], dan berfungsi sebagai kendala utama dalam deformasi seluler. Studi yang muncul, sebagian besar dilakukan dalam model 3D, mengusulkan nukleus berfungsi sebagai mekano-gauge, yang berarti bahwa peregangan selubung nukleus dalam lingkungan terbatas berkorelasi dengan perilaku seluler tertentu [ [ 73 , 74 ] ].
Penelitian pada sel-sel yang bermigrasi ke amuba, seperti sel dendritik dan sel T, menunjukkan bahwa sel-sel ini lebih menyukai pori-pori yang lebih besar dan bergerak ke arah jalur yang paling mudah. Khususnya, sel-sel ini bergerak dalam konfigurasi yang mengutamakan nukleus, dengan nukleus yang memandu migrasi melalui penyempitan [ [ 75 ] ]. Apakah sel B mengadopsi mekanisme yang sama masih belum diketahui, karena belum ada penelitian yang menyelidiki fenomena ini.
Pengangkutan protein sebagai mekanotransduser
Studi pada sel-sel yang melekat telah mengidentifikasi masuknya protein ke dalam inti sebagai respons terhadap rangsangan mekanis, seperti β-catenin [ [ 76 ] ], zyxin [ [ 77 ] ] dan paxillin [ [ 78 ] ], yang mengatur ekspresi gen. Mekanotransduser inti, termasuk koaktivator transkripsi homolog YAP1 dan protein pengatur transkripsi yang mengandung domain WW 1 (WWTR1/TAZ), juga telah diidentifikasi [ [ 79 ] ].
Dalam sel B, YAP1 dan TAZ tampaknya dipertahankan pada tingkat ekspresi yang lebih rendah daripada pada jenis sel manusia lainnya [ [ 80 ] ], karena alasan yang belum diketahui. Menariknya, wawasan baru tentang aktivitas imunosupresif sel T regulator (Treg) telah menunjukkan bahwa deregulasi YAP1 meningkatkan aktivitas Treg [ [ 81 ] ]. Dalam sel B, deregulasi YAP1 dan TAZ dapat memiliki peran yang sama dengan mengatur aktivitas sel B; namun, peran pasti protein ini dalam sel B masih harus dijelaskan. Xiaoming et al . menyelidiki regulasi CD19, antigen limfosit B dan biomarker yang terlibat dalam regulasi BCR, oleh kinase MST1, kinase protein serin/treonin, komponen kunci jalur pensinyalan Hippo dan faktor pro-apoptosis. Mereka menemukan bahwa MST1 mengatur YAP1 secara negatif. Dengan tidak adanya MST1, YAP1 bertranslokasi ke dalam nukleus, di mana ia menekan transkripsi CD19 melalui aktivasi TEAD2, menyoroti peran potensialnya dalam aktivasi sel B [ [ 82 ] ]. Studi lain menunjukkan bahwa penghambatan YAP1 yang dimediasi oleh fosforilasi meningkatkan kelangsungan hidup sel B dengan menekan sekresi IL-1β selama infeksi Salmonella , sehingga memfasilitasi penyebaran dan persistensi bakteri [ [ 83 ] ].
Fungsi nukleoskeleton
Selain translokasi protein, hubungan fisik langsung antara nukleus dan PM telah diidentifikasi, dimediasi oleh kompleks Linker of Nucleoskeleton and Cytoskeleton (LINC) [ [ 84 ] ].
Kompleks ini terdiri dari nesprin, yang mengikat secara langsung atau tidak langsung ke sitoskeleton, dan SUN, yang berinteraksi dengan nukleoskeleton (NSK) [ [ 8 ] ], jaringan kompleks protein yang berinteraksi dengan lamin sebagai elemen struktural inti [ [ 85 ] ]. Dua isotipe lamin utama adalah lamin A (LMNA) dan lamin B (LMNB), dengan lamin C (LMNC) yang timbul dari penyambungan alternatif LMNA. Sebuah studi baru-baru ini mengungkapkan bahwa selama pembentukan IS, sel-sel B mengarahkan kembali nukleusnya ke arah tempat kontak antigen. Membungkam baik nesprin maupun SUN merusak reposisi nuklir dan pembentukan IS, yang menyebabkan internalisasi BCR yang rusak [ [ 86 ] ]. Penelitian lebih lanjut menggunakan penjepit magnetik untuk menerapkan gaya secara langsung ke nesprin dalam nukleus yang terisolasi menunjukkan bahwa pengerasan nuklir terjadi melalui lamin [ [ 84 , 87 ] ].
LMNA merupakan penentu utama bentuk dan kekakuan inti; sel yang kekurangan LMNA menunjukkan inti yang lebih lunak dan peningkatan pembentukan gelembung inti [ [ 88 , 89 ] ]. Tikus yang kekurangan LMNA mati segera setelah lahir, menunjukkan cacat parah pada perkembangan sel T dan B, serta ukuran timus dan limpa yang mengecil [ [ 90 ] ].
LMNB, dikodekan oleh dua gen yang berbeda ( LMNB1 dan LMNB2 ) [ [ 91 ] ], diekspresikan pada rasio LMNA:LMNB1 yang bervariasi tergantung pada jenis jaringan. Pada progenitor sel induk hematopoietik manusia dari sumsum tulang, ekspresi LMNA rendah dan stoikiometri LMNA:LMNB1 yang rendah diperkirakan mempengaruhi kekakuan dan deformabilitas nuklir [ [ 92 , 93 ] ]. Misalnya, LMNA yang rendah memfasilitasi deformasi neutrofil, membantu perjalanan mereka melalui penghalang mikropori [ [ 94 , 95 ] ].
Tidak seperti jenis sel lainnya, limfosit tidak mempertahankan ekspresi LMNA yang stabil; sebaliknya, kadar LMNA berfluktuasi selama diferensiasi, aktivasi, dan migrasi [ [ 96 ] ]. González-Granado et al . melaporkan bahwa sel T naif yang sedang beristirahat memiliki ekspresi LMNA minimal, tetapi setelah aktivasi TCR, kadar LMNA meningkat secara signifikan, yang mendorong pembentukan IS, kemungkinan melalui polimerisasi aktin [ [ 97 ] ]. Penelitian lebih lanjut diperlukan untuk menentukan apakah mekanisme serupa mungkin ada pada sel B.
Memang, sedikit penelitian telah meneliti organisasi dan fungsi lamin dalam sel B. Sherif et al . menyelidiki migrasi dalam subtipe limfoma sel B besar difus (DLBCL) dan menemukan bahwa ekspresi LMNA/C meningkat pada sel primer dan lini sel, mengganggu kemampuan mereka untuk berubah bentuk dan bermigrasi melalui ruang sempit [ [ 98 ] ]. Penelitian lain melaporkan bahwa selama aktivasi sel B dan pembentukan pusat germinal, pengikatan kromatin ke LMNB1 menurun, kemungkinan karena fosforilasinya, yang meningkatkan ekspresi gen. Pengurutan imunopresipitasi kromatin mengungkapkan bahwa DNA yang dilepaskan sesuai dengan domain imunoglobulin kappa dan variabel berat, yang menghubungkan regulasi LMNB1 dengan hipermutasi somatik [ [ 16 ] ].
Menyelidiki mekanika limfosit: dari teknik pengukuran hingga implikasi biologis
Memahami pemain kunci yang terlibat dalam mekanotransduksi seluler sangat penting untuk menguraikan bagaimana sel merasakan dan merespons rangsangan mekanis, yang memengaruhi fungsi-fungsi seperti migrasi, aktivasi, dan kelangsungan hidup. Namun, penting juga untuk mempertimbangkan sifat-sifat mekanis intrinsik sel, yang menentukan kemampuannya untuk berubah bentuk sebagai respons terhadap gaya-gaya mekanis dari waktu ke waktu. Memang, perubahan-perubahan dalam kekakuan sel telah dilaporkan dalam berbagai kondisi fisiologis dan patologis, termasuk penuaan [ [ 99 ] ], infeksi [ [ 100 ] ] dan kanker [ [ 11 , 101 ] ]. Mengingat signifikansi biologis dari sifat-sifat mekanis ini, ada kebutuhan yang semakin meningkat untuk teknik-teknik canggih untuk mempelajari dan mengukurnya pada resolusi tinggi.
Teknik pengukuran
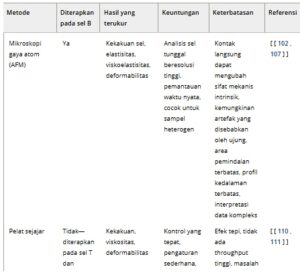
Selama dua dekade terakhir, banyak metode eksperimental telah dikembangkan untuk mempelajari dan mengukur berbagai bentuk deformasi seluler. Di bagian ini, kami menguraikan beberapa metode ini (Tabel 1 ) dan menunjukkan penerapannya untuk lebih memahami mekanotransduksi sel B dalam kondisi fisiologis dan patologis. Meskipun beberapa belum ditetapkan untuk sel B, metode tersebut telah berhasil digunakan untuk limfosit lain, sehingga berpotensi relevan untuk penelitian sel B (Gbr. 3A ).
Tabel 1. Metode pengukuran yang digunakan untuk mempelajari dan mengukur sifat mekanik limfosit, beserta kelebihan dan keterbatasannya.
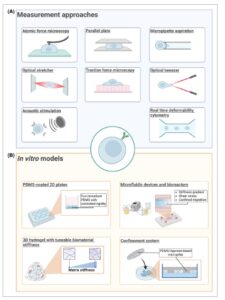
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Pendekatan eksperimental untuk menyelidiki sifat mekanis limfosit. (A) Teknologi untuk mengukur parameter mekanis sel tunggal, seperti Modulus Young, viskositas, dan deformabilitas. (B) Model untuk stimulasi mekanis, termasuk sistem in vitro untuk memaparkan sel terhadap gaya mekanis dan kondisi lingkungan mikro.
Mikroskop gaya atom
Mikroskopi gaya atom (AFM) secara luas dianggap sebagai standar emas untuk mempelajari sifat mekanis jaringan dan sel individu [ [ 102 ] ]; memungkinkan pengukuran respons seluler elastis [ [ 103 ] ] dan kental [ [ 104 , 105 ] ]. AFM beroperasi menggunakan mikroskop probe pemindaian, di mana ujung pemindaian, dipasang di ujung kantilever fleksibel, menyelidiki permukaan sampel [ [ 106 ] ]. Saat ujung bergerak melintasi sampel, defleksi kantilever berubah, mencerminkan sifat mekanis spesimen [ [ 107 ] ].
Dalam analisis sel tunggal, kontribusi struktur seluler yang berbeda terhadap sifat mekanik bergantung pada gaya yang diberikan. Misalnya, dalam pekerjaan kami sebelumnya pada sel B yang sehat dan ganas, kami membuat lekukan limfosit sejauh 500 nm untuk menilai peran korteks aktomiosin dalam kekakuan seluler dan untuk menyelidiki apakah agen kemoterapi dapat mengubah sifat mekaniknya. Menariknya, kami menemukan bahwa arsitektur kompleks aktomiosin dan kontraktilitas sel leukemia limfositik kronis (CLL) berkorelasi dengan fitur mekanik spesifik yang berbeda dari sel B yang sehat [ [ 11 ] ]. Dalam studi lain, peneliti menggunakan AFM untuk mengukur perubahan mekanik sel B limfoma setelah pengobatan kemoterapi. Mereka mengamati pengurangan signifikan dalam kekakuan limfoma sel B setelah pengobatan, menunjukkan bahwa AFM dapat menjadi alat yang berharga untuk meningkatkan pemahaman tentang efek kemoterapi [ [ 108 ] ]. Baru-baru ini, bekerja sama dengan peneliti lain, kami mengoptimalkan protokol untuk menghasilkan kantilever baji. Geometri baru ini mengatasi keterbatasan yang timbul dari karakteristik sampel kami (sel kecil, bulat dan lunak), sehingga memungkinkan pengukuran fungsi stres-relaksasi sel CLL, yang sulit dinilai menggunakan ujung yang lebih tradisional, seperti ujung piramida atau koloid berbentuk persegi [ [ 109 ] ].
Pelat sejajar
Pendekatan pelat paralel adalah teknik yang mirip dengan AFM yang menerapkan gaya pada sisi sel yang tidak berperekat. Dalam metode ini, sel ditempatkan di antara dua pelat paralel—satu fleksibel dan satu kaku—yang memungkinkan penilaian modulus Young, deformabilitas-relaksasi, dan fungsi creep [ [ 110 ] ].
Metode ini telah digunakan untuk menyelidiki sifat viskoelastis sel T dan APC myeloid baik dalam keadaan istirahat maupun inflamasi. Temuan tersebut menunjukkan bahwa sel T menghadapi kekakuan sel yang bervariasi saat berinteraksi dengan APC, dan bahwa sifat mekanis ini dapat berubah selama proses inflamasi [ [ 111 ] ]. Metode ini belum diterapkan pada sel B sejauh ini, tetapi kami yakin bahwa pendekatan ini dapat digunakan untuk mengekstrak informasi tentang bagaimana kekakuan sel B berubah selama proses aktivasi atau inflamasi.
Mikroskopi gaya traksi
Mikroskopi gaya traksi (TFM) mengukur gaya traksi seluler—gaya yang diberikan oleh sel untuk meregangkan atau menarik sekelilingnya—dengan mengukur deformasi substrat yang disebabkan oleh gaya yang dihasilkan sel secara optik [ [ 112 ] ]. Untuk mengukur deformasi substrat, pengaturan menggunakan susunan adhesi yang biasanya terdiri dari gel lunak yang tertanam dengan manik-manik atau susunan mikropilar. Defleksi pilar atau manik tertentu, yang dapat diukur melalui pencitraan optik, bergantung semata-mata pada gaya yang diberikan pada pilar atau manik spesifik tersebut oleh sel [ [ 113 ] ]. TFM telah diadaptasi untuk sel yang melekat dan sel suspensi dan juga telah dioptimalkan untuk pengukuran dalam matriks 3D [ [ 112 ] ]. Pada sel B, TFM telah digunakan untuk menyelidiki gaya yang diberikan pada substrat adhesi selama aktivasi. Secara khusus, Kumari et al . mengoptimalkan metode untuk menyelidiki distribusi spasial dan temporal medan gaya yang dihasilkan oleh BCR selama ekstraksi antigen. Dalam protokol mereka, substrat diadaptasi untuk meniru kekakuan lingkungan fisiologis dan memungkinkan pengukuran beberapa sel secara bersamaan. Menariknya, mereka mengamati bahwa gaya mekanis berpola secara spasiotemporal di IS, dengan interaksi antara gaya perifer dan sentral, keduanya diatur oleh kompleks aktinomiosin [ [ 114 , 115 ] ].
Pendekatan berbasis optik
Dua metode utama berbasis medan optik untuk mengukur sifat mekanik sel adalah optical stretcher (OS) dan optical tweezer (OT) [ [ 110 , 116 ] ]. Teknik non-invasif ini mengandalkan sinar laser terfokus untuk memanipulasi objek skala mikro, seperti sel atau komponen subseluler [ [ 117 , 118 ] ]. OS menggunakan dua sinar laser divergen berdaya tinggi untuk menjebak dan merusak seluruh sel. Peningkatan daya laser meningkatkan gaya yang diberikan dan deformasi seluler [ [ 119 ] ], tetapi juga dapat menyebabkan kerusakan atau pemanasan sel, yang berpotensi mengubah pengukuran [ [ 120 ] ].
Sebuah studi yang menyelidiki neutrofil dan sel darah merah memperkenalkan linear optical stretcher sebagai metode berpotensi berthroughput tinggi untuk menilai sifat mekanik seluler. Studi ini mengusulkan sistem mikrofluida yang menggabungkan daerah peregangan optik, tempat sel-sel individual ditangkap dan dideformasi secara langsung dalam aliran. Pendekatan ini memungkinkan diskriminasi sel berdasarkan deformasi mereka [ [ 121 ] ]. Sebaliknya, OT menggunakan sinar laser terfokus untuk menerapkan gaya tarik dan tolak pada spesimen [ [ 122 ] ]. Sementara metode ini memiliki rentang gaya terbatas dan tidak dapat sepenuhnya mendeformasi sel, metode ini sangat berguna untuk mempelajari kejadian mekanik lokal [ [ 117 ] ]. Misalnya, Duś-Szachniewicz et al . menggunakan OT untuk mengukur gaya awal interaksi antara sel B normal dan ganas dan lingkungan mikro mereka. Mereka mengembangkan metode yang memungkinkan diskriminasi sel B normal dari sel B limfoma non-Hodgkin (NHL) berdasarkan adhesi mereka ke sel stroma mesenkimal. Temuan mereka menunjukkan bahwa sel B ganas menunjukkan sifat perekat yang berkurang secara signifikan dibandingkan dengan sel B normal [ [ 120 ] ].
Pendekatan berbasis medan akustik
Teknik berbasis medan akustik menyediakan metode bebas label, tanpa kontak, dan biokompatibel untuk manipulasi sel [ [ 123 ] ]. Metode-metode ini telah diterapkan dalam berbagai konteks, termasuk pemisahan sel berdasarkan ukuran dan sifat mekanis. Misalnya, Ding et al . mengembangkan pendekatan noninvasif untuk memilah sel-sel berukuran sama berdasarkan kompresibilitasnya. Dengan menggunakan metode ini, mereka berhasil memisahkan sel-sel kanker payudara manusia yang bersirkulasi dari leukosit nonmaligna [ [ 124 ] ]. Medan akustik juga telah digunakan untuk mengukur kompresibilitas seluler [ [ 125 ] ]. Pendekatan yang sangat menarik adalah mikroskopi Brillouin, yang bergantung pada hamburan cahaya karena interaksi antara cahaya dan gelombang akustik gigahertz, suatu proses yang dikenal sebagai hamburan cahaya Brillouin. Teknik ini memberikan wawasan tentang sifat viskoelastis sampel biologis [ [ 126 ] ]. Ini adalah metode noninvasif, bebas label yang juga dapat diterapkan pada sampel 3D [ [ 127 ] ]. Hingga saat ini, belum ada penelitian yang mengeksplorasi penerapan metode ini pada sel B. Namun, mikroskopi Brillouin dapat berfungsi sebagai alat yang berharga untuk mempelajari modulus elastisitas dan respons viskoelastis sel B dalam suspensi, tanpa perlu menginduksi adhesi sel.
Aspirasi mikropipet
Aspirasi mikropipet adalah salah satu teknik paling awal yang dikembangkan untuk mengukur sifat mekanis sel tunggal. Dalam metode ini, sel yang tersuspensi disedot ke dalam mikropipet dengan menerapkan tekanan negatif yang terkontrol [ [ 128 , 129 ] ]. Posisi sel dan perubahan morfologi pada ujung mikropipet kemudian dilacak dari waktu ke waktu menggunakan mikroskop. Pendekatan ini memungkinkan pengukuran kekakuan, volume sel, viskositas dan koefisien penipisan geser [ [ 130 ] ]. Dalam penelitian terbaru, aspirasi mikropipet digunakan untuk memeriksa perubahan mekanis pada sel T selama aktivasi. Temuan tersebut mengungkapkan bahwa sel CD8 + yang diaktifkan , dibandingkan dengan sel CD8 + naif , menunjukkan peningkatan volume, ketegangan kortikal dan respons elastis awal, yang menurut penulis dapat berkontribusi pada motilitas spontan [ [ 131 ] ]. Aspirasi mikropipet juga telah diterapkan untuk meniru pemerasan dan deformasi sel T yang melewati kapiler atau selama migrasi transendotelial, untuk memahami apakah ada mekanisme pengaturan yang mencegah pecahnya membran selama deformasi besar. Menariknya, pendekatan ini mengungkapkan bahwa, selama aspirasi, sel T mempertahankan volume konstan sementara luas permukaannya meningkat, dan bahwa pecahnya membran hanya terjadi ketika ekspansi area membran melebihi ambang batas kritis, yang tidak tergantung pada aspirasi oleh mikropipet [ [ 132 ] ]. Saat ini, aspirasi mikropipet belum diterapkan pada sel B, tetapi dapat digunakan untuk mempelajari, misalnya, migrasi sel B di ruang sempit dan sifat mekanis terkait.
Sitometri deformabilitas waktu nyata
Real-time deformability cytometry (RT-DC) adalah metode throughput tinggi untuk menyelidiki morfologi dan reologi seluler—deformasi materi [ [ 133 ] ]—pada tingkat sel tunggal. Sel-sel terpapar aliran laminar dalam mikrokanal dengan dimensi yang sebanding dengan ukuran sel, yang menyebabkan deformasi sel tanpa kontak mekanis langsung [ [ 134 ] ]. Teknik ini memungkinkan akuisisi dan segmentasi gambar sel yang mengalami deformasi, memberikan informasi tentang ukuran sel, deformabilitas, dan kekakuan [ [ 135 , 136 ] ]. RT-DC sangat sensitif terhadap perubahan pada sitoskeleton. Misalnya, dalam sebuah penelitian oleh Golfier et al . pada garis sel leukemia HL-60, ditunjukkan bahwa integritas korteks aktin dan jaringan mikrotubulus merupakan faktor dominan dalam menentukan deformasi sel [ [ 137 ] ]. Dalam penelitian lain, RT-DC digunakan untuk mengungkap modulus Young dan viskositas dalam penyaringan throughput tinggi 100 sel per detik. Selain itu, pendekatan ini memungkinkan diskriminasi garis keturunan leukosit yang berbeda, seperti sel B dan sel T CD4 + [ [ 138 ] ]. Jumlah penelitian pada sel B yang diisolasi terbatas; namun, kesenjangan ini dapat menjadi peluang untuk penelitian lebih lanjut.
Sistem in vitro
Bersamaan dengan kemajuan dalam teknik untuk mengukur dan mengkuantifikasi sifat mekanik sel, pemodelan biomekanik sel muncul sebagai pendekatan yang menjanjikan untuk memahami mekanobiologi sel. Kemajuan terkini dalam bioteknologi telah menghasilkan berbagai sistem in vitro untuk menyelidiki efek stimulasi mekanik pada sel, mulai dari kultur 2D standar hingga sistem 3D dan perangkat mikrofluida [ [ 139 ] ]. Di bagian ini, kami menyoroti contoh sistem ini, dengan fokus khusus pada aplikasi sel B (Tabel 2 , Gambar 3B ).
Tabel 2. Model in vitro untuk menyelidiki efek stimulasi mekanis pada sel yang diinginkan, dicantumkan bersama dengan kelebihan dan keterbatasannya.
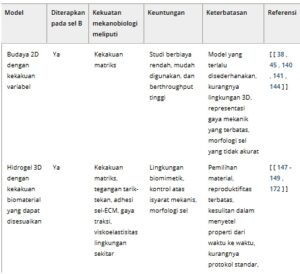
Plat kultur 2D dengan PDMS/agarose fungsional
Satu sistem yang mapan melibatkan perancangan kultur 2D di mana sel-sel melekat pada lapisan PDMS, yang difungsionalkan untuk menunjukkan kekakuan yang berbeda. Secara mekanistis, PDMS yang difungsionalkan dihasilkan dengan mencampur agen basa berujung vinil dengan agen pengawet (metil hidrogen siloksan). Dengan memodulasi rasio antara komponen-komponen ini, dimungkinkan untuk memperoleh permukaan dengan nilai kekakuan yang berbeda [ [ 140 , 141 ] ]. Zeng et al . menggunakan sistem ini untuk menunjukkan bagaimana pengenalan antigen pada permukaan PDMS yang kaku memicu akumulasi molekul BCR dan pSyk di permukaan sel B [ [ 38 ] ].
Studi mekanobiologi lainnya telah memanfaatkan gel berbasis poliakrilamid (PA), yang dibentuk oleh polimerisasi pengikat silang Bis-akrilat dan monomer akrilat [ [ 142 , 143 ] ]. Dengan menggunakan metode ini, Shaheen et al . menyelidiki bagaimana kekakuan substrat mempengaruhi aktivasi sel B. Dengan menggunakan substrat berbasis PA buatan berlabel antigen, mereka menunjukkan bahwa kekakuan substrat mempengaruhi aktivasi sel B melalui modulasi protein kinase C-β dan FAK [ [ 45 ] ]. Sementara model-model ini menyediakan alat yang mudah digunakan untuk mengeksplorasi regulasi mekanis perilaku sel, mereka tidak memiliki kompleksitas 3D dan mikroarsitektur dari lingkungan jaringan asli [ [ 144 ] ].
Hidrogel 3D dengan kekakuan biomaterial yang dapat disesuaikan
Sistem ini menggunakan hidrogel 3D dengan kekakuan biomaterial yang dapat disesuaikan, yang memungkinkan sel berinteraksi satu sama lain dan lingkungannya dalam pengaturan yang relevan secara fisiologis. Lebih khusus lagi, platform ini dapat membantu meniru sifat biokimia dan fisik ECM asli yang diproduksi langsung oleh sel stroma di lingkungan mikro, suatu aspek yang tidak dapat diimplementasikan dalam sistem kultur 2D. Hidrogel ini dapat terdiri dari berbagai biomaterial, termasuk alginat, gelatin, fibroin sutra, dan polietilen glikol. Dengan menyesuaikan rasio komponen, viskositas, dan metode ikatan silang, hidrogel yang kompatibel dengan sel dengan kekakuan yang disesuaikan dapat diproduksi [ [ 145 , 146 ] ]. Sistem ini digunakan oleh Zhong et al . untuk menghasilkan hidrogel 3D bermuatan sel yang meniru lingkungan mikro limfoid. Menggunakan hidrogel sintetis yang difungsionalkan dengan peptida perekat dan menunjukkan kekakuan seperti organ limfoid, mereka membungkus organoid yang berasal dari sel mononuklear darah tepi. Dengan melakukan hal ini, para peneliti menemukan bahwa sel B membentuk pusat germinal yang terkompartemen dan menunjukkan pola pemrograman ulang sel B, termasuk hipermutasi somatik dan peristiwa rekombinasi pergantian kelas, yang memungkinkan pengujian respons sel B terhadap terapi limfoma [ [ 147 ] ].
Dalam studi serupa, sel B dimasukkan ke dalam hidrogel sintetis yang dilengkapi dengan komponen yang berasal dari lingkungan mikro. Dibandingkan dengan model kultur 2D konvensional, pendekatan ini menghasilkan peningkatan kelangsungan hidup sel B, peningkatan diferensiasi sel plasma, dan produksi antibodi afinitas tinggi [ [ 148 ] ]. Model-model ini sekarang digunakan secara luas karena efektivitas biayanya dibandingkan dengan model hewan dan kemampuannya untuk meniru lingkungan mikro dan isyarat mekanis yang memengaruhi perilaku sel dengan lebih baik [ [ 149 ] ]. Meskipun demikian, platform ini sulit untuk dibuat, dan strategi pembacaan memerlukan pengoptimalan lebih lanjut.
Perangkat mikrofluida dan bioreaktor
Platform in vitro lain untuk mempelajari mekanobiologi melibatkan penggunaan bioreaktor dan perangkat mikrofluida [ [ 150 – 153 ] ]. Sistem ini memungkinkan penyelidikan tegangan geser dengan menghubungkan ke pompa untuk menghasilkan aliran [ [ 154 ] ] dan efek tekanan cairan interstisial [ [ 155 ] ], menyerupai yang dialami oleh sel-sel dalam pembuluh darah dan limfatik. Selain itu, platform ini memungkinkan mempelajari dampak gradien kekakuan [ [ 156 , 157 ] ] dan pengurungan seluler [ [ 158 ] ] yang dialami oleh sel-sel selama migrasi transendotelial atau dalam jaringan. Kekuatan-kekuatan ini sangat penting dalam konteks resirkulasi limfosit [ [ 7 ] ].
Mikrokanal telah banyak digunakan untuk mempelajari migrasi sel [ [ 159 ] ] dan deformasi [ [ 160 ] ] pada resolusi sel tunggal. Misalnya, dalam sebuah penelitian pada sel T, peneliti menggunakan perangkat mikrofluida dengan konstriksi tetap 3 μm untuk memeriksa deformasi sel dan nuklir selama migrasi transendotel. Mereka mengidentifikasi protein seperti formin 1 sebagai promotor utama migrasi sel T dan penekanan nuklir [ [ 161 ] ]. Dalam penelitian lain, peneliti mengoptimalkan pengikatan limfosit B pada lapisan PDMS fungsional di dalam ruang mikrofluida. Sistem ini memungkinkan penyelidikan efek gaya geser pada viabilitas sel B dan modifikasi fenotipik [ [ 162 ] ]. Selain keuntungan besar dari teknologi ini dalam membantu menguraikan hasil stimulasi mekanis, beberapa keterbatasan harus dipertimbangkan. Sebagian besar perangkat mikrofluida saat ini adalah sistem buatan sendiri, tidak memenuhi kebutuhan platform standar untuk menerjemahkan temuan ke dalam praktik klinis. Selain itu, sejalan dengan bagian sebelumnya, strategi pembacaan harus dioptimalkan dan disesuaikan dengan sistem yang digunakan [ [ 163 ] ].
Sistem kurungan sel
Sistem kurungan sel merupakan teknologi berharga lainnya untuk studi mekanobiologi kompleks, dan beberapa sistem telah dikembangkan untuk menyelidiki bagaimana penyempitan spasial memengaruhi perilaku seluler [ [ 164 , 165 ] ]. Secara mekanistis, sistem ini mengurung sel di antara dua permukaan kaca paralel pada ketinggian yang ditentukan, dikontrol oleh sistem berbasis mikropilar, yang biasanya terdiri dari PDMS atau agarosa pada slide kaca [ [ 158 , 166 ] ]. Platform ini sangat relevan dengan mekanobiologi limfosit, karena memungkinkan peneliti untuk meniru lingkungan lokal terbatas yang ditemui limfosit selama migrasi. Selain itu, sistem ini dapat diintegrasikan dengan platform lain di mana laju adhesi sel dapat disetel dengan memfungsikan substrat adhesi [ [ 165 ] ]. Sementara pendekatan ini menawarkan alat yang menarik untuk mempelajari adaptasi limfosit terhadap ruang terbatas, beberapa studi telah mengeksplorasi penerapannya dalam sel B dan T, terutama karena keterbatasan teknis, kompleksitas dalam desain eksperimental karena plastisitas sel B dan T, dan perilaku adhesi yang rendah, serta kurangnya protokol standar. Satu studi penting oleh Caillier et al . meneliti migrasi sel T primer dalam sistem pengurungan berbasis PDMS. Temuan mereka menunjukkan bahwa sel T membutuhkan adhesi fokal yang kecil dan dinamis untuk bergerak secara efisien melalui ruang terbatas [ [ 10 ] ]. Čada et al . menggunakan sistem berbasis agarosa untuk mengurung sel B dan menyelidiki migrasi seperti amoeboid mereka menggunakan teknik pencitraan sel hidup, membedah peran penghambatan kasein kinase 1 (CK1) dalam gangguan migrasi sel B [ [ 54 ] ].
Implikasi mekanobiologi pada respons sel kanker hematologi terhadap obat
Kanker secara tradisional dianggap sebagai penyakit yang terutama didorong oleh perubahan genetik yang memengaruhi proliferasi, diferensiasi, dan kematian sel [ [ 167 ] ]. Namun, kemajuan dalam pendekatan pengukuran dan model in vitro sejak itu telah mengklarifikasi bahwa sel kanker mengalami dan memanfaatkan isyarat mekanis yang berubah. Memang, tumor menunjukkan kekakuan yang tidak normal, permeabilitas pembuluh darah yang terganggu, dan tekanan cairan yang berubah, yang semuanya memodifikasi lingkungan mikro tumor. Saat tumor tumbuh, perubahan dalam arsitektur jaringan mengganggu homeostasis, memfasilitasi perkembangan penyakit [ [ 168 ] ]. Di bagian ini, kami mengeksplorasi interaksi antara gaya mekanis dan proses biologis dalam kanker hematologi, dengan fokus khusus pada pengaruhnya terhadap perilaku sel kanker dan hasil pengobatan [ [ 169 ] ].
Mekanotransduksi dan resistensi obat
Interaksi antara tumor dan lingkungan sekitarnya telah diidentifikasi sebagai penentu utama resistensi obat [ [ 143 ] ]. Misalnya, Apoorva et al . menempatkan sel DLBCL di dalam platform mikro-reaktor dengan distribusi aliran fluida yang seragam, yang memaparkan semua sel pada gaya biofisik yang sama. Studi mereka menunjukkan bahwa perubahan tegangan geser dan transportasi nutrisi, didorong oleh peningkatan vaskularisasi pada limfoma, meningkatkan proliferasi sel B, peningkatan regulasi sinyal SYK, dan modulasi integrin dan BCR. Secara khusus, mereka mengamati bagaimana tegangan geser fluida dapat bertindak sebagai stimulus biofisik penting dengan konsekuensi langsung pada onset DLBCL, perkembangan, dan respons terapeutik [ [ 19 ] ].
Meskipun wawasan ini, pengetahuan tentang sifat mekanis kanker hematologi masih terbatas. Sementara sudah mapan bahwa sel-sel ganas hematologi yang bersirkulasi dan menyusup terpapar pada berbagai rangsangan mekanis dari lingkungan eksternal mereka (Gbr. 1 ), peran perubahan mekanis ini dalam perkembangan tumor dan resistensi obat masih kurang dipahami [ [ 170 ] ]. Misalnya, sebuah penelitian pada sel-sel myeloma menemukan bahwa sel-sel yang melekat pada permukaan yang dilapisi fibronektin secara signifikan lebih resisten terhadap apoptosis setelah kemoterapi standar daripada sel-sel dalam suspensi. Selain itu, penulis mengamati korelasi antara ekspresi integrin ɑ4 dan resistensi doksorubisin, sehingga menghipotesiskan fenomena resistensi obat yang dimediasi adhesi sel (CAM-DR). Namun demikian, mekanisme pasti yang terlibat dalam sinyal pro-survival ini belum dijelaskan [ [ 171 ] ]. Menggunakan model berbasis hidrogel 3D, kelompok lain menunjukkan bahwa kekakuan matriks memengaruhi proliferasi dan respons obat pada subtipe sel leukemia myeloid akut (AML) tertentu [ [ 172 ] ].
Selain itu, sifat mekanik intraseluler, terutama kekakuan dan viskoelastisitas, diketahui mempengaruhi perilaku sel leukemia [ [ 7 ] ]. Kami baru-baru ini menunjukkan bahwa sel CLL menunjukkan kompleks aktomiosin yang kurang kontraktil dan kekakuan yang berkurang dibandingkan dengan sel B yang sehat. Dengan mengobati sel dengan penghambat tirosin kinase Bruton, obat utama yang digunakan dalam pengobatan CLL, seperti ibrutinib, kami mengamati pemulihan sebagian organisasi kompleks aktomiosin dan kekakuan, menyerupai sel B yang sehat, baik in vitro maupun in vivo . Temuan ini menunjukkan bahwa kekakuan kortikal adalah target ibrutinib dan mungkin terlibat dalam kemungkinan mekanisme resistensi obat [ [ 11 ] ].
Demikian pula, sebuah studi oleh Lam Wilbur et al . menunjukkan bahwa sel leukemia limfoblastik akut (ALL) dan AML menunjukkan peningkatan kekakuan sel sebesar dua kali lipat setelah kemoterapi standar, yang mengganggu kemampuan mereka untuk melewati saluran mikrofluida [ [ 173 ] ]. Yang lain juga melaporkan bahwa sel kanker menunjukkan sifat mekanik yang berubah dibandingkan dengan sel sehat. Pada sel hematopoietik CD34 + yang diisolasi dari donor sehat dan pasien leukemia, peneliti mengamati bahwa sel CD34 + kanker menjadi lebih kaku dan mengalami kegagalan getas ketika terkena gaya eksternal, sedangkan sel CD34 + yang sehat mempertahankan integritas strukturalnya [ [ 174 ] ]. Selain itu, sebuah studi sel tunggal mikrofluida pada sel ALL yang diobati dengan kemoterapi standar selama 7 hari menemukan bahwa sel yang diobati menunjukkan peningkatan deformabilitas, yang selanjutnya mendukung hubungan antara mekanika sel dan respons pengobatan [ [ 175 ] ].
Pengatur molekuler mekanika sel kanker
Studi terbaru telah mengimplikasikan deregulasi protein dan jalur spesifik yang mengatur respons sel kanker terhadap stres mekanis [ [ 176 ] ]. Satu jalur yang mapan dalam konteks ini adalah jalur pensinyalan Hippo. Sebuah studi tahun 2018 yang mengevaluasi ekspresi gen jalur pensinyalan Hippo mengungkapkan bahwa TAZ dideregulasi pada pasien dengan leukemia myeloid kronis (CML) yang refrakter terhadap inhibitor tirosin kinase (TKI) imatinib [ [ 177 ] ] . Yang lain telah menunjukkan bahwa knockdown YAP1 mengganggu proliferasi sel leukemia dan mengaktifkan jalur apoptosis pada lini sel CML dan sel leukemia Jurkat. Selain itu, deregulasi YAP1 dalam CML dikaitkan dengan peningkatan efikasi TKI in vitro [ [ 178 , 179 ] ]. Menariknya, YAP1 telah diidentifikasi sebagai gen penekan tumor pada kanker hematologi, di mana ia lebih disukai dinonaktifkan, menunjukkan bahwa memulihkan fungsi YAP1 dapat mewakili strategi terapi baru [ [ 180 ] ]. Sampai saat ini, peran YAP1 dalam keganasan sel B telah dibatasi pada beberapa penelitian. Dengan memeriksa ekspresi YAP1 dalam kumpulan data publik, Zhou dan rekannya menghubungkan ekspresinya dengan perkembangan penyakit dan prognosis yang buruk pada pasien dengan DLBCL. Selain itu, knockdown YAP1 dengan bantuan CRISPR/Cas9 ditemukan menimbulkan efek antitumor dengan mengatur siklus sel, baik secara in vitro atau in vivo [ [ 181 ] ]. Dalam penelitian serupa, para peneliti memeriksa ekspresi YAP1 dalam lini sel B-ALL dan menemukan bahwa peningkatan regulasi YAP1 dan tingkat fosforilasi yang rendah dikaitkan dengan hasil yang lebih buruk, sejalan dengan temuan sebelumnya. Selain itu, mereka mengamati bahwa knockdown YAP1 menghambat proliferasi sel, dengan demikian mengonfirmasi perannya sebagai onkogen potensial. Selain itu, mereka mengidentifikasi LATS1—large tumor suppressor kinase—sebagai penghambat potensial fosforilasi YAP1, yang menunjukkan bahwa penargetan jalur ini dengan verteporfin dapat meningkatkan prognosis pasien B–ALL [ [ 182 ] ].
Di luar pensinyalan Hippo, studi terbaru menunjukkan bahwa deregulasi lamin dapat memengaruhi perkembangan leukemia sel B [ [ 183 ] ]. Telah diusulkan bahwa LMNB1 memberikan fungsi protektif, mencegah aberasi kromosom selama evolusi klonal pada CLL [ [ 16 ] ]. Secara khusus, pasien CLL dengan rantai IgHV yang bermutasi, yang berkorelasi dengan prognosis yang baik, menunjukkan peningkatan ekspresi LMNB1. Sebaliknya, pasien CLL dengan gen imunoglobulin yang tidak bermutasi, yang sangat terkait dengan kelainan sitogenetik dan prognosis yang buruk, menunjukkan penurunan ekspresi LMNB1 [ [ 16 ] ]. Selain itu, hipermetilasi CpG dalam promotor LMNA , yang membungkam ekspresi LMNA/C, ditemukan sebagai prediktor hasil yang buruk pada pasien dengan limfoma sel B besar [ [ 184 ] ].
Sinyal kelangsungan hidup yang dimediasi integrin merupakan mekanisme kunci lain yang mendorong perkembangan keganasan sel B dan resistensi terapi [ [ 185 ] ]. Astier et al . menunjukkan bahwa stimulasi dengan protein yang berasal dari matriks ekstraseluler mengaktifkan integrin β1, yang mencegah aktivasi caspase-3 dan caspase-7, sehingga melindungi sel B-ALL dari apoptosis [ [ 186 ] ]. Demikian pula, penelitian lain menunjukkan bahwa kontak langsung antara sel CLL primer dan sel stroma yang berasal dari sumsum tulang meningkatkan kelangsungan hidup sel CLL dengan mencegah apoptosis [ [ 187 ] ].
Peran adhesi fokal dalam perkembangan leukemia juga telah mendapatkan perhatian yang semakin meningkat. Sebuah studi oleh Sonoda et al . menunjukkan bahwa ekspresi berlebihan FAK dalam garis sel leukemia HL-60 meningkatkan resistensi apoptosis dengan mengaktifkan jalur PI3K/AKT dan NF-κB [ [ 188 ] ]. Pada tahun 2022, laboratorium kami mengidentifikasi peningkatan regulasi homolog FAK, tirosin kinase 2 kaya prolin (PYK2) dalam sel B ganas dari pasien CLL dibandingkan dengan sel B sehat. Khususnya, penurunan regulasi FAK secara bersamaan dikaitkan dengan transisi dari penyakit stabil ke fenotipe yang lebih agresif. Hasil ini menunjukkan bahwa FAK dan PYK2 dapat berfungsi sebagai target terapi potensial dalam CLL, menawarkan strategi baru yang bertujuan untuk memodulasi sifat mekanis sel kanker dan lingkungan mikronya [ [ 189 ] ]. Sesuai dengan hal ini, defactinib, penghambat FAK, telah muncul sebagai terapi antikanker yang menjanjikan untuk berbagai tumor padat [ [ 190 ] ].
Bidang minat terakhir yang muncul adalah peran miosin dalam migrasi sel leukemia. Sebuah studi yang berfokus pada penyebaran dan kekambuhan ALL, yang biasanya dikaitkan dengan prognosis yang buruk, mengidentifikasi MYH9 sebagai kemungkinan promotor. Dengan menyuntikkan sel ALL yang di-knock down (KD) untuk MYH9 ke tikus, mereka mengamati tingkat perkembangan leukemia yang lebih lambat dan kelangsungan hidup yang lebih lama. Ini merupakan hasil dari gangguan pencangkokan leukemia, terutama pada tingkat sistem saraf pusat. Studi ini menunjukkan bahwa efek ini mungkin berkorelasi dengan kemampuan migrasi yang terganggu dan proses migrasi transendotel yang tidak efisien pada sel ALL MYH9 KD, yang menunjukkan MYH9 sebagai target terapi potensial untuk mencegah penyebaran ALL [ [ 191 ] ]. Studi lain menunjukkan peran potensial subtipe miosin dalam mempromosikan mobilisasi sel leukemia, baik dalam garis sel yang berasal dari sel T atau B; dengan demikian menyoroti potensi terapeutik dari kelas molekul ini dalam mengganggu kapasitas migrasi sel leukemia [ [ 192 ] ]. Baru-baru ini, studi lain pada pasien ALL mengorelasikan tingkat ekspresi MYO1G—miosin kelas I yang terlibat dalam ketegangan membran dan pengaturan kecepatan sel—dengan diagnosis dan hasil pengobatan pasien. Secara khusus, para peneliti mengamati peningkatan ekspresi pada pasien dengan perubahan genomik spesifik dan mereka yang kambuh setelah pengobatan. Ini menunjukkan bahwa MYO1G mungkin berkontribusi pada perkembangan ALL dan sifat klinis pasien, yang berpotensi relevan untuk meningkatkan stratifikasi pasien saat diagnosis [ [ 193 ] ].
Kesimpulan dan perspektif
Dalam tinjauan ini, kami telah menyoroti peran mendasar mekanobiologi dalam membentuk perilaku sel B, dari penginderaan dan aktivasi antigen hingga migrasi dan kelangsungan hidup, baik dalam konteks sehat maupun ganas. Selain itu, kami telah mengeksplorasi teknologi baru dan pendekatan eksperimental yang memungkinkan studi mekanika seluler, memberikan wawasan baru tentang fungsi sel B dan perkembangan penyakit. Namun, penting untuk dicatat bahwa beberapa aspek mekanobiologi sel B masih belum dieksplorasi. Seperti yang telah disebutkan, sebagian besar penelitian tentang mekanobiologi limfosit belum dilakukan pada sel B. Hal ini kemungkinan besar disebabkan oleh keterbatasan teknis yang terkait dengan fakta bahwa sel B tumbuh dalam suspensi dalam kultur, ukurannya yang kecil, plastisitas, dan pergerakan berkecepatan tinggi, yang membatasi pengukuran dan karakterisasi sifat mekanisnya.
Akibatnya, dari perspektif mekanotransduksi, peran pasti BCR sebagai molekul mekanosensori masih belum jelas, dan data tentang molekul mekanosensori lainnya, seperti saluran kationik PIEZO, terbatas. Mengingat bahwa BCR adalah reseptor utama yang terlibat dalam aktivasi dan fungsi sel B, kesenjangan pengetahuan ini mengganggu pemahaman tentang regulasi sel B, yang dapat memengaruhi pemahaman patofisiologi keganasan sel B dan desain terapi. Mengenai sitoskeleton, lebih banyak informasi tersedia, khususnya mengenai pembentukan IS; namun, sebagian besar penelitian tentang migrasi leukosit interstisial dalam lingkungan 3D, khususnya peralihan antara berbagai mode migrasi, telah difokuskan pada sel-sel migrasi amoeboid lainnya.
Kini, mekanisme ini harus divalidasi dalam sel B untuk pemahaman yang lebih baik tentang mekanisme perdagangan sel B baik dalam keadaan sehat maupun sakit. Dalam nukleus, hanya sedikit penelitian yang mengeksplorasi struktur NSK sel B dan organisasi lamin. Hal yang sama berlaku untuk protein pengangkut nuklir seperti YAP1/TAZ, serta peran pengukur mekanis nukleus, yang terutama telah diselidiki dalam sel T dan sel dendritik. Mengingat plastisitas sel B yang tinggi, kita akan mengharapkan nukleus, organel paling kaku dalam sel, untuk dengan cepat mengatur ulang struktur dan organisasinya, yang memungkinkan sel untuk berubah bentuk bahkan di hadapan penyempitan yang sangat kecil sambil mempertahankan integritas isi nukleus. Lebih jauh, konfigurasi yang mengutamakan nuklir menunjukkan bahwa nukleus bertindak sebagai navigator, yang memandu sel melalui kompartemen tubuh. Jika temuan ini dikonfirmasi untuk sel B, itu akan menyoroti kesenjangan pengetahuan penting mengenai nukleusnya, yang perlu diisi untuk memahami mekanisme respons imun dan penyebaran sel B ganas.
Berbagai teknologi yang telah kita bahas dapat membantu mengatasi keterbatasan ini, membuka jalan bagi penemuan baru dalam mekanobiologi sel B, baik dalam keadaan sehat maupun ganas. Memahami aspek mekanobiologi responsivitas obat dalam sel B ganas dapat membuka jalan terapeutik baru.
Secara langsung menargetkan sifat mekanik, misalnya, dengan menggunakan obat yang mengubah sitoskeleton atau mengganggu pensinyalan yang dimediasi integrin, dapat menghambat pertumbuhan dan perkembangan tumor [ [ 170 ] ]. Misalnya, dasatinib, penghambat tirosin kinase BCR-ABL1, adalah terapi yang disetujui untuk pengobatan pasien dengan leukemia myeloid kronis fase kronis dan lanjut [ [ 194 ] ]. Selain itu, defactinib, penghambat FAK, dapat mendukung hasil pasien dalam kombinasi dengan obat lain [ [ 195 ] ]. Selain itu, menggabungkan kemoterapi tradisional dengan agen yang menargetkan jalur mekanobiologis, terutama pada pasien dengan tumor resisten, dapat meningkatkan efektivitas obat dan pengiriman ke lokasi target. Misalnya, sebuah studi baru-baru ini pada tumor padat yang berbeda menghubungkan sifat mekanik dengan ECM tumor dan kemampuan infiltrasi sel T in vivo . Dengan menghambat lysil oksidase—enzim yang sering meningkat pada tumor dan terlibat dalam organisasi kolagen—mereka memodulasi ECM secara mekanis, meningkatkan mobilitas sel T dalam tumor dan menunda perkembangan tumor [ [ 196 , 197 ] ]. Namun, menerjemahkan pengetahuan mekanobiologi fundamental ke dalam praktik klinis masih sulit. Salah satu tantangan utama adalah pengembangan model eksperimental canggih yang dapat secara akurat mereplikasi mekanika lingkungan mikro tumor. Seperti yang telah kami soroti, sekarang ada banyak sekali teknik pengukuran, metode pencitraan, dan model in vitro yang tersedia yang memungkinkan penilaian biomekanik tumor yang dipersonalisasi. Kami berharap bahwa dalam beberapa tahun mendatang, penelitian akan mengadaptasi aplikasinya ke pengaturan yang berbeda, termasuk kemungkinan untuk mengintegrasikan teknik pengukuran yang tersedia dengan sistem in vitro untuk mengkarakterisasi mekanika tumor dengan cara yang lebih canggih, sambil mereproduksi pengaturan lingkungan mikro yang relevan. Tantangan utama kedua adalah kebutuhan untuk mengembangkan pendekatan terapeutik yang sangat selektif sambil menilai risiko efek samping terkait dengan hati-hati. Secara khusus, transisi dari bangku ke tempat tidur pasien memerlukan pemahaman terperinci tentang deregulasi mekanis yang mendasari inisiasi tumor, untuk memahami bagaimana tumor dapat memodulasi mekanikanya dan siapa saja yang terlibat. Hal ini sangat penting karena perubahan dalam lingkungan mikro fisik juga dapat mengganggu mekanobiologi sel-sel sehat, yang berpotensi menyebabkan efek samping yang tidak diinginkan [ [ 198 ] ].
Singkatnya, bidang mekanobiologi yang sedang berkembang menjanjikan pengembangan terapi yang disesuaikan, yang pada akhirnya meningkatkan manajemen pasien dan hasil pengobatan.
Kami optimis bahwa kemajuan di masa mendatang dalam mekanobiologi sel B akan memberikan wawasan berharga untuk lebih memahami mekanisme pergerakan dan adaptasi sel B, khususnya dalam konteks kanker hematologi. Penemuan semacam itu dapat mengungkap peluang baru untuk mengidentifikasi dan menargetkan pemain molekuler baru. Namun, untuk sepenuhnya mewujudkan kemajuan ini, pengembangan protokol dan pendekatan baru yang disesuaikan untuk sel yang tidak melekat, seperti sel B, akan sangat penting.
Kami menekankan perlunya penting untuk penyelidikan lebih lanjut terhadap mekanobiologi sel B, yang kami yakini memiliki potensi signifikan untuk memajukan pemahaman kita tentang penyakit hematologi terkait sel B.
