Abstrak
Sistem translasi mitokondria mengandung dua faktor penyelamatan ribosom, ICT1 dan MTRFR (C12orf65), yang menghidrolisis peptidil-tRNA pada ribosom yang terhenti. ICT1 juga berfungsi sebagai protein ribosom dari subunit ribosom besar mitokondria (mtLSU) pada tikus dan manusia, dan penghapusannya bersifat mematikan. Sebaliknya, MTRFR tidak memiliki peran ini. Meskipun mutasi kehilangan fungsi pada MTRFR telah dikaitkan dengan penyakit mitokondria manusia, data tentang hubungan ini pada vertebrata lain tidak ada. Di sini, upaya untuk menghasilkan tikus knockout Mtrfr tidak berhasil. Namun, garis zebrafish knockout berhasil dihasilkan untuk ict1 dan mtrfr ( ict1 −/− dan mtrfr −/− ). Kedua garis knockout tampak sehat dan subur. ict1 −/− , mtrfr −/− , dan sel sirip ekor dewasa tipe liar menunjukkan perbedaan signifikan dalam morfologi mitokondria. Penghapusan ict1 memengaruhi sifat jaringan lebih dari jumlah individu dan jaringan, sedangkan penghapusan mtrfr menunjukkan efek sebaliknya. Selain itu, tingkat kelangsungan hidup larva garis knockout secara signifikan lebih rendah daripada larva tipe liar dalam kondisi kelaparan. Hasil ini menunjukkan bahwa ict1 dan mtrfr diperlukan untuk bertahan hidup dalam kondisi stres tertentu, sedangkan ict1 −/− dan mtrfr −/− melibatkan mekanisme kompensasi yang berbeda dalam menanggapi hilangnya salah satu faktor dalam kondisi tanpa stres. Protein Ict1 dari semua teleost, termasuk ikan zebra, tidak memiliki motif pengikat mtLSU N-terminal yang ditemukan di sebagian besar metazoa, yang menunjukkan bahwa Ict1 tidak berfungsi sebagai protein ribosom pada teleost. Dengan demikian, Mtrfr dapat mengkompensasi sebagian hilangnya Ict1. Sebagai kesimpulan, ikan zebra tampaknya merupakan contoh kategori terbatas vertebrata yang mampu bertahan terhadap kelainan genetik pada ict1 atau mtrfr .
Singkatan
Penyakit paru obstruktif kronis (COXPD7)
defisiensi fosforilasi oksidatif gabungan-7
CRISPR/Cas9
pengelompokan pengulangan palindromik yang berjarak teratur/protein terkait CRISPR 9
kriogenik-EM
mikroskopi kriogenik elektron
dpf
hari pasca pembuahan
Universitas Negeri Moskow
subunit ribosom besar mitokondria
OKSFO
fosforilasi oksidatif
Mitokondria memiliki sistem transkripsi dan translasi yang unik untuk genom atau DNA mitokondria (mtDNA) yang mengkodekan sejumlah gen yang terbatas (13 protein, 2 rRNA, dan 22 tRNA pada manusia, tikus, dan ikan zebra) [ [ 1 , 2 ] ]. Ribosom yang menerjemahkan terhenti pada mRNA karena berbagai alasan terlepas dari spesies atau organel. Sebuah studi sebelumnya menggunakan analisis sekuensing mendalam menyelidiki sumber mRNA yang tidak memiliki kodon stop (mRNA nonstop) yang dihasilkan dari genom mitokondria manusia dan mengungkapkan bahwa beberapa mRNA nonstop, dengan proses produksi yang berbeda, terjadi pada sel dan jaringan yang sehat [ [ 3 ] ]. Temuan ini menunjukkan bahwa ribosom mitokondria (mitoribosom) di ujung 3′ mRNA nonstop adalah umum. Ribosom ini secara signifikan memengaruhi efisiensi daur ulang ribosom dan, akibatnya, efisiensi atau keluaran translasi (hasil), yang pada akhirnya dapat berakibat fatal bagi sel [ [ 4 ] ]. Dalam mitokondria, terlepas dari spesies eukariotik, sistem translasi spesifik terdiri dari dua faktor penyelamat mitoribosom, ICT1 dan C12orf65 (berganti nama menjadi MTRFR, seperti yang dijelaskan kemudian). Faktor-faktor ini homolog karena berfungsi sebagai hidrolase peptidil-tRNA, dengan residu motif Gly-Gly-Gln (GGQ) yang berfungsi sebagai tempat katalitik [ [ 5 – 8 ] ]. Mengikuti domain yang mengandung GGQ terstruktur (domain GGQ), kedua protein tersebut menampilkan ekstensi C-terminal yang tidak terstruktur dalam bentuk bebas, yang berbeda dalam urutan antara kedua faktor dan memainkan peran kunci dalam fungsi masing-masing [ [ 7 , 8 ] ]. Khususnya, domain GGQ dari faktor penyelamat menunjukkan homologi satu sama lain dan dengan domain katalitik (domain 3) dari faktor pelepasan tipe bakteri (RF) (RF1 dan RF2 pada bakteri; mtRF1a dan mtRF dalam mitokondria). Hal ini menunjukkan bahwa ICT1, C12orf65, dan RF tipe bakteri berevolusi dari nenek moyang yang sama dan selanjutnya memperoleh peran yang berbeda [ [ 9 ] ]. Fungsi khusus ICT1 dan C12orf65 yang dijelaskan hingga saat ini, bersama dengan poin-poin yang belum terselesaikan, diuraikan di bawah ini.
ICT1 pertama kali diidentifikasi sebagai faktor penyelamat mitoribosom [ [ 5 ] ]. Banyak bakteri, meskipun tidak semuanya, mengandung ortolog ICT1 yang dikenal sebagai ArfB (YaeJ) [ [ 5 , 7 , 10 – 12 ] ]. ICT1/ArfB pada dasarnya memasuki situs-A ribosom yang terhenti yang disebabkan oleh mRNA yang tidak berhenti dan menghidrolisis peptidil-tRNA di situs-P. Aktivitas ini memungkinkan pelepasan ribosom yang terhenti, memfasilitasi daur ulang ribosom. Menurut studi struktural ArfB dan ICT1 [ [ 13 , 14 ] ], ketika ICT1/ArfB mengikat ribosom yang terhenti yang disebabkan oleh mRNA yang tidak berhenti, daerah heliks dibentuk oleh bagian dari ekstensi C-terminal ICT1/ArfB, yang terletak di saluran masuk mRNA hilir dari situs-A yang kosong di subunit 30S. Residu yang terlibat dalam pengikatan spesifik ke saluran masuk mRNA sangat terkonservasi di seluruh protein ICT1 dan ArfB dari berbagai spesies [ [ 8 ] ]. Dengan demikian, ekstensi C-terminal dianggap sebagai sensor untuk membedakan antara ribosom yang macet dan yang sedang aktif menerjemahkan. Domain GGQ diposisikan di situs A, mirip dengan RF, dengan residu motif GGQ terletak di pusat peptidiltransferase dari subunit ribosom besar. Posisi ini memungkinkan peptidil-tRNA di situs P untuk dihidrolisis.
Yang perlu diperhatikan, ICT1 memiliki fungsi ganda karena ia juga berfungsi sebagai komponen integral dari subunit ribosom besar dari mitoribosom mamalia (mtLSU), yang juga disebut mL62 (MRPL58) berdasarkan nomenklatur protein ribosom [ [ 5 , 15 ] ]. Protein ICT1 yang terikat pada mtLSU menghubungkan tonjolan sentral, yang komponen-komponennya spesifik untuk mitokondria, ke badan utama mitoribosom, yang berkontribusi pada stabilisasi struktural mtLSU, dan akibatnya, seluruh mitoribosom [ [ 16 ] ]. Fungsi ganda yang serupa telah diamati pada tRNA Val mitokondria , yang juga berfungsi sebagai konstituen rRNA tambahan yang dimasukkan ke dalam tonjolan sentral [ [ 16 , 17 ] ]. Selama evolusi cepat atau peningkatan divergensi mitoribosom, ketidakstabilan struktural putatif, seperti yang disebabkan oleh tidak adanya segmen rRNA mitokondria tertentu, sering dikompensasi oleh elemen yang sudah ada sebelumnya, sebuah fenomena yang dikenal sebagai penambalan struktural [ [ 18 ] ]. Setelah ICT1 terikat pada mitoribosom, ia tidak dapat dilepaskan dan tidak akan bertindak sebagai faktor penyelamat [ [ 10 ] ]. Apakah beberapa ICT1 bebas hadir dalam mitokondria, apakah ICT1 bebas diproduksi, misalnya, oleh mekanisme yang menghambat pengikatannya ke mitoribosom, atau apakah ICT1 bebas ada dalam cara yang bergantung pada sel atau jaringan, masih harus ditentukan.
ICT1 sangat penting untuk pemeliharaan sel, viabilitas sel, proliferasi, dan perkembangan. Pada sel kultur manusia, penipisan ICT1 menggunakan siRNA spesifik ICT1 secara signifikan mengurangi pertumbuhan dibandingkan dengan sel kontrol, menurunkan kadar sintesis protein mitokondria untuk 13 gen [ [ 5 , 7 ] ]. Mengingat kurangnya contoh mutasi ICT1 yang tercatat terkait dengan penyakit, mutasi yang menyebabkan hilangnya fungsi pada ICT1 akan berakibat fatal pada manusia. Sebuah studi komprehensif tentang protein ribosom mitokondria telah menunjukkan bahwa tikus knockout Ict1 secara embrionik mematikan [ [ 19 , 20 ] ]. Efek parah dari disfungsi ICT1 tersebut dapat dikaitkan dengan kombinasi hilangnya fungsinya sebagai protein ribosom dan sebagai faktor penyelamat. Studi lebih lanjut masih diperlukan untuk menjelaskan rincian kombinasi ini.
C12orf65, faktor penyelamatan kedua, dimulai dengan laporan yang menjelaskan bahwa mutasi kehilangan fungsi pada gen nuklir, MTRFR , dalam dua silsilah yang tidak terkait menyebabkan ensefalomiopati mitokondria [ [ 6 ] ]. Analisis fibroblas dari pasien menunjukkan bahwa penghapusan 1-bp pada MTRFR , yang mengakibatkan kodon stop prematur, mengganggu translasi mitokondria total untuk 13 gen. Hal ini menyebabkan penurunan yang signifikan pada tingkat kompleks fosforilasi oksidatif (OXPHOS) I, IV, dan V, dan penurunan yang lebih sederhana pada kompleks III. Berbeda dengan sel yang kekurangan ICT1, fibroblas pasien tidak menunjukkan efek buruk pada tingkat protein mitoribosomal kondisi mapan atau perakitan subunit mitoribosomal [ [ 6 , 21 ] ]. Dalam sel yang dikultur, knockdown C12orf65 yang dimediasi siRNA menghambat proliferasi sel, tetapi kurang dari knockdown ICT1 [ [ 8 ] ]. Beberapa penelitian telah menunjukkan bahwa gen MTRFR tunduk pada berbagai pola mutasi kehilangan fungsi yang terkait dengan penyakit [ [ 22 – 32 ] ]. Jika gen mutan diekspresikan, protein yang dihasilkan tidak lengkap atau tidak berfungsi, dengan panjang protein bervariasi berdasarkan mutasi spesifik [ [ 25 , 27 , 28 ] ]. Defisiensi MTRFR ditandai dengan berbagai macam fenotipe berdasarkan mutasi; tiga fitur klinis utama adalah atrofi optik, neuropati perifer, dan paraplegia spastik [ [ 30 ] ]. Fenotipe yang terkait dengan mutasi MTRFR disebut sebagai combined oxidative phosphorylation shortage-7 (COXPD7) atau autosomal recessive spastik paraplegia type 55 (SPG55); yang pertama digunakan sebagai sebutan untuk penyakit ini. COXPD7 biasanya bermanifestasi antara usia 3 dan 12 bulan dan, dalam kebanyakan kasus, mengakibatkan kematian antara masa kanak-kanak atau remaja, dengan beberapa pengecualian (51 atau 53 tahun) [ [ 25 , 27 , 28 ] ].
Kombinasi rekonstitusi biokimia dan cryo-EM menentukan peran MTRFR dalam penyelamatan ribosom dan menjelaskan mekanisme kerjanya [ [ 33 ] ]. Mitoribosom penerjemahan dibagi menjadi dua subunit mitoribosomal yang difasilitasi oleh faktor pembelahan ribosom spesifik, meskipun penyebab pasti dari pemisahan tersebut masih belum jelas. Bagian dari ekstensi C-terminal MTRFR mengikat kofaktor MTRES1 (C6orf203), dan kompleks MTRFR·MTRES1 memasuki situs A mtLSU untuk menghidrolisis peptidil-tRNA di situs P. Pada saat yang sama, MTRES1 berinteraksi dengan loop antikodon peptidil-tRNA. Temuan ini menunjukkan MTRFR sebagai faktor penyelamatan mitoribosom untuk mtLSU terbagi abnormal yang ditempati oleh peptidil-tRNA. Dengan demikian, C12orf65 dinamakan faktor pelepasan translasi mitokondria dalam penyelamatan, mtRF-R atau MTRFR [ [ 33 ] ]. Akan tetapi, sebuah studi baru-baru ini yang berfokus pada generasi intrinsik mRNA nonstop dalam mitokondria menunjukkan bahwa MTRFR penting untuk penyelamatan ribosom nonstop tetapi tidak untuk mtLSU yang terbelah [ [ 3 ] ]. Selain itu, tidak ada efek kompensasi ICT1 yang diamati pada fibroblas manusia yang kekurangan MTRFR . Target penyelamatan MTRFR belum sepenuhnya ditetapkan, sehingga membuat perbedaan antara MTRFR dan ICT1 dalam proses penyelamatan ribosom menjadi kurang jelas.
Pembuatan model vertebrata dengan disfungsi MTRFR akan membantu memfasilitasi penelitian dan pengembangan obat untuk penyakit genetik langka, seperti COXPD7. Sejauh pengetahuan kami, model vertebrata dengan COXPD7 masih kurang. Dalam penelitian ini, kami menghasilkan galur knockout ict1 dan mtrfr dari ikan zebra ( Danio rerio ) menggunakan sistem penyuntingan genom CRISPR/Cas9, meskipun kami tidak dapat menghasilkan tikus knockout Mtrfr ( Mus musculus ). Tanpa diduga, kedua galur knockout ikan zebra tampak sehat dan subur. Kami meneliti efek knockout masing-masing gen pada morfologi mitokondria, tingkat kematian, dan perilaku dalam berbagai kondisi stres untuk mengkarakterisasi kedua galur knockout tersebut. Selain itu, kami melakukan analisis perbandingan sekuens berbasis struktur dari protein Ict1 dari berbagai metazoa, yang mengungkapkan bahwa protein Ict1 teleost tidak memiliki motif pengikatan mtLSU. Temuan ini menunjukkan bahwa ikan zebra merupakan kategori vertebrata yang sangat terbatas yang galur knockout ict1 dan mtrfrnya dapat dihasilkan. Kami yakin bahwa garis keturunan zebrafish knockout ini memiliki potensi untuk digunakan sebagai moda untuk COXPD7, jika kondisi stresnya terkendali.
Bahan dan metode
Perawatan hewan
Semua percobaan tikus disetujui oleh Komite Perawatan dan Percobaan Hewan Universitas Gunma (Nomor Izin: 16-061) dan dilakukan sesuai dengan pedoman yang disetujui. Semua percobaan ikan zebra disetujui oleh Komite Perawatan dan Percobaan Hewan Universitas Gunma (23-019, 23-023) dan Komite Percobaan Hewan dan Komite Keselamatan Percobaan Modifikasi Gen Universitas Osaka (04294 dan FBS-14-002-1). Ikan zebra dipelihara dalam kondisi standar 28 °C dan siklus terang/gelap 14/10 jam. Bila perlu, tikus dieutanasia dengan dislokasi serviks yang dilakukan oleh personel dengan kecakapan teknis yang terbukti, dan ikan zebra dieutanasia dengan perendaman dalam overdosis tricaine methane sulfonate.
Pembuatan tikus knockout MTRFR menggunakan sistem CRISPR/Cas9
Tikus C57BL/6J dan ICR dibeli dari Charles River, Jepang. Tikus betina C57BL/6J berusia 5 minggu disuperovulasi dengan memberikan 7,5 unit serum gonadotropin kuda betina hamil (PMSG; ASKA Animal Health, Tokyo, Jepang), diikuti oleh 7,5 unit human chorionic gonadotrophin (hCG; ASKA Animal Health) 48 jam kemudian. Tikus betina dikawinkan semalaman dengan tikus jantan C57BL/6J. Keesokan harinya, sel telur yang telah dibuahi dikumpulkan dari saluran telur. Pengeditan genom dilakukan seperti yang dijelaskan sebelumnya [ [ 34 ] ]. Urutan target crRNA (5′-GCCTCCCTCTACCACTGATC-3′) diperoleh menggunakan layanan web CRISPRdirect [ [ 35 ] ]. Volume yang sama dari crRNA (100 μ m ; IDT, Coralville, IA, AS) dan trans -activating crRNA (tracrRNA) (100 μ m ; IDT) digabungkan dalam buffer dupleks (IDT), dipanaskan dalam thermal cycler hingga 95 °C selama 5 menit, dan diinkubasi selama 10 menit pada suhu kamar sesuai dengan protokol pabrik. Gabungan crRNA/tracrRNA (50 ng·μL −1 ) dan protein Cas9 rekombinan (40 ng·μL −1 ; GeneArt Platinum Cas9 Nuclease, Thermo Fisher Scientific, Waltham, MA, AS) disuntikkan ke dalam sitoplasma telur yang telah dibuahi. Embrio yang disuntikkan dikultur dalam medium M16 pada suhu 37 °C di bawah 5% CO 2 di udara. Keesokan harinya, 74 embrio yang berkembang ke tahap 2 sel dipindahkan ke ampula saluran telur betina ICR yang sedang hamil semu. Genotipe dari 19 anakan dikonfirmasi menggunakan reaksi berantai polimerase (PCR), diikuti oleh kloning dan sekuensing TA. Urutan primer tercantum dalam Tabel S1 .
Pembuatan garis keturunan zebrafish knockout ict1 dan mtrfr menggunakan sistem CRISPR/Cas9
Garis knockout ict1 dan mtrfr zebrafish dihasilkan menggunakan sistem penyuntingan genom CRISPR/Cas9 [ [ 36 ] ]. Urutan target ( ict1 : 5′-GGAATAACGGCGCTCAGCAG-3′, mtrfr : 5′-GTTCGCGGATCTGGACCTGG-3′) diperoleh menggunakan layanan web ZiFit [ [ 37 ] ] dan CRISPRdirect [ [ 35 ] ]. Fragmen DNA templat disiapkan menggunakan PCR, dan sgRNA disintesis dan dimurnikan menggunakan Kit Transkripsi T7 in vitro (Takara, Kusatsu, Jepang) mengikuti protokol pabrik. Sebanyak 1–2 nL larutan injeksi [100 ng·μL −1 sgRNA, 250 ng·μL −1 protein Cas9 (New England Biolabs, Ipswich, MA, AS), dan 0,01% pewarna hijau cepat] disuntikkan ke dalam telur ikan zebra yang telah dibuahi pada tahap satu sel. Ikan chimeric generasi F 0 yang disuntik disilangkan dengan ikan tipe liar untuk menghasilkan kumpulan ikan generasi F 1 . Ikan F 1 dengan mutasi pada situs target disilangkan dengan tipe liar untuk menghasilkan kumpulan ikan generasi F 2 . Urutan situs target ikan generasi F 2 ditentukan, dan, sebagai hasilnya, satu galur mutan loss-of-function heterozigot ict1 dan mtrfr dipilih . Setiap galur mutan heterozigot disilangkan satu sama lain untuk memperoleh galur mutan homozigot, ict1 −/− dan mtrfr −/− . Genotipe dikonfirmasi menggunakan PCR, diikuti oleh kloning dan pengurutan TA.
Kultur sel in vitro dari sirip ekor, pewarnaan mitokondria, dan analisis morfologi mitokondria
Kultur in vitro sel dari sirip ekor dilakukan seperti yang dijelaskan sebelumnya [ [ 38 ] ]. Sel diisolasi dari sirip ekor ikan dewasa yang dibius dan dipotong menjadi kubus berukuran sekitar 2 mm secara manual menggunakan pisau bedah di bawah mikroskop stereo. Sel sirip dicuci lima kali dengan garam penyangga fosfat (PBS) [137 m m NaCl (Nacalai, Kyoto, Jepang), 27 m m KCl (Wako, Osaka, Jepang), 100 m m Na 2 HPO 4 ·H 2 O (Wako)] dan dilarutkan dalam 1 mL pengenceran 100 kali lipat larutan tripsin (Wako) dalam PBS dalam tabung pengikat rendah protein 1,5 mL (larutan tripsin: 0,5 w/v% tripsin dan 5,3 mmol/L EDTA·4Na tanpa fenol merah). Setelah diinkubasi selama 15 menit pada suhu 28 °C, sampel dibilas lima kali dengan PBS untuk menghilangkan tripsin dan diinkubasi dengan larutan kolagenase selama 3 jam pada suhu 28 °C dengan pengocokan lembut, yang terdiri dari 1 mg·mL −1 kolagenase I (Thermo Fisher Scientific), 0,1 mg·mL −1 DNase I (Worthington Biochemical, Lakewood, NJ, AS), dan 1,2 mg·mL −1 BSA (Wako) dalam PBS.
Setelah inkubasi, sampel disentrifugasi dan dicuci tiga kali dengan 1 mL PBS, dan 800 μL supernatan dibuang. Sebanyak 120 μL sampel disemai ke dalam slide 6-saluran dengan permukaan nonadherent untuk mikroskop fluoresensi (μ-slide VI 0.4; ibidi, Gräfelfing, Bavaria, Jerman) dan diinkubasi selama 3 jam pada suhu 28 °C. Setelah adhesi sel, setiap saluran dicuci dua kali dengan 200 μL PBS, dan sampel dikultur selama 16 jam dalam medium L-15 (Gibco, Waltham, MA, AS) tanpa serum sapi fetal. Setelah kultivasi, sampel dicuci dua kali dengan PBS dan diwarnai dengan larutan kerja MitoTracker Red CMXRos (Thermo Fisher Scientific) selama 20 menit pada suhu 28 °C sesuai dengan manual pabrik pembuat. Setelah pewarnaan, sampel dicuci dengan lembut tiga kali dengan PBS dan difiksasi dengan 4% paraformaldehida (Wako) dalam PBS. Setelah dicuci lembut dua kali dengan PBS, gambar fluoresensi sampel diambil menggunakan mikroskop fluoresensi (BZ-9000; Keyence, Osaka, Jepang). Gambar tersebut mengalami pengurangan kabut menggunakan perangkat lunak dengan mikroskop.
Gambar-gambar tersebut dianalisis menggunakan perangkat lunak Analisis Jaringan Mitokondria ( mina ) [ [ 39 ] ], sebuah plug-in untuk imagej/fiji [ [ 40 ] ], untuk memperoleh ringkasan parameter data yang mengklasifikasikan morfologi mitokondria. Hasilnya ditampilkan sebagai plot biola yang dibuat menggunakan graphpad prism 9.3.1 untuk Windows (GraphPad Software, Boston, MA, AS).
Uji perilaku
Untuk uji motilitas, larva 7 dpf dari tipe liar, ict1 −/− , dan mtrfr −/− digunakan. Sepuluh larva dari setiap galur ditempatkan dalam cawan petri steril (Diameter 90 × Tinggi 20 mm; Sansei Medical, Kyoto, Jepang), dan gerakan mereka difoto selama sekitar 30 detik menggunakan kamera digital 60 fps dengan resolusi 12,1 megapiksel (Canon PowerShot S120; Canon, Tokyo, Jepang). Semua rekaman gerakan dimulai 10 menit setelah adaptasi dalam cahaya tampak di ruangan ber-AC (25 °C).
Video dalam format MPEG3 dianalisis menggunakan perangkat lunak pelacakan buatan sendiri yang dikembangkan dalam bahasa python 3.0 menggunakan pustaka OpenCV (Python Software Foundation, Wilmington, DE, AS). Gambar JPG diekstraksi dari setiap bingkai video, dan pada setiap gambar, informasi posisi larva yang dipilih diperoleh dari kontras kepala larva terhadap latar belakang. Data dari setiap gambar kemudian diintegrasikan untuk memperoleh data tentang variasi temporal dalam posisi larva.
Kecepatan berenang rata-rata setiap larva dan rasio waktu berhenti terhadap total waktu pengukuran dihitung. Definisi item dan metode perhitungan dibahas di bagian Hasil .
Uji respons sentuhan dilakukan pada larva 7 dpf dalam cawan petri. Pergerakan larva yang dipicu dengan menyentuh permukaan dorsal ekor dengan probe bulu mata dipantau. Operasi yang tersisa sama dengan uji motilitas, kecuali waktu perekaman 1 menit. Respons segera setelah disentuh diklasifikasikan menjadi tiga jenis berdasarkan pola gerakan yang berbeda (lihat bagian Hasil ). Proporsi setiap jenis di setiap baris ditampilkan sebagai diagram batang bertumpuk 100%.
Hasil
Generasi garis keturunan tikus knockout Mtrfr dan daya mematikannya
Penamaan gen dan protein faktor penyelamat mitoribosom untuk setiap spesies yang digunakan dalam penelitian ini tercantum dalam Tabel S2 . Untuk nama representatif, kami menggunakan penamaan pada manusia, seperti ICT1 dan ICT1; MTRFR dan MTRFR.
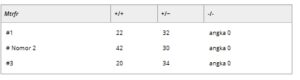
Bahasa Indonesia: Kami pertama kali mencoba untuk menghasilkan galur tikus knockout Mtrfr pada latar belakang tipe liar menggunakan sistem penyuntingan genom CRISPR/Cas9 dan memperoleh tiga galur independen tikus knockout heterozigot Mtrfr ( Mtrfr +/− ) (Tabel 1 , Gambar S1 ). Pada setiap galur knockout, mutasi delesi diperkenalkan ke ekson 3, menghasilkan pergeseran bingkai dan pembentukan kodon terminasi prematur (PTC). Ketiga alel mutan mengkodekan protein terpotong (residu 54, 53, dan 57) alih-alih protein residu 84 panjang penuh, yang semuanya tidak memiliki domain GGQ dan ekstensi C-terminal (Gambar S1 ). Semua galur knockout heterozigot tampak normal, konsisten dengan fakta bahwa pada manusia, penyakit mitokondria, COXPD7, yang diakibatkan oleh mutasi kehilangan fungsi pada MTRFR diwariskan secara resesif autosom. Namun, tidak ada galur tikus knockout homozigot ( Mtrfr −/− ) yang dapat dihasilkan dari setiap persilangan dari tiga galur knockout heterozigot, yang menunjukkan bahwa knockout Mtrfr bersifat mematikan pada tikus (Tabel 1 ). Pada persilangan tikus heterozigot, jumlah keturunan saat lahir tetap tidak berubah tanpa kematian berikutnya, yang menyiratkan bahwa galur knockout homozigot tidak lahir pada awalnya dan dengan demikian mematikan embrio. Temuan pada tikus ini kontras dengan temuan bahwa mutasi kehilangan fungsi pada MTRFR tidak mematikan dan menyebabkan penyakit pada manusia. Dalam percobaan knockout gen, fenotipe mutan knockout sering kali berbeda atau tidak sepenuhnya identik pada tikus dan manusia.
Tabel 1. Hasil persilangan dari tiga galur tikus heterozigot Mtrfr knockout. Urutan genom yang bermutasi dari tiga galur knockout ditunjukkan pada Gambar S1 .
Pembuatan garis keturunan zebrafish knockout ict1 dan mtrfr serta sifat tidak mematikannya
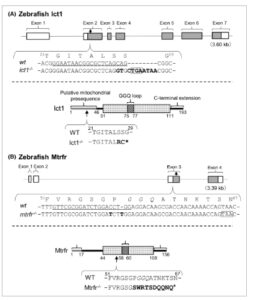
Selanjutnya kami menghasilkan garis zebrafish knockout ict1 dan mtrfr pada latar belakang tipe liar (Tu) menggunakan sistem CRISPR/Cas9. Untuk tujuan ini, kami menargetkan ekson 2 dan 3 di ict1 dan mtrfr , masing-masing, untuk mengganggu translasi protein dengan panjang penuh (Gbr. 1 ). Pertama, garis mutan heterozigot ict1 dan mtrfr dibuat , dan garis mutan homozigot diperoleh setelah percobaan silang berikutnya.
Gbr. 1
Buka di penampil gambar
Presentasi PowerPoint
Pembuatan galur zebrafish knockout ict1 dan mtrfr menggunakan sistem CRISPR/Cas9. (A) Panel atas: Diagram skema konfigurasi ict1 dari zebrafish menurut basis data Ensemble [ [ 56 ] ]. Ekson direpresentasikan sebagai kotak, dengan daerah abu-abu menunjukkan daerah pengodean protein. Panah bawah menunjukkan posisi mutasi. Hanya urutan DNA gen untuk tipe liar ( wt ) dan ict1 −/− sebelum dan sesudah posisi mutasi yang ditampilkan, dan urutan asam amino yang sesuai untuk wt ditampilkan di atas urutan DNA. Urutan RNA panduan dalam wt digarisbawahi. Urutan mutasi dalam ict1 −/− ditampilkan dalam huruf tebal, dan urutan dalam kotak menunjukkan kodon stop prematur. Panel bawah: Representasi domain skema protein Ict1. Domain katalitik terstruktur (domain GGQ) direpresentasikan sebagai kotak berdasarkan struktur ICT1 mamalia. Batang abu-abu menunjukkan wilayah yang sesuai dengan urutan atau presekuens penargetan mitokondria yang diduga, yang diprediksi menggunakan server web TargetP-2.0 [ [ 57 ] ]. Panah ke atas menunjukkan asam amino pertama yang mengalami perubahan karena mutasi. Urutan asam amino untuk wt dan ict1 −/− ditunjukkan. Huruf tebal menunjukkan residu yang bermutasi dalam ict1 −/− , dan tanda bintang menunjukkan terminasi. (B) Gambar mengenai mtrfr ditunjukkan. Notasinya sama dengan (A).
Kami memperoleh satu galur mutan homozigot ict1 dan satu galur mtrfr . Untuk knockout ict1 , tiga basa pada ekson 2 digantikan dengan 11 basa (Gbr. 1A ), sedangkan untuk knockout mtrfr , perubahan satu basa dan penyisipan satu basa dilakukan pada ekson 3 (Gbr. 1B ). Mutasi ini menyebabkan frameshift dan memperkenalkan PTC ke dalam ict1 dan mtrfr .
Jika gen mutan ict1 dan mtrfr diekspresikan, protein yang diekspresikan akan terdiri dari 28 dan 66 residu asam amino, berbeda dengan protein normal dengan panjang penuh yang masing-masing terdiri dari 193 dan 156 residu (Gbr. 1A,B ). Kedua protein tersebut tidak memiliki domain GGQ dan ekstensi C-terminal yang mengikutinya. Temuan ini menunjukkan bahwa satu galur knockout untuk ict1 dan mtrfr telah dibuat, yang masing-masing disebut ict1 −/− atau mtrfr −/− .
Baik galur ict1 −/− maupun mtrfr −/− dewasa tidak menunjukkan perbedaan nyata dari tipe liar dalam morfologi, ukuran, atau perilaku selama setidaknya 6 bulan setelah pembuahan dalam kondisi pembiakan standar (Gbr. S2 ). Selain itu, galur ict1 −/− dan mtrfr −/− memiliki kapasitas reproduksi normal. Hasil ini menunjukkan bahwa pertumbuhan dan perkembangan ikan zebra dalam kondisi normal atau tanpa stres tidak memerlukan kedua gen tersebut.
Morfologi mitokondria sel sirip ekor dewasa berbeda antara tipe liar ict1 −/− dan mtrfr −/−
Meskipun tidak ditemukan kelainan yang dapat diamati pada individu yang mengalami knockout, penghapusan ict1 atau mtrfr seharusnya memiliki pengaruh terhadap fungsi mitokondria pada sel ikan zebra. Kami memeriksa morfologi mitokondria pada sel mirip keratinosit dari sirip ekor dewasa ict1 −/− dan mtrfr −/− yang diwarnai dengan MitoTracker Red dan mengambil gambar menggunakan mikroskop fluoresensi (Gbr. 2 ).

Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Morfologi mitokondria dalam sel sirip ekor dari ikan dewasa tipe liar, ict1 −/− , dan mtrfr −/− . Empat gambar fluoresensi representatif yang diwarnai dengan MitoTracker Red CMXRos (kiri) dan gambar skeletonisasi terkait yang dibuat menggunakan perangkat lunak mina (kanan) masing-masing untuk sel sirip ekor dari ikan dewasa tipe liar (A), ict1 −/− (B), dan mtrfr −/− (C). Gambar-gambar ini dipilih dari gambar-gambar yang digunakan untuk analisis yang disajikan dalam Gambar 3. Setiap batang skala mewakili 5 μm. Mitokondria dalam sel tunggal yang dibingkai dalam warna putih di panel kiri skeletonisasi menggunakan perangkat lunak mina .
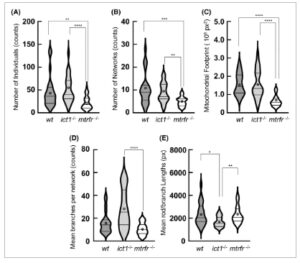
Morfologi mitokondria dalam gambar fluoresensi dianalisis menggunakan perangkat lunak mina [ [ 39 ] ], plugin imagej/fiji [ [ 40 ] ]. Singkatnya, mina pertama-tama melakukan binarisasi pada gambar asli dan membuat kerangkanya untuk menghasilkan kerangka morfologi (Gbr. 2 ). Proses ini memungkinkan ekstraksi parameter kuantitatif yang secara tepat menangkap morfologi mitokondria. mina menggunakan sistem yang mengklasifikasikan objek dalam gambar kerangka menjadi dua kategori. Batang dan bentuk titik diklasifikasikan sebagai ‘individu’, sementara semua objek dengan setidaknya satu persimpangan sebagai ‘jaringan’ (Gbr. S3 ). Akhirnya, mina menghasilkan serangkaian keluaran deskriptor mitokondria: jumlah individu dan jaringan, cabang rata-rata per jaringan (ukuran jaringan), dan panjang batang/cabang; jejak mitokondria (area kerangka yang dihitung sebelum kerangka).
Perbandingan deskriptor mitokondria di antara tipe liar, ict1 −/− , dan mtrfr −/− menunjukkan perbedaan yang nyata dalam morfologi mitokondria antara setiap garis knockout dan tipe liar dan antara garis knockout. Dalam sel ict1 −/− , tidak ada perubahan signifikan yang diamati dalam jumlah individu dan jaringan dan jejak mitokondria dibandingkan dengan tipe liar (Gbr. 3 ). Namun, panjang batang/cabang menurun secara signifikan, sementara jumlah cabang per jaringan meningkat, dengan rata-rata dua kali lipat dari tipe liar; meskipun P = 0,0638. Sebaliknya, dalam sel mtrfr −/− , tidak ada perubahan signifikan yang diamati dalam panjang batang/cabang dan jumlah cabang per jaringan dibandingkan dengan tipe liar (Gbr. 3 ). Namun, jumlah individu dan jaringan serta jejak menurun secara signifikan dibandingkan dengan tipe liar. Secara keseluruhan, penghapusan ict1 memengaruhi sifat jaringan hingga tingkat yang lebih besar daripada jumlah individu dan jaringan, sedangkan penghapusan mtrfr menunjukkan efek yang berlawanan. Karena ict1 −/− dan mtrfr −/− tampak sehat, morfologi mitokondria yang berubah mungkin terkait dengan mekanisme kompensasi untuk dugaan cacat mitokondria yang disebabkan oleh setiap penghapusan gen.
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
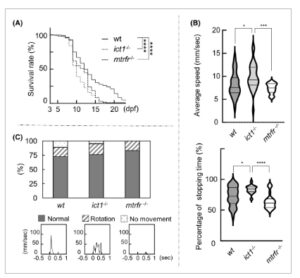
Analisis jaringan mitokondria untuk sel sirip ekor dari ikan dewasa tipe liar, ict1 −/− , dan mtrfr −/− . Gambar kerangka yang ditunjukkan pada Gambar 2 dianalisis menggunakan perangkat lunak mina untuk menunjukkan deskriptor mina : jumlah individu (A), jumlah jaringan (B), jejak mitokondria (C), cabang rata-rata per jaringan (D), dan panjang batang/cabang rata-rata (E). Plot biola ditunjukkan untuk empat deskriptor wt ( n = 22), ict1 −/− (25) dan mtrfr −/− (29). Garis besar plot biola menggambarkan kerapatan probabilitas kernel; dengan kata lain, lebar plot biola mewakili proporsi data, sehingga menunjukkan distribusi data. Kuartil ketiga, median, dan kuartil pertama ditunjukkan dengan batang horizontal dari atas ke bawah, sedangkan rata-rata ditunjukkan dengan lingkaran. Tanda bintang menunjukkan perbedaan signifikan antara masing-masing kelompok (ditunjukkan dengan batang). Uji Kruskal–Wallis dengan uji perbandingan ganda Dunn, **** P < 0,0001; *** P < 0,001; ** P < 0,01; * P < 0,05. Kelaparan mengurangi tingkat kelangsungan hidup larva ict1 −/− dan mtrfr −/− Dalam kondisi tanpa tekanan, baik penghapusan ict1 maupun mtrfr tidak berdampak signifikan pada perkembangan atau pertumbuhan ikan zebra. Oleh karena itu, kami meneliti tingkat kelangsungan hidup galur ict1 −/− dan mtrfr −/− larva ikan zebra ketika mengalami kondisi kelaparan. Kondisi stres dan perubahan sumber energi memiliki berbagai efek pada mitokondria, seperti perubahan tingkat OXPHOS dan morfologi mitokondria serta biogenesis [ [ 41 , 42 ] ]. Sepuluh larva pada 3 hari pascafertilisasi (dpf) dipelihara dalam cawan Petri tanpa makanan. Kondisi pembiakan membantu meminimalkan potensi kontaminasi air pembiakan. Jumlah larva yang hidup dihitung setiap hari. Larva awalnya diberi makan oleh kantung kuning telur, yang diserap sepenuhnya oleh sekitar 10 dpf [ [ 43 ] ]. Akibatnya, larva mengalami stres kelaparan total untuk pertama kalinya setelah periode ini. Kurva survival Kaplan–Meier menunjukkan perbedaan signifikan antara tipe liar dan ict1 −/− dan antara tipe liar dan mtrfr −/− (Gbr. 4A ). Hingga 8 dpf, tingkat survival serupa di antara ketiga galur, sementara pada 10 dpf, urutan tingkat survival adalah wt (75%) > ict1 −/− (55%) > mtrfr −/− (39%), sementara pada 13 dpf, yaitu: wt (40%) > ict1 −/− ≈ mtrfr −/− (24%). mtrfr −/− tampak lebih sensitif terhadap kelaparan daripada ict1 −/− . Rentang hidup maksimum tipe liar adalah 23 dpf, sedangkan dua galur knockout adalah 18 dpf. Hasil ini menunjukkan bahwa ICT1 dan MTRFR memainkan peran penting dalam kelangsungan hidup larva dalam kondisi stres kelaparan. Dengan kata lain, dalam kondisi stres seperti itu, kebutuhan ICT1 dan MTRFR mungkin menjadi jelas.
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Tingkat kelangsungan hidup dan perilaku motorik larva tipe liar, ict1 −/− , dan mtrfr −/− . (A) Kurva kelangsungan hidup Kaplan–Meier dari tipe liar ( n = 201), ict1 −/− (205), dan mtrfr −/− (145) yang dipelihara dalam cawan Petri tanpa pakan. Pengamatan dimulai pada 3 dpf. Tanda bintang menunjukkan perbedaan signifikan antara masing-masing kelompok (uji Kruskal–Wallis dengan uji perbandingan berganda Dunn). **** P < 0,0001; *** P < 0,001; ** P < 0,01; * P < 0,05. (B) Atas: Kecepatan rata-rata pergerakan larva dari tiga galur, dihitung dengan membagi jarak yang ditempuh dengan waktu yang dihabiskan untuk bepergian. Plot biola menunjukkan kecepatan rata-rata larva 7 dpf dari tipe liar ( n = 29), ict1 −/− (30), dan mtrfr −/− (24). Perhitungan waktu tempuh tidak termasuk bingkai di mana larva menghentikan perjalanannya (yaitu, jarak tempuh < 0,02 mm). Kuartil ketiga, median, dan kuartil pertama ditunjukkan dengan batang horizontal dari atas ke bawah. Data dinilai menggunakan uji Kruskal–Wallis dengan uji perbandingan berganda Dunn. Lintasan pergerakan larva ditunjukkan pada Gambar S4B . Bawah: Persentase waktu berhenti selama larva berhenti melakukan perjalanan, dihitung dengan membagi waktu selama larva menghentikan perjalanannya (yaitu, jarak tempuh < 0,02 mm) dengan total waktu perekaman. (C) Atas: Persentase tiga jenis respons sentuhan terhadap larva 7 dpf dari tiga garis yang diklasifikasikan menjadi normal, rotasi, dan tidak ada gerakan. Bawah: plot tipikal (detik vs. kecepatan) untuk setiap kategori ditampilkan. Ilustrasi klasifikasi yang lebih rinci ditampilkan pada Gambar S4C . Tidak ada perbedaan signifikan antara wt dan ict1 −/− (uji pasti Fisher, P = 0,764) atau antara wt dan mtrfr −/− ( P = 0,703) yang diamati.
Larva Ict1 −/− dan Mtrfr −/− menunjukkan perubahan perilaku lokomotor, sedangkan sentuhan tidak terpengaruh
Ciri klinis COXPD7 meliputi atrofi optik, neuropati perifer, dan paraparesis spastik. Kami pertama kali melakukan uji perilaku untuk larva ict1 −/− dan mtrfr −/− : aktivitas lokomotor (kecepatan berenang dan waktu berhenti selama gerakan) dan respons sentuhan. Untuk memeriksa aktivitas lokomotor, kami memantau pergerakan larva 7 dpf dalam cawan Petri selama sekitar 30 detik menggunakan kamera digital 60 fps dengan resolusi 12,1 megapiksel (Gbr. S4A,B ). Tujuh larva dpf dari tipe liar dan garis knockout berada di bawah sedikit atau tidak ada stres kelaparan [ [ 43 ] ]. Semua rekaman gerakan dimulai 10 menit setelah adaptasi dalam cahaya tampak pada suhu kamar. Total jarak yang ditempuh oleh setiap larva dihitung menggunakan perangkat lunak pelacakan buatan sendiri. Kecepatan berenang rata-rata ditentukan dengan membagi jarak yang ditempuh dengan waktu yang telah berlalu yang diperoleh dengan menggunakan 1/60 detik per nyala api, tidak termasuk bingkai di mana larva tidak menunjukkan gerakan substansial (< 0,02 mm). Rasio waktu berhenti terhadap waktu pengukuran ditentukan dengan membagi jumlah bingkai di mana larva tidak menunjukkan gerakan dengan jumlah total bingkai. Artinya, saat nilai rasio mendekati 1, proporsi waktu di mana ikan zebra tidak menunjukkan gerakan meningkat.
Nilai median kecepatan renang rata-rata ict1 −/− lebih tinggi daripada tipe liar (Gbr. 4B , atas), dengan distribusi yang lebih luas. Nilai median waktu berhenti rata-rata ict1 −/− lebih tinggi, dengan distribusi yang lebih sempit (Gbr. 4B , bawah). Sebaliknya, nilai median kecepatan renang rata-rata mtrfr −/− mirip dengan tipe liar, dengan distribusi yang lebih sempit (Gbr. 4B , atas). Median waktu berhenti rata-rata mtrfr −/− lebih rendah daripada tipe liar, dengan distribusi yang berisi puncak mayor dan minor, yang berbeda dari distribusi tipe liar (Gbr. 4B , bawah). Secara keseluruhan, ict1 −/− menunjukkan kecenderungan berenang relatif lebih cepat dan berhenti lebih jarang daripada tipe liar, sedangkan mtrfr −/− cenderung memiliki kecepatan yang sebanding dan frekuensi berhenti yang meningkat dibandingkan dengan tipe liar.
Uji respons sentuhan dilakukan pada larva 7 hari setelah lahir dalam cawan Petri dengan menyentuh bagian dorsal ekor dengan probe bulu mata. Respons segera setelah disentuh diklasifikasikan menjadi tiga jenis berdasarkan pola gerakannya yang berbeda (Gbr. S4C ). Perbandingan respons sentuhan antara ketiga galur tidak menunjukkan perbedaan yang signifikan berdasarkan klasifikasi ini (Gbr. 4C ).
Secara kolektif, kecuali untuk respons sentuhan, perbedaan signifikan dalam perilaku lokomotor di antara larva galur ict1 −/− , mtrfr −/− , dan tipe liar diamati. Hasil ini menunjukkan bahwa penghapusan gen ict1 atau mtrfr memiliki efek yang lebih besar pada fungsi sel neuron daripada pada sel otot. Cawan petri mungkin telah menekan larva dengan membatasi rentang gerakan, terutama kedalaman. Oleh karena itu, tekanan ini mungkin disebabkan oleh perbedaan perilaku lokomotor antara galur tipe liar dan galur knockout.
Zebrafish Ict1 tidak memiliki motif pengikat mitoribosom yang ditemukan di sebagian besar protein ICT1 eukariotik
Karena penghapusan ICT1 menyebabkan perbedaan yang nyata dalam tingkat kematian antara ikan zebra dan mamalia, kami berspekulasi bahwa terdapat perbedaan mendasar dalam fungsi dan, dengan demikian, urutan asam amino antara protein ICT1 ikan zebra dan mamalia. Dengan demikian, kami melakukan penyelarasan urutan di antara protein ICT1 dari berbagai metazoa (Gbr. 5A , Gbr. S5 ). Mengingat struktur mitoribosom manusia [ [ 44 ] ] (Gbr. 5B ), urutan pengikatan mtLSU diidentifikasi pada ujung N sebagian besar protein ICT1; namun, motif ini tidak ditemukan pada teleost, termasuk ikan zebra (Gbr. 5A ). Urutan konsensus untuk pengikatan mtLSU adalah sebagai berikut: F/YKSXYSLDK/RLYP (di mana X mewakili residu hidrofobik dalam banyak kasus), selanjutnya disebut motif YSLDK untuk kenyamanan. Dalam struktur mitoribosom, residu motif membentuk bentangan tunggal struktur yang terdiri dari tiga unit struktural minimal yang berurutan: β-turn (tipe I, salah satu β-turn yang paling umum), satu-turn dari α-helix, dan 3 10 -helix [ [ 44 ] ] (Gbr. 5C , kiri). Struktur motif ini memfasilitasi perakitan rantai samping hidrofobik residu dalam satu arah. Permukaan hidrofobik yang dihasilkan dalam ICT1 berinteraksi dengan permukaan yang dibentuk oleh residu hidrofobik spesifik dari protein ribosom mitokondria uL15m (MRPL15) (Gbr. 5C , kanan). Selain itu, dua ikatan hidrogen putatif terbentuk antara Ser41 dalam ICT1 dan Asp261 dalam uL15m dan antara Ser52 dan Asp225, dengan kemungkinan interaksi anion-π antara Tyr49 dan Asp225 (Gbr. 5C , kiri). Serangkaian interaksi menunjukkan interaksi yang sangat spesifik antara motif YSLDK dan struktur uL15m; keduanya tampak terpelihara dengan baik di sebagian besar metazoa (yaitu, metazoa lain kecuali teleost).
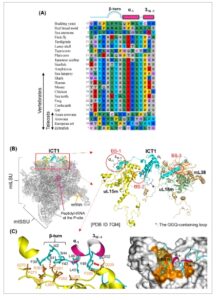
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Pengikatan ICT1 manusia ke mitoribosom sebagai protein ribosom integral dan motif pengikatan karakteristik di N terminus. (A) Penjajaran urutan asam amino terdapat pada motif YSLDK di N terminus di antara protein ICT1 dari berbagai eukariota. Motif YSLDK ditunjukkan oleh kotak dengan garis-garis putih. Di atas penjajaran, elemen struktur sekunder yang dibentuk oleh residu motif YSLDK yang ditemukan di ICT1 manusia ditunjukkan. Untuk C. elegans ICT1, daerah N-terminal pendek; oleh karena itu, urutannya tidak ditunjukkan. Penjajaran dilakukan dengan menggunakan program clustalw [ [ 58 ] ]. Penjajaran urutan panjang penuh protein ICT1 ditunjukkan pada Gambar S5 . Kode aksesi untuk protein ICT1 yang digunakan disediakan dalam legenda Gambar S5 . Angka di sebelah kiri penjajaran sesuai dengan jumlah asam amino pertama di setiap protein ICT1. Penjajaran diwarnai sebagai berikut: ungu: glisin (G); kuning: prolin (P); hijau: asam amino kecil dan hidrofobik (A, V, L, I, M); merah muda: residu aromatik hidrofobik (F, W); abu-abu: asam amino hidroksil dan amina (S, T, N, Q); merah: asam amino bermuatan negatif (D, E); biru: asam amino bermuatan positif (K, R); merah muda pucat: sistein (C); cyan: histidin (H) dan tirosin (Y). (B) Kiri: Struktur keseluruhan mitoribosom manusia yang mengandung mRNA, tRNA di situs P, dan ICT1 sebagai protein ribosom dalam representasi pita. Semua struktur dalam gambar ini berdasarkan PDB ID 7QI4 [ [ 44 ] ]. Protein ribosom dan rRNA dalam mitoribosom digambarkan dalam warna abu-abu, sedangkan yang lainnya ditunjukkan dengan anak panah. Kanan: kostruktur ICT1 (aquamarine) dan tiga protein ribosomal, uL15m (kuning), uL18m (hutan), dan mL38 (coklat muda), yang diekstraksi dan dilibatkan dari struktur di panel kiri. BS-1, -2, dan -3 (dilingkari merah) menunjukkan situs pengikatan utama ICT1 ke tiga protein ribosomal. Struktur BS-1 diilustrasikan dalam (C), sedangkan BS-2 dan BS-3 ada di Gambar S6 . Program pymol (PyMOL Molecular Graphics System, Versi 2.0, Schrödinger, LLC) digunakan untuk memvisualisasikan dan menganalisis struktur. (C) Kiri: Tampilan BS-1 yang diperbesar. Rantai samping dari sembilan residu motif pengikatan karakteristik ICT1, motif YSLDK, ditunjukkan; α- dan 3 10 -heliks digambarkan dalam warna merah muda. Rantai samping residu dalam uL15m yang berinteraksi dengan residu motif ditunjukkan. Garis putus-putus merah menunjukkan ikatan hidrogen, sementara panah merah dua arah menunjukkan interaksi anion-π. Kanan: Representasi permukaan molekul yang menunjukkan daerah interaksi uL15m (digambarkan dengan warna oranye) dengan representasi pita residu motif YSLDK. Program molmol[ [ 59 ] ] digunakan untuk memvisualisasikan dan menganalisis struktur.
Bahasa Indonesia: Selain tempat pengikatan motif ke mtLSU (disebut BS-1), dua tempat pengikatan lain, BS-2 dan BS-3, yang diatur oleh interaksi hidrofobik telah diidentifikasi [ [ 44 ] ] (Gbr. 5B , Gbr. S6 ). Secara umum, interaksi hidrofobik sangat penting dalam ‘interaksi permanen’ antara protein; dalam hal ini, antara ICT1 dan protein ribosomal tertentu [ [ 45 ] ]. Secara khusus, dalam BS2, Tyr142 dan Phe144 di ICT1 berinteraksi dengan Ala145, Tyr240, dan Leu162 di uL15m. Di BS-3, Leu188 di ICT1 berinteraksi dengan Leu137 di uL18m (MRPL18) dan Pro186 dan Tyr188 di mL38 (MRPL38) (Gbr. S6 ). Residu hidrofobik yang membentuk kedua situs, seperti terlihat di BS1, sangat terkonservasi dalam protein ICT1 dan protein ribosom dari sebagian besar metazoa (Gbr. S5 dan S7 ).
Namun, protein ICT1 dari teleost tidak memiliki motif YSLDK, dan urutan N-terminal di hulu domain GGQ tidak dipertahankan di antara teleost (Gbr. 5A , Gbr. S5 ). Mengenai BS-2 dan BS-3, beberapa residu berbeda antara sebagian besar metazoa dan teleost (misalnya, Leu162 di uL15m vs. Gly/Lys/Ala; Phe144 di ICT1 vs. Gln/Arg/His) (Gbr. S6 dan S7 ), dan oleh karena itu, interaksi hidrofobik seperti pada mitoribosom manusia mungkin tidak terbentuk pada rekan-rekan teleost. Hasil-hasil ini digabungkan menunjukkan bahwa ICT1 di teleost tidak dapat mengikat mtLSU sebagai komponen mitoribosom. Namun, kemungkinan bahwa ICT1 ikan zebra berinteraksi dengan mtLSU dalam mode yang berbeda atau wilayah mtLSU yang berbeda tidak dapat dikesampingkan.
Diskusi
Dalam penelitian ini, kami memperoleh tiga garis independen tikus knockout Mtrfr heterozigot tetapi tidak dapat memperoleh tikus knockout homogenik. Bahkan jika gen mutan MTRFR diekspresikan, tiga posisi mutasi memungkinkan protein mutan kekurangan residu asam amino yang membentuk domain GGQ dan ekstensi C-terminal. Posisi mutasi serupa telah dilaporkan pada pasien dengan COXPD7, seperti Pro34Ilefs*25 [ [ 28 ] ] dan Thr3Argfs*54 [ [ 23 ] ]. Ini menunjukkan bahwa efek negatif dari penghapusan gen yang secara efektif meniadakan ekspresi MTRFR kemungkinan lebih jelas pada tikus daripada pada manusia. Karena penghapusan Ict1 mematikan pada tikus, faktor penyelamat mitoribosom, ICT1 dan MTRFR, sangat penting untuk perkembangan dan pertumbuhan normal pada mamalia.
Kami menghasilkan satu garis zebrafish knockout masing-masing untuk ict1 dan mtrfr , yang tampak sehat, bertentangan dengan harapan. Namun, dalam kondisi kelaparan, tingkat kelangsungan hidup garis knockout larva secara signifikan lebih rendah daripada tipe liar. Produksi ATP dalam mitokondria memerlukan translasi semua gen yang dikodekan oleh mtDNA, yang proteinnya merupakan subunit dari lima kompleks multimerik rantai OXPHOS. Agar larva dapat bertahan hidup di lingkungan yang miskin nutrisi, translasi mitokondria harus berlangsung secara efisien dan tanpa gangguan, melebihi efisiensi yang terlihat dalam kondisi tanpa stres. Kondisi ini menyoroti perlunya faktor penyelamatan ribosom.
Berikutnya, kami membahas pertanyaan berikut: mengapa dua garis knockout zebrafish dapat bertahan hidup dan sehat dalam kondisi tanpa stres? Satu kemungkinan jawaban adalah bahwa mekanisme berbeda yang mengkompensasi hilangnya salah satu faktor tersebut menjadi aktif dalam garis sel knockout. Analisis mina mitokondria dalam sel sirip ekor dewasa menunjukkan perbedaan signifikan dalam morfologi mitokondria antara ict1 −/− dan mtrfr −/− dan tipe liar dan antara ict1 −/− dan mtrfr −/− . Karena dua garis knockout tersebut sehat, perbedaan dalam morfologi mitokondria dari tipe liar ini mungkin bermanfaat bagi sel ict1 −/− dan mtrfr −/− . Fitur morfologi mitokondria yang paling menonjol yang diamati dalam ict1 −/− adalah peningkatan dalam ukuran jaringan tanpa peningkatan dalam jumlah jaringan. Ini menunjukkan fusi mitokondria yang diaktifkan atau jaringan mitokondria yang lebih menyatu, berdasarkan hasil kuantifikasi morfologi mitokondria pada fibroblas yang berasal dari pasien yang berbeda, termasuk yang terkena penyakit mitokondria, dianalisis menggunakan mina [ [ 39 , 46 , 47 ] ]. Sebaliknya, fitur morfologi mitokondria yang paling menonjol dalam sel mtrfr −/− adalah pengurangan yang signifikan dalam jumlah individu dan jaringan dan jejak mitokondria. Pengurangan tersebut sering menunjukkan fisi atau fragmentasi mitokondria, yang terkait dengan disfungsi mitokondria [ [ 48 – 50 ] ]. Namun, pada saat yang sama, panjang batang/cabang rata-rata dalam sel mtrfr −/− meningkat sampai batas tertentu daripada tipe liar, dan ini mungkin sebagian membantu mengkompensasi dugaan disfungsi mitokondria dalam sel mtrfr −/− . Eksperimen lebih lanjut diperlukan untuk menjelaskan mekanisme kompensasi; Setelah dipahami, perbedaan fungsional antara kedua protein akan menjadi jelas.
Penjelasan potensial lainnya adalah bahwa Ict1 dan Mtrfr pada ikan zebra memiliki beberapa kesamaan fungsional, yang memungkinkan satu faktor untuk mengompensasi sebagian disfungsi atau hilangnya faktor lainnya, meskipun tidak sepenuhnya. Komplementaritas fungsional seperti itu tidak diamati pada manusia, karena penghapusan ICT1 bersifat mematikan, sedangkan penghapusan MTRFR menyebabkan penyakit mitokondria. Salah satu alasan utama kurangnya komplementaritas fungsional antara kedua faktor penyelamat pada manusia adalah bahwa ICT1 merupakan komponen mtLSU (Gbr. 5B ), yang menghalangi kemungkinan MTRFR menjadi pengganti ICT1. Temuan penyelarasan sekuens menunjukkan bahwa, pada ikan zebra, Ict1 bukan merupakan komponen mtLSU; oleh karena itu, hilangnya Ict1 dapat dikompensasi sebagian oleh Mtrfr.
Kematian garis knockout ICT1 atau MTRFR dari manusia, tikus, ikan zebra, dan ragi bertunas dirangkum dalam Tabel 2. Khususnya, temuan pada ikan zebra mirip dengan yang ada di Saccharomyces cerevisiae . Galur mutan S. cerevisiae yang tidak memiliki ortolog ICT1 atau MTRFR (masing-masing Pth4 atau Pth3) dapat hidup dalam kondisi tanpa stres. Sebaliknya, dalam kondisi stres suhu dan antibiotik, baik Pth4 maupun Pth3 sangat diperlukan untuk pertumbuhan, yang menunjukkan interaksi genetik antara pth4 dan pth3 yang melibatkan komplementaritas fungsional [ [ 51 ] ]. Selain itu, ortolog ICT1 tidak memiliki motif YSLDK dan tidak diamati dalam struktur mitoribosom cryo-EM dari ragi [ [ 52 ] ] atau Neurospora crassa [ [ 53 ] ]. Hal ini menunjukkan bahwa ortolog ICT1 bukanlah komponen mitoribosom di seluruh fungi. Dengan demikian, mungkin ada hubungan antara kematian atau penyakit akibat penghapusan setiap faktor penyelamatan ribosom, sifat pengikatan ribosom pada ICT1, dan keberadaan motif YSLDK dalam kelompok biologis tertentu, seperti jamur dan teleost.
Tabel 2. Ringkasan kematian akibat knockout gen ICT1 atau MTRFR pada kondisi normal dan keberadaan motif YSLDK pada berbagai eukariota.

a Harapan dari data latar belakang yang dijelaskan dalam Pendahuluan.
b Data yang ditunjukkan dalam penelitian ini.
Studi ini juga menunjukkan bahwa, meskipun semua eukariota memiliki ICT1, teleost (infrakelas Teleostei) adalah satu-satunya kelompok vertebrata di mana ICT1 tidak memiliki motif YSLDK (Gbr. S8 ). Keunikan ini mencerminkan terjadinya duplikasi genom ketiga, yang terjadi hanya pada teleost, yang dikenal sebagai duplikasi genom spesifik teleost (TGD) [ [ 54 , 55 ] ]. Setelah terjadinya TGD pada nenek moyang teleost, urutan motif YSLDK dari ICT1 tampaknya telah mengalami mutasi yang luas, mencegah ICT1 menjadi komponen struktural mtLSU. Sebaliknya, motif GGQ sepenuhnya dilestarikan dalam protein ICT1 di semua spesies eukariotik; khususnya, residu motif GGQ tidak berfungsi sebagai situs interaksi dengan mitoribosom pada manusia [ [ 44 ] ]. Konservasi ini menyoroti pentingnya ICT1 sebagai faktor penyelamat mitoribosom pada eukariota. Temuan kami menunjukkan bahwa ICT1 berfungsi sebagai faktor penyelamatan dalam kondisi tertentu, bahkan pada spesies seperti manusia, di mana ia juga berfungsi sebagai komponen struktural mtLSU.
