Abstrak
Virus sering berinteraksi dengan jaringan regulasi transkripsi dan epigenetik inang. Elemen yang sering diabaikan dari interaksi ini adalah pembentukan R-loop, struktur asam nukleat beruntai tiga yang terdiri dari hibrida RNA–DNA dan untai DNA tunggal yang tergeser. Bukti yang terkumpul menunjukkan keterlibatan R-loop dalam preferensi situs integrasi virus, regulasi genom virus laten, pembungkaman epigenetik, dan bahkan genesis RNA pengganggu kecil (siRNA) yang memodulasi elemen virus bergerak. Perspektif ini menyajikan potensi hubungan antara gen virus, transposon, dan R-loop; meneliti peran R-loop dalam patogenesis, latensi, dan reaktivasi virus; mengeksplorasi bagaimana virus memanfaatkan atau menghindari respons terkait R-loop; dan menyoroti arah penelitian masa depan—mulai dari pemetaan hotspot R-loop hingga pemanfaatan modulasi R-loop untuk terapi antivirus.
Singkatan
BRCA1/2 , gen kanker payudara 1/2
Protein Cas , protein terkait CRISPR
cccDNA , DNA sirkuler tertutup kovalen
cDNA , salinan DNA
CMV , sitomegalovirus
ColE1 , kolisin E1
CRISPR-Cas9 , pengelompokan pengulangan palindromik pendek yang tersebar secara teratur/protein 9 yang terkait dengan CRISPR
crRNA , RNA CRISPR
DAMP , pola molekuler terkait kerusakan
DDX , helikase kotak MATI
DNMT , DNA metiltransferase
DRIP-seq , pengurutan imunopresipitasi DNA–RNA
dsDNA , DNA untai ganda
dsRNA , RNA untai ganda
EBV , virus Epstein-Barr
G/C , guanin/sitosin
HBV , Virus Hepatitis B
Protein HBx , protein onkogen X yang dikodekan oleh HBV
HCMV , virus sitomegalo manusia
HCV , virus hepatitis C
HDAC , histon deasetilase
HERV , retrovirus endogen manusia
HERV-K , retrovirus endogen manusia K
het-siRNA , siRNA heterokromatik
HIV , virus imunodefisiensi manusia
HIV-1 , virus imunodefisiensi manusia-1
HPV , virus papiloma manusia
HSV-1 , virus herpes simpleks-1
HTLV-1 , virus limfotropik T manusia tipe 1
IL-10 , interleukin-10
KSHV , virus herpes yang berhubungan dengan sarkoma Kaposi
LANA , antigen nuklir laten
LEDGF/p75 , faktor pertumbuhan yang berasal dari epitel lensa
LMP1 , protein membran laten 1
lncRNA4.9 , RNA noncoding panjang4.9
LRA , agen pembalik latensi
LTR , pengulangan terminal panjang
NSP14 , protein non-struktural 14
ORF57 , bingkai baca terbuka 57
ori , asal usul replikasi
oriLyt , asal usul replikasi litik
PAMP , pola molekuler terkait patogen
QDRIP , imunopresipitasi diferensial kuantitatif DNA–RNA
Rb/pRb , protein retinoblastoma
RdRp , RNA polimerase yang bergantung pada RNA
RISC , Kompleks pembungkaman yang diinduksi RNA
RNAi , Interferensi RNA
S1-DRIP , S1 nuklease DNA:RNA imunopresipitasi
siRNA , RNA pengganggu kecil
Tat , trans-aktivator transkripsi-1
TREX , ekspor transkripsi
vIL-6 , interleukin-6 virus
R-loop adalah struktur asam nukleat beruntai tiga yang terbentuk ketika untai RNA yang baru terbentuk berhibridisasi dengan DNA cetakannya, menggantikan untai DNA non-cetakan (Gbr. 1 ). Meskipun awalnya dianggap sebagai produk sampingan transkripsi yang tidak normal, sekarang terbukti bahwa R-loop memiliki fungsi fisiologis dan patologis yang beragam [ [ 1 – 3 ] ]. Struktur ini mengatur ekspresi gen, mengoordinasikan pemrosesan RNA ko-transkripsi, memfasilitasi perbaikan DNA, dan berkontribusi pada pengurangan stres topologi [ [ 2 , 4 , 5 ] ]. Namun, R-loop yang belum terselesaikan dapat membahayakan integritas genom, yang menyebabkan stres replikasi dan kerusakan DNA, yang menggarisbawahi peran ganda mereka dalam homeostasis seluler [ [ 2 , 6 – 9 ] ].
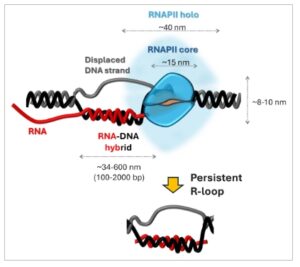
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Dimensi struktur R-loop relatif terhadap RNA polimerase II (RNAPII), dan relevansinya dengan genom virus dan inang. R-loop terbentuk ketika RNA berhibridisasi dengan untai DNA komplementer, yang biasanya mencakup ratusan pasangan basa, meskipun dalam beberapa konteks genomik, R-loop dapat memanjang hingga 2 kilobase (kb) panjangnya. Ini sesuai dengan kemungkinan rentang dari ~ 34 nanometer (nm) hingga lebih dari 600 nm. Struktur ini dapat muncul dalam genom virus dan inang dan dicirikan oleh fitur biokimia yang serupa dan ketergantungan pada mesin enzimatik yang sebanding. Untuk konteks spasial, enzim inti RNA Polimerase II (RNAPII) memiliki struktur kompak dengan panjang sekitar 15 nm dan tinggi 8 hingga 10 nm. Holoenzim, yang mencakup faktor transkripsi tambahan seperti Mediator dan TFIIH, berukuran lebih dari 40 nm dan memiliki massa molekul lebih dari 2 megadalton (MDa). Dalam kompleks RNAPII, gelembung transkripsi membentang sekitar 10 nm, dengan saluran masuk dan keluar DNA berukuran sekitar 2 nm dan saluran keluar RNA sedikit lebih lebar yaitu sekitar 3 nm. Perbandingan struktural ini menyoroti skala fisik R-loop relatif terhadap mesin transkripsi baik dalam konteks inang maupun virus.
R-loop tersebar luas di seluruh genom, terbentuk secara istimewa di daerah kaya G/C, di telomer, sentromer, dan dalam DNA mitokondria [ [ 10 – 13 ] ]. Mereka berfungsi sebagai pengatur penting transkripsi, memengaruhi inisiasi, elongasi, terminasi, dan modifikasi kromatin [ [ 2 , 11 , 14 ] ]. Khususnya, selama transkripsi sinyal poliA, pembelahan endonukleolitik RNA yang baru terbentuk menginduksi jeda kinetik yang memfasilitasi hibridisasi ulang fragmen RNA hulu dengan cetakan DNA, menghasilkan hibrida RNA–DNA yang stabil [ [ 7 , 15 , 16 ] ]. R-loop ini bertindak sebagai penghalang fisik yang mendorong disosiasi Pol II, memperkuat terminasi transkripsi. Lebih jauh lagi, mereka merekrut faktor terminasi seperti helicase senataxin (SETX), yang menyelesaikan hibrida RNA–DNA dan mencegah pembacaan transkripsi, sehingga menjaga stabilitas genom.
Dinamika R-loop selanjutnya dikendalikan oleh sejumlah enzim pemecah R-loop (resolvase) yang menjaga integritas genom. Enzim-enzim ini meliputi helikase seperti SETX, DDX5, DHX9, dan Aquarius, yang mengenali dan melepaskan hibrid RNA–DNA pada badan gen, terminator, dan urutan berulang [ [ 17 ] ]. Disfungsi atau penipisan enzim-enzim ini mengakibatkan akumulasi R-loop, perubahan transkripsi, stres replikasi, dan ketidakstabilan genom [ [ 18 ] ].
Studi terkini telah menyoroti fungsi nonkanonik penting dari penekan tumor p53 dalam mempertahankan homeostasis R-loop melalui regulasi transkripsi enzim pemecah R-loop utama. p53 telah terbukti meningkatkan regulasi transkripsi RNA helicase DDX5 bersama dengan mitra RNA sirkuler penstabilnya, circASCC3, sehingga mendorong penyelesaian R-loop dalam kondisi stres [ [ 19 ] ]. Lebih jauh lagi, p53 menekan pembentukan R-loop pada lokus kaya retrotransposon, termasuk elemen LINE1, yang cenderung menyebabkan ketidakstabilan genom [ [ 20 ] ]. Peran metabolik p53 juga berkontribusi pada regulasi R-loop dengan mempertahankan kadar tinggi S-adenosilmetionina (SAM), donor metil yang diperlukan untuk metilasi histon dan DNA yang memengaruhi stabilitas R-loop [ [ 21 ] ]. Gangguan fungsi p53—baik melalui mutasi atau penargetan virus—oleh karena itu dapat menyebabkan akumulasi R-loop yang meluas dan disregulasi transkripsi, seperti yang ditunjukkan pada sel yang ditransformasikan HPV di mana protein E6 virus mendorong pembentukan R-loop dengan mendegradasi p53 [ [ 22 ] ]. Hilangnya p53 ini tidak hanya mengganggu aktivitas penekan tumor kanoniknya tetapi juga mengganggu regulasi jalur penyelesaian R-loop. Akibatnya, R-loop terakumulasi terutama pada lokus gen imun bawaan dan situs poliadenilasi genom virus, berkontribusi pada penekanan imun dan mempertahankan lingkungan kromatin yang menguntungkan bagi persistensi dan replikasi virus. Temuan ini memperkuat konsep p53 sebagai simpul sentral dalam mesin seluler yang mencegah akumulasi R-loop patologis dan menjaga integritas genom.
Selain perannya dalam ekspresi gen, R-loop memediasi rekombinasi pergantian kelas imunoglobulin, kohesi sentromer, pemeliharaan genom mitokondria [ [ 2 , 23 ] ], dan bahkan penargetan CRISPR-Cas9 [ [ 24 ] ]. Namun, persistensi atau misregulasi mereka dikaitkan dengan gangguan transkripsi, stres replikasi, dan ketidakstabilan genom—fitur yang mendasari beberapa penyakit manusia, termasuk neurodegenerasi dan kanker [ [ 6 – 8 , 25 – 27 ] ].
Sementara peran R-loop dalam regulasi gen fisiologis semakin dipahami, keterlibatan mereka dalam infeksi virus dan patogenesis masih harus dijelaskan. Infeksi virus, khususnya yang melibatkan retrovirus dan virus DNA yang berintegrasi ke dalam atau berinteraksi dengan genom inang, diketahui mengubah lanskap transkripsi dan epigenetik [ [ 28 ] ]. Urutan retrovirus endogen, sisa-sisa infeksi kuno, telah digunakan kembali sebagai elemen pengatur dalam genom inang [ [ 29 ] ]. Beberapa virus memanipulasi mekanisme resolusi R-loop inang untuk meningkatkan replikasinya atau menghindari deteksi imun. Bukti terbaru menunjukkan bahwa R-loop dapat terbentuk secara istimewa pada promotor virus dan tempat integrasi, yang memengaruhi ekspresi gen dan latensi virus [ [ 13 , 22 ] ].
Lebih jauh lagi, virus dapat secara aktif memanipulasi enzim pemecah R-loop inang seperti SETX dan DDX5 untuk menekan ekspresi gen antivirus dan mengarahkan ulang jalur perbaikan DNA untuk memfasilitasi replikasinya [ [ 30 ] ]. Interaksi ini menunjukkan paradigma baru di mana virus memanfaatkan atau membentuk kembali dinamika R-loop untuk keuntungan evolusinya sendiri.
Di sini, kami mensintesiskan kemajuan terkini dalam memahami bagaimana virus berinteraksi dengan biologi R-loop. Sementara beberapa ide masih didorong oleh hipotesis, ide-ide tersebut didasarkan pada bukti eksperimental yang muncul. Secara khusus, kami menarik persamaan antara strategi virus di seluruh kelompok Baltimore, kelompok virus yang diklasifikasikan menurut jenis genom dan metode replikasi, dan mengusulkan cara baru untuk menyelidiki antarmuka koevolusi inang-patogen ini. Karena R-loop terletak di persimpangan kontrol transkripsi, pemeliharaan genom, dan kekebalan bawaan, memahami bagaimana virus terlibat dengan struktur R-loop dapat mengungkap target baru untuk intervensi antivirus.
R-loop dalam genom virus
Klasifikasi Baltimore membedakan tujuh kelompok virus berdasarkan tipe genom dan strategi replikasi (Gbr. 2 ), mulai dari virus DNA untai ganda (dsDNA), DNA untai tunggal (ssDNA), RNA untai ganda (dsRNA), dan RNA untai tunggal (ssRNA) dengan genom sense positif atau negatif. Meskipun mekanisme replikasinya berbeda, semua kelas virus secara inheren melibatkan pembentukan R-loop pada beberapa tahap dalam siklus hidupnya. Struktur ini muncul secara alami selama transkripsi virus, ketika untai RNA yang baru disintesis berhibridisasi dengan templat DNA komplementernya. Dalam beberapa kasus, R-loop yang dihasilkan transkripsi memainkan peran aktif dalam replikasi virus, terutama pada asal replikasi virus. Lebih jauh lagi, virus grup 6 dan grup 7 secara sementara memiliki genom hibrid RNA–DNA sebagai perantara wajib dalam siklus replikasinya, seperti retrovirus yang mengalami transkripsi balik dan hepadnavirus yang bergantung pada templat RNA untuk sintesis DNA. Pengamatan ini menunjukkan bahwa hibrida RNA–DNA sering kali merupakan perantara penting yang dimanfaatkan virus untuk replikasi dan persistensi genom yang efisien.
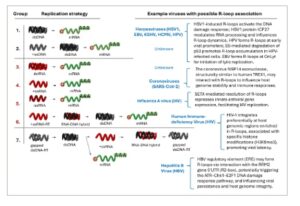
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Klasifikasi virus Baltimore dan contoh-contoh dengan asosiasi R-loop. Klasifikasi Baltimore mengkategorikan virus ke dalam tujuh kelompok berdasarkan jenis genom dan strategi replikasinya, khususnya bagaimana mereka menghasilkan mRNA. Sistem ini menyoroti keragaman mekanistik ekspresi gen virus. Virus Grup 1 memiliki genom DNA untai ganda (dsDNA). Transkripsi mRNA dilakukan dengan menggunakan RNA polimerase sel inang, yang dicontohkan oleh virus herpes dan adenovirus. Sebagai alternatif, virus memiliki RNA polimerase yang bergantung pada DNA sendiri, seperti virus pox. Virus Grup 2 memiliki genom DNA untai tunggal (ssDNA) yang pertama-tama harus diubah menjadi bentuk dsDNA sebelum transkripsi dapat terjadi, seperti yang terlihat pada parvovirus. Grup 3 mencakup virus RNA untai ganda (dsRNA), yang memerlukan RNA polimerase yang bergantung pada RNA sendiri untuk mentranskripsi mRNA dari genomnya, seperti yang diamati pada reovirus seperti rotavirus. Kelompok 4 terdiri dari virus RNA untai tunggal (+ssRNA) sense positif, yang genomnya dapat langsung diterjemahkan oleh ribosom inang, meskipun mereka bergantung pada RNA polimerase mereka sendiri yang bergantung pada RNA untuk replikasi, seperti pada virus korona, pikornavirus, dan flavivirus. Kelompok 5 mencakup virus RNA untai tunggal (−ssRNA) sense negatif yang pertama-tama mengubah genom mereka menjadi +ssRNA sebelum translasi, suatu proses yang difasilitasi oleh RNA polimerase mereka sendiri, karakteristik ortomiksovirus dan rhabdovirus. Kelompok 6 , retrovirus, seperti HIV-1, menggunakan transkriptase balik untuk mengubah genom +ssRNA mereka menjadi DNA untai ganda, yang kemudian terintegrasi ke dalam genom inang dan berfungsi sebagai cetakan untuk transkripsi. Virus Grup 7 , termasuk hepadnavirus seperti Hepatitis B, memiliki genom DNA bercelah (sebagian beruntai ganda) dan juga bergantung pada transkripsi balik (dari progenomik +ssRNA) sebagai bagian dari siklus replikasinya. Virus yang disorot dengan warna biru memiliki asosiasi yang diketahui atau yang diusulkan dengan struktur R-loop. Temuan utama yang terkait dengan koneksinya dengan R-loop dirangkum secara singkat dan dirinci lebih lanjut dalam teks utama.
Dalam beberapa virus DNA yang mereplikasi inti, terutama virus herpes, struktur R-loop semakin dikenal sebagai perantara replikasi fungsional. Analisis genom secara luas telah mengidentifikasi sekuens pembentuk R-loop dalam virus Epstein–Barr (EBV), virus herpes terkait sarkoma Kaposi (KSHV), dan virus sitomegalo manusia (HCMV) [ [ 31 , 32 ] ]. Dalam EBV, R-loop stabil terbentuk pada asal litik replikasi (OriLyt) [ [ 33 ] ] yang memungkinkan perekrutan protein pengikat DNA untai tunggal virus BALF2 untuk memulai sintesis DNA litik [ [ 8 ] ]. Gangguan pada R-loop ini oleh RNase H1 mengganggu replikasi, yang menggarisbawahi pentingnya mereka. Pertahanan host menargetkan R-loop ini: kompleks SMC5/6 mengikat R-loop OriLyt dan menekan replikasi dan ekspresi gen akhir, yang dihindari EBV dengan mengekspresikan BNRF1, yang mendegradasi SMC5/6, membebaskan OriLyt untuk replikasi produktif. Demikian pula, pada HCMV, R-loop distabilkan di OriLyt oleh lncRNA4.9 dan faktor replikasi virus UL84, yang mengikat struktur sekunder RNA untuk mengoordinasikan aktivasi asal [ [ 34 – 36 ] ]. Struktur ini tidak hanya memfasilitasi replikasi tetapi juga kemungkinan melindungi genom virus dari pengawasan host. Pada human papillomavirus (HPV), R-loop terbentuk di daerah promotor awal dan harus diselesaikan untuk mempertahankan status episomal genom virus. SETX diperlukan untuk resolusi ini, menyoroti interaksi yang dilestarikan antara metabolisme R-loop host dan persistensi virus [ [ 22 , 37 ] ]. Virus herpes lainnya, seperti HSV1 dan KSHV, mengkodekan protein yang memodulasi dinamika R-loop secara tidak langsung [ [ 38 ] ]. Protein HSV1 ICP27 dan KSHV ORF57 mengisolasi komponen kompleks ekspor mRNA TREX (TRanscription-Export), yang menyebabkan stres transkripsi, akumulasi R-loop, dan ketidakstabilan genom—fenomena yang dianggap meningkatkan ekspresi gen virus atau melewati pertahanan inang [ [ 39 ] ].
Retrovirus (Grup VI), seperti HIV-1 dan HTLV-1, secara inheren melibatkan hibrid RNA–DNA selama transkripsi balik, sebuah langkah penting untuk integrasi ke dalam genom inang [ [ 40 ] ]. Setelah terintegrasi, promotor virus yang kuat dalam pengulangan terminal panjang (LTR) mempromosikan aktivitas RNA polimerase II yang tinggi, menciptakan lingkungan transkripsi yang intens yang kondusif untuk pembentukan R-loop. Pada HIV-1, protein virus Tat (Trans-Activator of Transcription-1) memperkuat pemanjangan Pol II dan akumulasi R-loop di dekat LTR [ [ 41 ] ]. Yang penting, integrasi HIV-1 sering terjadi dalam gen transkripsi aktif yang diperkaya dengan R-loop, dengan Tat selanjutnya memperkuat transkripsi dan mempromosikan akumulasi R-loop di sekitar LTR [ [ 42 ] ] .
Pembentukan R-loop yang bergantung pada integrasi juga relevan untuk HPV, di mana integrasi virus mengganggu represor E2, menciptakan transkrip chimeric dan R-loop pada titik henti integrasi [ [ 22 , 43 ] ]. Pada hepadnavirus seperti virus hepatitis B (HBV) (Grup VII), integrasi DNA untai ganda parsial ke dalam kromosom inang umum terjadi pada infeksi kronis. Protein HBx onkogenik HBV mengubah jalur replikasi dan perbaikan inang, yang dapat bersinggungan dengan metabolisme R-loop [ [ 44 , 45 ] ]. Kehadiran R-loop dalam titik henti integrasi HBV atau DNA sirkular tertutup kovalen (cccDNA) masih belum pasti, tetapi dampak potensialnya pada persistensi virus memerlukan penyelidikan lebih lanjut. Mekanisme lain yang diusulkan menunjukkan bahwa ERE (Enhancer Regulatory Element) virus dapat melibatkan wilayah yang disebut kotak R2 untuk mendorong pembentukan R-loop [ [ 46 ] ]. R-loop ini, pada gilirannya, diketahui memicu respons kerusakan DNA melalui jalur ATR (ataxia telangiectasia dan Rad3-related), yang pada akhirnya mengaktifkan faktor-faktor hilir seperti checkpoint kinase Chk1 dan faktor transkripsi E2F1 [ [ 47 ] ]. Bersama-sama, kaskade pensinyalan ATR–Chk1–E2F1 ini membantu mengoordinasikan perbaikan DNA dan mempertahankan integritas genom. Meskipun masih hipotetis, mekanisme ini mengusulkan bahwa HBV dapat memanfaatkan pensinyalan yang dimediasi R-loop untuk memanipulasi siklus sel inang dan mesin perbaikan.
Selain virus eukariotik, bakteriofag juga menyediakan contoh eksploitasi R-loop yang menarik [ [ 48 , 49 ] ]. Pada fag T4, R-loop terbentuk di beberapa asal replikasi (oriA, oriE, oriF, oriG) dan penting untuk memulai replikasi DNA [ [ 49 ] ]. Struktur ini menciptakan daerah DNA untai tunggal untuk perekrutan mesin replikasi yang dikodekan oleh inang atau fag [ [ 50 ] ]. Demikian pula, fag ColE1 (colicin E1) menggunakan R-loop sebagai perantara penting selama replikasi DNA. Proses inisiasi melibatkan pembentukan R-loop di asal replikasi, di mana daerah yang tidak tergulung secara persisten distabilkan, memungkinkan sintesis untai DNA yang baru terbentuk secara efisien [ [ 51 ] ]. Dalam kasus fag T3 dan T7, studi in vitro telah menunjukkan bahwa RNA polimerase masing-masing dapat menghasilkan hibrid RNA–DNA yang stabil selama transkripsi [ [ 48 ] ]. Namun, penting untuk dicatat bahwa pembentukan hibrid tersebut tidak unik untuk polimerase virus ini. Sebaliknya, pembentukan hibrid RNA–DNA ditentukan oleh urutan dan fitur struktural cetakan DNA, seperti konten GC dan keberadaan motif tertentu. Ini menyoroti bahwa pembentukan R-loop adalah sifat umum transkripsi dalam konteks urutan yang kondusif, daripada fungsi khusus dari RNA polimerase tertentu.
Yang lebih mencolok lagi adalah peran R-loop dalam imunitas adaptif bakteri. Dalam sistem CRISPR-Cas Tipe I dan III, crRNA memandu protein Cas untuk membentuk R-loop pada target DNA fag, yang memungkinkan pembelahan spesifik sekuens [ [ 52 ] ]. Kehadiran R-loop dalam genom fag dapat membuat daerah gen tertentu lebih rentan terhadap penargetan yang dimediasi CRISPR [ [ 53 ] ]. Beberapa sistem CRISPR tipe III memperluas mekanisme ini dengan mendegradasi RNA dan DNA virus secara bersamaan, memanfaatkan R-loop untuk interferensi ganda [ [ 54 , 55 ] ]. Sebagai respons, fag telah mengembangkan protein anti-CRISPR yang menghalangi pembentukan R-loop atau mendegradasi crRNA, yang secara efektif menghindari pertahanan inang [ [ 56 ] ]. Interaksi evolusioner antara sistem imun inang dan genom virus telah membentuk arsitektur genom fag, dengan fag terus beradaptasi untuk meminimalkan akumulasi R-loop di daerah protospacer yang kritis. Perlombaan senjata ini terus mendorong koevolusi bakteri dan fag, memperkuat peran R-loop dalam mekanisme pertahanan genom [ [ 57 , 58 ] ].
Integrasi virus dan hotspot R-loop
Teknik pemetaan genom secara luas seperti DNA–RNA immunoprecipitation sequencing (DRIP-seq) [ [ 11 , 59 ] ] telah mengungkapkan bahwa R-loop terakumulasi terutama di daerah genom yang seringkali sangat aktif secara transkripsi. Karena integrase HIV dan integrase retrovirus lainnya cenderung menargetkan kromatin yang terbuka secara transkripsi, titik panas integrasi mungkin tumpang tindih dengan tempat yang rentan terhadap R-loop [ [ 41 , 42 ] ]. R-loop dapat memfasilitasi integrasi virus melalui berbagai mekanisme, termasuk kemampuannya untuk mengubah aksesibilitas kromatin [ [ 42 ] ], merekrut kompleks protein [ [ 60 , 61 ] ], dan meringankan stres topologi [ [ 5 ] ]. Dengan membuka kromatin dan memengaruhi status epigenetik lokal [ [ 4 ] ], R-loop menciptakan lingkungan yang dapat meningkatkan efisiensi integrasi [ [ 61 ] ]. Selain itu, integrase virus atau faktor pengikatnya, seperti LEDGF/p75 (lens epithelium-derived growth factor), dapat berkolokasi dengan kompleks protein terkait R-loop, yang selanjutnya memandu integrasi ke lokasi genomik tertentu [ [ 42 , 62 ] ]. Lebih jauh lagi, keberadaan R-loop dapat meredakan stres superkoil [ [ 5 ] ], yang membuat DNA lebih mudah diakses oleh integrase virus. Konflik antara transkripsi dan replikasi, yang sering bertepatan dengan akumulasi R-loop [ [ 63 ] ], juga dapat menyediakan lingkungan yang menguntungkan untuk integrasi virus, karena tempat-tempat ini rentan terhadap pemutusan untai sementara atau percabangan replikasi yang terhenti. Virus tertentu, seperti HTLV-1, dapat secara aktif mengganggu mekanisme perbaikan DNA, meningkatkan kemungkinan pemutusan DNA yang memfasilitasi penyisipan virus yang stabil [ [ 64 ] ].
Virus dan retrotransposon memiliki beberapa kesamaan struktural dan fungsional, termasuk LTR dan integrase [ [ 65 ] ]. Setelah terintegrasi ke dalam genom inang, elemen turunan virus ini dapat digunakan kembali untuk regulasi gen inang, berfungsi sebagai penambah atau promotor. Retrovirus endogen manusia (HERV) adalah sisa-sisa infeksi retrovirus purba yang tertanam dalam genom kita. Meskipun sebagian besar sekuens HERV dibungkam atau rusak, beberapa mempertahankan aktivitas transkripsi [ [ 66 ] ], dan LTR mereka mungkin rentan terhadap pembentukan R-loop. Transkripsi melalui LTR dapat menghasilkan RNA yang berhibridisasi kembali ke untai DNA komplementer, menghasilkan R-loop. Secara umum, elemen berulang dan transposabel seperti HERV menimbulkan tantangan bagi sel – resolusi R-loop yang tidak tepat di daerah berulang ini dapat menyebabkan tabrakan replikasi-transkripsi, kerusakan DNA, dan ketidakstabilan genom [ [ 67 ] ]. Dengan demikian, jika sekuens HERV ditranskripsi tanpa manajemen R-loop yang tepat, hal itu dapat membahayakan stabilitas genom lokal. Hal ini dapat menyebabkan insersi, delesi, atau rekombinasi pada lokus HERV atau gen tetangga, yang berpotensi berkontribusi terhadap penyakit atau evolusi genom. Ketika situs integrasi untuk HERV dimodifikasi secara epigenetik melalui metilasi DNA atau remodeling histon, akumulasi R-loop dapat lebih lanjut membentuk kembali lanskap epigenetik ini, yang mengarah pada pergeseran pola ekspresi HERV [ [ 29 , 68 ] ]. Hal ini menunjukkan bahwa R-loop pada sekuens retrovirus endogen [ [ 69 ] ] dapat memainkan peran yang lebih luas dalam mengatur ekspresi gen dalam genom mamalia.
Dalam ragi tunas eukariota uniseluler, R-loop telah diidentifikasi sebagai fitur signifikan retrotransposon Ty LTR [ [ 70 , 71 ] ]. Sementara secara fungsional analog dengan provirus retroviral, elemen Ty bereplikasi sepenuhnya secara intraseluler tanpa fase ekstraseluler. R-loop Ty ini menimbulkan pertanyaan menarik tentang apakah struktur nonkanonik ini memainkan peran yang dilestarikan dalam mengatur retroelemen lintas spesies. Salah satu kemungkinan adalah bahwa R-loop berfungsi sebagai agen penekan, membentuk penghalang fisik yang menghambat mesin transkripsi dan mengurangi ekspresi transposon. Selain itu, akumulasi mereka dapat mendorong pembentukan keadaan heterokromatik, yang mengarah pada pemadatan kromatin dan pembungkaman transkripsi, suatu mekanisme yang mengingatkan pada strategi represi retrotransposon yang diamati di seluruh genom eukariotik untuk menjaga stabilitas genom. Sebaliknya, R-loop dapat secara aktif meningkatkan aktivitas elemen Ty dengan menginduksi stres topologi lokal yang memfasilitasi peristiwa invasi untai, suatu langkah penting dalam sintesis cDNA dan integrasi retrotransposon. Dalam kapasitas ini, R-loop mungkin bukan produk sampingan insidental dari aktivitas transkripsi tinggi, melainkan perantara dinamis yang berkontribusi pada siklus hidup elemen Ty. Pengaruhnya dapat berfungsi sebagai sakelar pengatur, di mana konteks seluler menentukan apakah R-loop bertindak sebagai penghalang transposisi atau sebagai fasilitator mobilitas Ty. Peran ganda ini menunjukkan bahwa, melalui evolusi, pembentukan R-loop mungkin telah diadopsi untuk menyempurnakan keseimbangan antara propagasi transposon dan integritas genom, sehingga membentuk lanskap genom sebagai respons terhadap tekanan selektif.
Urutan virus yang memengaruhi gen inang dan elemen pengatur
Virus dan inang telah bertukar materi genetik sepanjang sejarah evolusi, yang mengarah ke contoh-contoh di mana sekuens virus memiliki homologi dengan gen inang atau sebaliknya [ [ 72 , 73 ] ]. Interaksi genetik ini telah berkontribusi pada berbagai fenomena biologis, seperti integrasi HPV ke dalam genom inang, di mana RNA virus dapat menyatu dengan transkrip manusia, berpotensi mengaktifkan onkogen atau menghasilkan transkrip chimeric [ [ 74 ] ]. Virus herpes juga telah mengembangkan protein yang menyerupai molekul inang, memungkinkan mereka untuk memodulasi respons imun. Dalam kasus KSHV, ekspresi homolog interleukin-6 (vIL-6) virus memungkinkan virus untuk meniru sitokin inang, mengubah sinyal imun dan berkontribusi pada persistensi virus [ [ 75 , 76 ] ]. Selain integrasi genetik langsung, elemen virus telah diadopsi oleh genom inang selama waktu evolusi, sebuah fenomena yang dicontohkan oleh retrotransposon asal virus yang telah memperoleh fungsi baru, seperti mengatur respons imun dan proses perkembangan [ [ 29 ] ].
Integrasi DNA virus dan ekspresi onkogen virus dapat menyebabkan ketidakstabilan genom, sebagian dengan mendorong akumulasi R-loop [ [ 77 ] ]. Akumulasi R-loop ini sebagian besar disebabkan oleh aksi onkoprotein virus. Misalnya, papillomavirus, seperti HPV, mengeksploitasi mekanisme genom host untuk membentuk infeksi persisten dan memfasilitasi transformasi seluler. Mekanisme baru yang digunakan HPV untuk menekan respons imun bawaan host melibatkan induksi R-loop yang ditargetkan pada lokus gen imun bawaan tertentu, terutama pada sel yang ditransformasi HPV. Studi terbaru telah menghubungkan fenomena ini dengan aktivitas onkoprotein HPV E6 dan E7, yang mendegradasi penekan tumor seperti p53, mengganggu homeostasis R-loop. Templeton dan Laimins [ [ 22 ] ] menunjukkan bahwa hilangnya fungsi p53 pada sel yang ditransformasi HPV berkorelasi dengan akumulasi R-loop yang meluas, yang mengimplikasikan p53 sebagai pengatur utama stabilitas hibrida RNA–DNA selama infeksi. Dalam studi lanjutan, Templeton dan Laimins [ [ 78 ] ] selanjutnya menunjukkan bahwa R-loop yang diinduksi HPV pada lokus gen imun bawaan menekan aktivasi transkripsi mereka, sehingga menumpulkan sinyal antivirus. Bersamaan dengan itu, struktur ini mengaktifkan jalur perbaikan kerusakan DNA—yang diadopsi oleh virus untuk memfasilitasi replikasi dan persistensinya. Menariknya, SETX memainkan peran ganda dalam biologi HPV; Jose et al . [ [ 37 ] ] melaporkan bahwa SETX bekerja langsung pada episom HPV untuk mengatasi R-loop terkait transkripsi, mempertahankan genom virus dalam keadaan episomalnya. Namun, pada sel yang ditransformasi HPV, interferensi virus dengan fungsi SETX dapat menyebabkan stabilisasi selektif R-loop pada lokus imun host, yang mendorong represi transkripsi berkelanjutan. Pelepasan fungsi SETX antara genom virus dan host ini menunjukkan strategi virus untuk melindungi episomnya sendiri sambil membungkam pertahanan host. Khususnya, dampak HPV pada jalur perbaikan kerusakan DNA host semakin memperkuat strategi regulasi ganda ini. Seperti yang ditunjukkan oleh Vats dan Laimins [ [ 79 ]], onkoprotein HPV menyusun ulang jaringan perbaikan DNA inang, yang memungkinkan pemeliharaan genom virus sembari menoleransi atau bahkan mendorong ketidakstabilan genom yang diinduksi R-loop pada sel inang. Selain mekanisme terkait kromatin ini, temuan terkini mengungkapkan bahwa HPV dapat menghasilkan struktur DNA ekstrakromosomal (ecDNA) hibrida manusia-virus yang bertindak sebagai penambah ampuh untuk mendorong ekspresi onkogen virus E6 dan E7. ecDNA hibrida ini diperkaya dalam karsinoma sel skuamosa orofaringeal dan dapat mendorong pertumbuhan tumor. Eksperimen fungsional menunjukkan bahwa penargetan elemen penambah ini—baik melalui interferensi CRISPR atau inhibitor BET—mengarah pada represi E6/E7 dan pengurangan nyata dalam proliferasi tumor [ [ 80 ] ]. Meskipun R-loop tidak dipelajari secara langsung dalam konteks ini, aktivitas transkripsi intens yang terkait dengan penambah ecDNA dan kapasitasnya untuk terlibat dengan mesin transkripsi inang meningkatkan kemungkinan bahwa pembentukan R-loop juga dapat terjadi di situs pengatur ini. Secara bersamaan, temuan-temuan ini mengungkap mekanisme canggih yang digunakan HPV untuk memanipulasi beberapa lapisan biologi genom—pembentukan R-loop, regulasi kromatin, dan aktivitas penambah ekstrakromosomal—untuk mengubah jalur pertahanan seluler menjadi platform replikasi virus dan pendorong perkembangan onkogenik [ [ 77 , 80 , 81 ] ].
EBV dan KSHV juga memodulasi sinyal host melalui protein seperti protein membran laten 1 (LMP1) dan antigen nuklir laten (LANA), yang mengganggu mekanisme regulasi seluler [ [ 82 – 84 ] ]. Onkogen virus ini juga dapat memengaruhi jalur resolusi R-loop, meningkatkan kemungkinan kerusakan untai ganda dan mutasi [ [ 9 ] ]. Selain efek langsung pada stabilitas genom, beberapa virus telah mengembangkan strategi mimikri molekuler, menghasilkan protein yang secara struktural atau fungsional menyerupai ligan host [ [ 75 , 85 ] ]. Dengan mengadopsi fitur seperti host ini, virus dapat menekan deteksi imun, memanipulasi jaringan pensinyalan sitokin, dan menumbangkan mekanisme pertahanan seluler [ [ 86 ] ]. vIL-6 KSHV, misalnya, sangat mirip dengan rekan selulernya, yang mendorong proliferasi sel dan penghindaran imun [ [ 87 , 88 ] ]. Demikian pula, cytomegalovirus (CMV) mengkode homolog interleukin-10 (IL-10) virus yang melemahkan respons inflamasi, sehingga memungkinkan virus untuk bertahan hidup di dalam tubuh inang [ [ 89 , 90 ] ].
Mimikri molekuler melampaui sitokin individu, meliputi berbagai strategi virus yang mengeksploitasi jalur regulasi inang [ [ 91 , 92 ] ]. Beberapa virus mengkode protein yang mengikat langsung ke DNA inang atau ko-regulator transkripsi, dengan demikian memprogram ulang jaringan transkripsi. Beta- dan gamma-herpesvirus, misalnya, menghasilkan homolog interleukin dan kemokin yang memengaruhi rekrutmen dan aktivasi sel imun [ [ 68 ] ]. Selain itu, virus RNA seperti virus influenza A (IAV) telah mengembangkan mekanisme canggih untuk mengganggu pensinyalan seluler inang, termasuk ekspresi peptida virus yang meniru modifikasi pasca-translasi seperti fosforilasi atau ubikuitilasi, dengan demikian mengganggu jalur yang mengatur kelangsungan hidup sel dan apoptosis [ [ 86 ] ]. Dalam sebuah studi penting, Miller et al . [ [ 30 ] ] menunjukkan bahwa selama infeksi IAV, SETX memainkan peran penting dalam memodulasi respons antivirus. Secara khusus, SETX menekan ekspresi gen yang distimulasi interferon (ISG) dengan menyelesaikan R-loop pada terminator transkripsi mereka, memfasilitasi pelepasan RNA polimerase II yang tepat dan mencegah aktivasi gen imun yang tidak tepat. Aktivitas ini tidak hanya melemahkan pensinyalan antivirus tetapi juga berkontribusi pada replikasi virus yang efisien, menunjukkan bahwa virus influenza dapat mengkooptasi mesin resolusi R-loop inang untuk mengoptimalkan lingkungan intraseluler mereka. Mendukung model ini, Rogan et al . [ [ 93 ] ] mengusulkan bahwa akumulasi RNA virus influenza yang bereplikasi dapat mengisolasi protein pengikat RNA inang (RBP), mengganggu resolusi R-loop dan menyebabkan persistensi hibrida RNA–DNA. Beban R-loop yang tidak terselesaikan ini dapat memicu respons kerusakan DNA dan apoptosis, yang berpotensi memperburuk patologi paru-paru selama infeksi berat. Bersama-sama, penelitian ini menyoroti metabolisme R-loop sebagai antarmuka penting dalam patogenesis virus influenza, membentuk penghindaran imun dan penyebaran virus.
Adaptasi virus sering kali memberikan keuntungan dengan mengganggu pengawasan imun, memodifikasi titik pemeriksaan siklus sel, dan mengatur ulang fungsi metabolisme. HIV-1 mencontohkan strategi ini melalui Tat, yang berinteraksi dengan faktor transkripsi inang untuk meningkatkan pemanjangan transkripsi [ [ 94 ] ]. Interaksi ini secara tidak sengaja meningkatkan pembentukan R-loop di dekat LTR virus, yang berkontribusi pada regulasi ekspresi gen dan latensi virus [ [ 95 ] ].
LTR retrovirus endogen telah diadopsi untuk mendorong ekspresi gen dalam sel imun dan plasenta [ [ 68 ] ]. Virus, pada gilirannya, sering memperoleh motif pengatur seperti inang yang meningkatkan replikasinya sendiri. Selama waktu evolusi, transposon telah berkontribusi pada evolusi genom [ [ 96 ] ] dengan memperkenalkan tempat pengikatan faktor transkripsi dan urutan seperti asal virus, yang kemudian diadopsi untuk regulasi gen spesifik jaringan atau respons stres [ [ 29 ] ]. Interaksi berkelanjutan antara virus, LTR, transposon [ [ 96 ] ], dan genom inang telah menyebabkan munculnya genom mosaik, di mana ‘transposon seperti virus’ mampu melintasi batas spesies [ [ 97 ] ].
Konsekuensi dari mimikri virus melampaui penghindaran imun dan kontrol transkripsi, karena protein virus yang sangat menyerupai antigen inang dapat memicu respons imun reaktif silang. Interaksi tersebut telah terlibat dalam penyakit autoimun, seperti yang terlihat pada infeksi virus hepatitis C (HCV), di mana mimotop virus memicu aktivasi imun yang abnormal [ [ 85 ] ]. Koronavirus juga dihipotesiskan mengkodekan mimik molekuler yang berkontribusi pada patologi autoimun [ [ 27 ] ]. Kehadiran R-loop dapat memperburuk efek ini lebih lanjut dengan bertindak sebagai pola molekuler terkait patogen (PAMP) atau pola molekuler terkait kerusakan (DAMP), yang menyebabkan peradangan kronis dan disregulasi imun. Jika R-loop berkontribusi pada ekspresi gen yang abnormal, akumulasi mereka dalam sel yang terinfeksi virus dapat lebih lanjut memperkuat disfungsi imun, memperkuat hubungan antara infeksi virus dan penyakit inflamasi atau autoimun [ [ 27 , 98 ] ].
Protein nonstruktural 14 (NSP14) virus corona SARS-CoV-2 adalah eksonuklease penting yang memastikan kesetiaan (aktivitas pemeriksaan) replikasi RNA virus corona [ [ 99 ] ]. Ia termasuk dalam keluarga eksonuklease DEDDh, yang dicirikan oleh motif DEEDh yang terkonservasi, yang mengoordinasikan ion logam yang penting untuk aktivitas katalitik. Fitur struktural ini membentuk hubungan evolusi antara NSP14 dan eksonuklease manusia TREX1 [ [ 100 ] ], yang menunjukkan kemungkinan tumpang tindih fungsional dalam metabolisme asam nukleat. TREX1, komponen utama kompleks THO/TREX (Transkripsi dan Ekspor), memainkan peran mendasar dalam resolusi R-loop [ [ 101 – 103 ] ]. Kompleks THO/TREX mengatur integritas transkripsi dengan memfasilitasi pemrosesan dan ekspor RNA, mencegah akumulasi hibrida RNA–DNA yang dapat menyebabkan ketidakstabilan genom. TREX1 berkontribusi pada proses ini dengan mendegradasi asam nukleat berlebih, termasuk hibrid RNA–DNA sitosol yang berasal dari nukleus [ [ 104 ] ], dengan demikian memastikan homeostasis R-loop yang tepat dan melindungi terhadap aktivasi imun. Homologi struktural antara TREX1 dan NSP14 menimbulkan pertanyaan apakah NSP14 dapat terlibat dengan struktur R-loop, baik untuk memfasilitasi replikasi virus atau untuk memodulasi metabolisme asam nukleat inang. Karena virus sering membajak proses seluler inang untuk mengoptimalkan siklus replikasinya, dapat dibayangkan bahwa NSP14 dapat berinteraksi dengan hibrid RNA–DNA dengan cara yang memengaruhi stabilitas genom virus atau regulasi transkripsi. Selain itu, NSP14 berpotensi mengganggu pemrosesan R-loop untuk menumbangkan jalur antivirus inang. Dengan meniru aspek fungsi TREX1, NSP14 dapat mengubah regulasi R-loop, memengaruhi ekspresi gen inang atau memodulasi pensinyalan imun dengan cara yang mendukung persistensi virus. Meskipun bukti langsung keterlibatan NSP14 dalam metabolisme R-loop masih harus ditetapkan, hubungan evolusionernya dengan TREX1 dan peran pentingnya dalam pemrosesan asam nukleat virus memberikan alasan kuat untuk penyelidikan lebih lanjut.
R-loop sebagai pengatur epigenetik ekspresi gen virus dan inang
Di luar peran mereka dalam ketidakstabilan genom, R-loop dapat bertindak sebagai pengatur epigenetik dinamis yang membentuk arsitektur kromatin dan ekspresi gen. Semakin banyak penelitian telah menunjukkan bahwa R-loop dapat mempromosikan atau menekan transkripsi tergantung pada konteks genomik dan fitur kromatin terkait. Misalnya, Sanz et al . [ [ 105 ] ] menunjukkan bahwa R-loop lebih disukai diperkaya pada promotor gen dan berkorelasi dengan tanda histon aktif seperti H3K4me3, yang menunjukkan peran dalam mempertahankan kromatin yang kompeten secara transkripsi. Demikian pula, Grunseich et al . [ [ 106 ] ] melaporkan bahwa hilangnya SETX mengakibatkan metilasi DNA yang abnormal pada promotor gen, yang menunjukkan bahwa R-loop dapat mencegah pembungkaman dengan memblokir akses DNA metiltransferase.
Secara mekanistis, R-loop dapat bertindak sebagai perancah untuk kompleks pengubah kromatin. Arab et al . [ [ 107 ] ] mengungkapkan bahwa faktor respons stres GADD45A mengikat R-loop dan merekrut TET1 untuk mendemetilasi pulau CpG, yang memodulasi program ekspresi gen. Selain itu, demetilasi histon, seperti hilangnya H3K9me2, dapat menginduksi akumulasi R-loop dan dikaitkan dengan disorganisasi kromatin, seperti yang ditunjukkan oleh Zhou et al . [ [ 108 ] ]. Pada sel pluripoten, R-loop telah terbukti berkoordinasi dengan faktor transkripsi kunci seperti SOX2 untuk mengatur pemrograman ulang [ [ 109 ] ] yang menekankan perannya dalam regulasi gen perkembangan. Struktur ini juga terkait dengan penghentian transkripsi melalui interaksi dengan RNA yang dimodifikasi m6A dan motif DNA yang condong ke GC yang mendukung pembentukan hibrida [ [ 110 , 111 ] ].
Penelitian terbaru lebih lanjut mendukung model di mana R-loop sensitif terhadap modifikasi pasca-translasi protein pengatur R-loop. Misalnya, metilasi DDX5 yang dimediasi PRMT5 memengaruhi resolusi hibrida dan aksesibilitas kromatin [ [ 112 ] ]. Khususnya, Rakshit et al . [ [ 113 ] ] menunjukkan bahwa disregulasi program epigenetik terkait R-loop berkontribusi pada fenotipe penyakit seperti kanker dan gangguan kardiovaskular, yang menyoroti relevansi fungsional struktur ini dalam konteks fisiologis dan patologis.
Dengan menggabungkan temuan-temuan ini ke dalam kerangka interaksi virus-inang, menjadi jelas bahwa virus yang memanfaatkan dinamika R-loop juga dapat memanipulasi status epigenetik inang. Misalnya, akumulasi R-loop yang diinduksi virus pada lokus gen imun—seperti yang didokumentasikan dalam sel yang terinfeksi HPV [ [ 78 ] ]—dapat memperkuat pembungkaman transkripsi melalui jalur epigenetik, yang berkontribusi pada penghindaran imun.
R-loop telah terlibat dalam modulasi metilasi DNA represif melalui dua mekanisme yang berlawanan. Di satu sisi, mereka dapat menghambat metilasi dengan secara fisik mencegah DNA metiltransferase (DNMT) dari mengikat pulau CpG, dengan demikian mempertahankan promotor dalam keadaan aktif atau siap [ [ 11 , 106 ] ]. Di sisi lain, R-loop persisten dapat menyebabkan kerusakan DNA, memicu jalur perbaikan yang secara tidak sengaja menyebabkan hipermetilasi daerah genom di dekatnya [ [ 26 ] ]. Banyak virus, termasuk EBV, HPV, dan HBV, mengalami metilasi yang didorong oleh inang dari DNA virus terintegrasi dan episomal, yang memainkan peran penting dalam mengatur ekspresi gen selama keadaan infeksi laten dan kronis [ [ 44 , 114 ] ]. Kehadiran R-loop di dekat promotor atau enhancer virus dapat mengganggu perekrutan DNMT, sehingga gen virus tetap aktif secara transkripsi atau memfasilitasi reaktivasi dalam kondisi seluler tertentu [ [ 115 ] ]. Sebaliknya, beberapa virus secara aktif merekrut atau memanipulasi DNMT untuk membungkam ekspresi gen mereka sendiri, sebuah strategi yang memungkinkan mereka untuk menghindari deteksi imun [ [ 116 ] ].
Sementara bukti langsung yang menghubungkan modifikasi histon dengan regulasi R-loop pada sel yang terinfeksi virus masih terbatas, beberapa penelitian memberikan wawasan tentang mekanisme potensial. Misalnya, pada infeksi HIV-1, virus lebih memilih untuk mengintegrasikan genomnya ke dalam wilayah genom inang yang diperkaya dengan R-loop, yang juga terkait dengan tanda histon represif, yang memfasilitasi latensi provirus [ [ 117 ] ]. Dalam konteks virus herpes simpleks (HSV), genom virus yang masuk dengan cepat dikromatinisasi melalui interaksi dengan badan inti leukemia promielositik (PML-NB), tempat chaperone histon inang seperti DAXX dan ATRX menyimpan histon H3.3 ke dalam DNA virus, yang mendorong pembentukan heterokromatin dan pembungkaman gen segera-dini [ [ 118 ] ]. Proses ini terkait dengan modifikasi histon represif dan kemungkinan bersinggungan dengan regulasi R-loop pada lokus terkait latensi.
Pada sel yang tidak terinfeksi, modifikasi histon terkait erat dengan dinamika R-loop. Misalnya, asetilasi histon oleh PCAF meningkatkan resolusi R-loop dengan mendorong perekrutan atau aktivitas helikase RNA–DNA; hilangnya PCAF menyebabkan peningkatan akumulasi R-loop dan ketidakstabilan genom [ [ 119 ] ]. Temuan ini menunjukkan bahwa virus dapat secara tidak langsung mengeksploitasi atau mengganggu jalur modifikasi histon inang untuk mengatur pembentukan dan resolusi R-loop, sehingga memengaruhi replikasi virus, ekspresi gen, dan latensi.
Hubungan antara jalur interferensi RNA (RNAi) dan biologi R-loop masih merupakan bidang studi yang baru muncul. Sementara siRNA antivirus kanonik biasanya berasal dari prekursor RNA untai ganda [ [ 120 ] ], kemungkinan bahwa hibrida RNA–DNA dapat berinteraksi dengan mesin RNAi masih dalam penyelidikan. Khususnya, penelitian kami sebelumnya menunjukkan bahwa siRNA heterokromatik (het-siRNA) tertentu dapat memandu rekrutmen RNA spesifik urutan ke kromatin, di mana mereka mempromosikan pembentukan R-loop dan pembungkaman transkripsi melalui pemasangan homolog dengan lokus genom [ [ 12 ] ]. Mekanisme ini menunjukkan bahwa RNA kecil dapat, dalam kondisi kromatin tertentu, memperkuat stabilitas R-loop dan berkontribusi pada regulasi epigenetik.
Peran RNAi dalam pertahanan antivirus bervariasi di antara spesies. Pada tumbuhan, perantara replikasi virus dapat diperkuat oleh RNA polimerase yang bergantung pada RNA (RdRp), yang meningkatkan penekanan virus yang dimediasi siRNA [ [ 121 ] ]. Pada serangga, respons RNAi yang kuat berkontribusi pada kekebalan antivirus, dengan beberapa transkrip virus membentuk R-loop yang berfungsi sebagai prekursor untuk produksi siRNA [ [ 122 ] ]. Meskipun sel mamalia lebih bergantung pada respons interferon daripada RNAi untuk pertahanan antivirus, virus tertentu, seperti HCV dan influenza, tetap rentan terhadap penghambatan yang dimediasi siRNA eksogen, yang mungkin berasal dari struktur seperti R-loop parsial dalam sel yang terinfeksi [ [ 123 ] ].
Untuk melawan RNA silencing, virus telah mengembangkan berbagai penekan RNAi yang mengganggu respons antivirus inang. Misalnya, CMV mengkodekan protein 2b, sementara virus corona mengekspresikan protein N, yang keduanya mengikat struktur dsRNA atau mirip R-loop untuk memblokir aktivitas Dicer atau RISC [ [ 124 , 125 ] ]. Konflik molekuler yang sedang berlangsung ini menggambarkan perlunya virus untuk memanipulasi atau menetralkan strategi imun yang terkait dengan R-loop untuk membangun infeksi yang berhasil dan mempertahankan latensi.
Potensi terapeutik interaksi virus-R-loop
Potensi terapeutik penargetan R-loop dalam konteks infeksi virus dan latensi menghadirkan area penelitian dengan implikasi klinis yang cukup besar. Jika R-loop berkontribusi pada pembungkaman virus dengan bertindak sebagai penghalang fisik atau dengan merekrut pengubah kromatin represif pada LTR retrovirus terintegrasi, maka penyelesaian struktur ini berpotensi membalikkan latensi dan mengaktifkan kembali transkripsi virus yang tidak aktif. Strategi yang ditujukan untuk memodulasi pembentukan R-loop, seperti penambah RNase H atau aktivator helicase molekul kecil, dapat berfungsi sebagai kelas baru agen pembalik latensi (LRA) yang mampu mengganggu dormansi virus dan membuat sel yang terinfeksi rentan terhadap pembersihan imun [ [ 126 ] ]. Namun, tantangan kritis dalam mengembangkan strategi terapeutik ini adalah membedakan R-loop yang berasal dari virus dari R-loop inang untuk menghindari ketidakstabilan genom yang tidak diinginkan atau gangguan proses seluler yang penting.
Salah satu pendekatan yang mungkin untuk mencapai spesifisitas adalah dengan memanfaatkan pengenalan spesifik urutan lokasi integrasi virus atau urutan genom virus. Genom virus, termasuk urutan retrovirus terintegrasi, sering kali mengandung motif nukleotida unik atau konteks struktural yang berbeda dari daerah genom inang. Oleh karena itu, penargetan yang tepat dari R-loop virus dapat dicapai dengan merancang alat berbasis CRISPR, seperti dCas9 yang digabungkan dengan domain RNase H atau enzim helicase, yang diarahkan secara khusus ke lokus integrasi virus. Selain itu, kemajuan terkini dalam teknologi pembuatan profil R-loop di seluruh genom, seperti pendekatan DRIP-seq dan sekuensing molekul tunggal, memfasilitasi identifikasi tanda tangan R-loop virus unik yang berbeda dalam panjang, stabilitas, dan komposisi nukleotida dari R-loop inang.
Selain itu, sistem CRISPR baru yang mampu merasakan pembentukan R-loop dalam cara yang bergantung pada urutan dan konteks menawarkan peluang lebih lanjut untuk spesifisitas. Misalnya, Hu et al . mengidentifikasi varian CRISPR-Cas3 Tipe IA dari Thermococcus siculi yang diaktifkan secara selektif oleh pembentukan R-loop, bergantung pada motif berdekatan protospacer (PAM) dan urutan pengenalan protospacer tertentu [ [ 127 ] ]. Properti ini dapat dimanfaatkan untuk secara selektif menargetkan R-loop virus dengan merekayasa RNA pemandu yang mengenali urutan spesifik virus, sehingga meminimalkan efek di luar target pada struktur kromatin inang. Sistem mereka menunjukkan pengenalan yang diperluas (PAM), intoleransi ketidakcocokan yang ketat, dan mode aktivasi ganda yang responsif terhadap target DNA dan RNA. Memanfaatkan karakteristik ini, para peneliti mengembangkan Hyper-Active-Verification Establishment (HAVE), yang memungkinkan diagnosis HPV yang cepat dan tepat dalam sampel klinis.
HERV, meskipun tidak menular, lebih jauh menggambarkan kompleksitas terapeutik. R-loop yang berasal dari HERV dapat mengancam stabilitas genom dan berpotensi melibatkan jalur imun, menggarisbawahi pentingnya membungkam elemen-elemen ini dengan ketat dalam kondisi normal. Reaktivasi ekspresi HERV (misalnya dengan demetilasi dalam terapi kanker atau penyakit autoimun) menghasilkan RNA dan protein seperti virus yang dapat memicu imunitas bawaan. RNA untai ganda dari transkripsi HERV konvergen dapat mengaktifkan sensor imun seperti MDA5 atau TLR3. R-loop dari transkrip HERV mungkin juga dirasakan saat akumulasi. Meskipun bukti langsung dari R-loop yang memicu respons imun dalam konteks HERV terbatas, secara analogi, setiap hibrida RNA-DNA sitosolik yang berasal dari DNA HERV dapat dideteksi oleh reseptor pengenalan pola. R-loop yang tidak terselesaikan dapat menyebabkan fragmen DNA untai tunggal atau hibrida RNA-DNA dalam sitoplasma, yang bersifat imunogenik [ [ 104 ] ]. Agen farmakologis seperti modulator epigenetik atau teknik interferensi CRISPR dapat digunakan untuk memodulasi elemen-elemen ini, sehingga merangsang pertahanan antivirus atau mengekspos protein virus untuk pengenalan dan pembersihan imun [ [ 68 ] ]. Peningkatan ekspresi HERV-K secara selektif telah dieksplorasi sebagai cara untuk meningkatkan jalur imun antivirus [ [ 128 ] ]; namun, pendekatan ini memerlukan optimasi yang cermat untuk menyeimbangkan manfaat potensial dari reaktivasi virus dan pembersihan imun terhadap risiko yang terkait dengan peningkatan ketidakstabilan genom.
Selain itu, modulator epigenetik, termasuk inhibitor DNMT (misalnya, 5-azacytidine) atau inhibitor histone deacetylase (HDAC), telah dievaluasi sebagai strategi pembalikan latensi virus, misalnya, dalam konteks terapi ‘shock and kill’ HIV, di mana reaktivasi promotor virus laten diinduksi untuk mengekspos sel yang terinfeksi terhadap pembersihan imun [ [ 129 ] ]. Strategi terapi di masa depan dapat mengeksplorasi cara untuk secara efektif memanfaatkan interaksi virus-R-loop sebagai kerentanan terapeutik.
Kesimpulan dan perspektif
Pemahaman kita yang berkembang tentang biologi R-loop membentuk kembali perspektif dalam virologi, imunologi, dan struktur genom. Daripada menjadi produk sampingan transkripsi belaka, R-loop memainkan peran penting dalam mengatur ekspresi gen virus dengan memodulasi aksesibilitas promotor dan enhancer, khususnya dalam LTR retrovirus. Kehadiran mereka memengaruhi pola integrasi virus, karena integrase virus sering kali lebih menyukai kromatin aktif transkripsi terbuka yang diperkaya dalam R-loop [ [ 42 ] ]. Selain itu, R-loop berpotongan dengan pertahanan antivirus inang, berfungsi sebagai substrat untuk interferensi CRISPR pada prokariota dan sebagai pemicu RNAi pada sel eukariotik [ [ 54 , 130 , 131 ] ]. Di luar kontrol transkripsi, struktur ini berkontribusi pada regulasi epigenetik dengan berinteraksi dengan metilasi DNA, modifikasi histon, dan mekanisme perbaikan kerusakan DNA [ [ 106 , 107 , 132 ] ]. Interaksi evolusi antara virus, transposon, dan gen inang juga dibentuk oleh R-loop, karena elemen transposabel dan retrovirus endogen sering kali tergabung dalam jaringan regulator inang.
Interaksi antara virus dan pembentukan R-loop inang menghadirkan tantangan ganda. Genom virus sering memanfaatkan relaksasi kromatin yang diinduksi R-loop untuk integrasi atau peningkatan transkripsi [ [ 42 ] ], namun mekanisme imun inang dapat memanfaatkan R-loop untuk mendeteksi dan mendegradasi RNA virus [ [ 130 ] ]. Lebih jauh lagi, beberapa virus meniru protein inang yang terlibat dalam resolusi R-loop, membajak helikase dan RNase untuk memfasilitasi replikasinya atau menghindari deteksi imun. Implikasi klinis dari temuan ini sangat mendalam, menunjukkan aplikasi potensial dalam menyempurnakan strategi pembalikan latensi HIV [ [ 133 – 136 ] ], meningkatkan pengenalan imun terhadap virus herpes laten atau virus onkogenik, dan memanipulasi penambah yang berasal dari transposon atau virus untuk meningkatkan imunitas antivirus. Namun, beberapa pertanyaan tetap ada mengenai spesifisitas tipe sel dari dinamika R-loop dan bagaimana virus yang berbeda memodulasi resolusi R-loop atau berkontribusi pada ketidakstabilan genom.
Sementara hubungan antara R-loop dan ketidakstabilan genom sudah mapan, penelitian terbaru menunjukkan bahwa virus dapat memanfaatkan struktur ini sebagai simpul pengatur untuk memprogram ulang ekspresi gen inang dan respons kerusakan DNA. Virus tampaknya memanipulasi pembentukan dan resolusi R-loop di lokus gen inang, terutama yang terlibat dalam kekebalan antivirus dan pemeliharaan genom, memberikan keuntungan selektif yang meningkatkan kelangsungan hidup dan perkembangbiakannya. Salah satu mekanisme utama yang digunakan virus untuk mencapai kontrol ini adalah dengan menargetkan mesin seluler yang bertanggung jawab atas resolusi R-loop, yang sangat bergantung pada mesin seluler inang, termasuk RNase H, helikase seperti SETX atau famili DDX (helikase DEAD-box), topoisomerase, dan jalur perbaikan DNA yang melibatkan protein anemia Fanconi dan sumbu BRCA1/2 [ [ 60 ] ]. Virus sering berinteraksi dengan atau memanipulasi jalur yang sama ini, terkadang mengadopsinya untuk replikasi, integrasi genom, atau penghindaran imun [ [ 137 ] ]. Misalnya, SETX, yang biasanya menyelesaikan R-loop untuk menjaga stabilitas transkripsi dan genomik, dibajak selama infeksi virus influenza A untuk membatasi ekspresi gen antivirus inang dengan menekan gen yang terstimulasi interferon [ [ 30 ] ].
Selain itu, virus tampaknya memanipulasi faktor-faktor terkait kromatin yang memengaruhi pembentukan R-loop. HIV-1, misalnya, terintegrasi ke dalam daerah genom yang diperkaya dengan urutan pembentuk R-loop dan modifikasi histon represif, yang mendukung pembentukan keadaan laten, transkripsi diam yang memungkinkan persistensi jangka panjang. Dalam kasus virus herpes, tanda heterokromatin terkait R-loop yang disimpan oleh DAXX dan ATRX berkontribusi pada pembungkaman gen segera-dini selama latensi [ [ 117 , 118 ] ]. Temuan ini menunjukkan bahwa R-loop mungkin secara strategis ditargetkan oleh virus tidak hanya untuk membungkam respons antivirus tetapi juga untuk memodulasi keadaan epigenetik yang kondusif untuk latensi dan reaktivasi.
Hubungan evolusi antara retrovirus endogen, transposon, dan virus eksogen menyoroti sejarah panjang pertukaran genetik antara inang dan urutan virus. Interaksi ini telah menyebabkan siklus integrasi virus yang berulang, domestikasi parsial melalui aktivasi retrovirus endogen (ERV), dan adaptasi inang yang ditujukan untuk melawan ancaman virus. Kemampuan struktur R-loop untuk mendorong penataan ulang genom dan memengaruhi jaringan pengatur menunjukkan bahwa mereka dapat berfungsi sebagai katalis dalam proses evolusi ini [ [ 68 ] ].
Secara keseluruhan, bukti di atas mendukung model di mana virus memanfaatkan R-loop sebagai ancaman sekaligus alat: mendorongnya untuk mengacaukan wilayah genom tertentu atau membungkam gen kunci, sekaligus merekrut faktor resolusi untuk mencegah ketidakstabilan genom yang merugikan. Dengan demikian, regulasi dinamis R-loop merupakan antarmuka penting dalam koevolusi virus-inang, yang memungkinkan pemrograman ulang fungsi sel inang secara tepat untuk melayani kebutuhan virus.
Semakin berkembangnya pengetahuan seputar R-loop menawarkan arah baru yang menjanjikan untuk intervensi terapeutik. Meskipun menggabungkan modulator R-loop dengan obat epigenetik, seperti inhibitor HDAC atau DNMT, telah menunjukkan efektivitas awal dalam pengaturan eksperimental, penelitian tambahan diperlukan untuk sepenuhnya memahami ruang lingkup dan keterbatasan strategi ini [ [ 22 , 136 , 138 ] ]. Misalnya, inhibitor HDAC telah menunjukkan keberhasilan awal dalam mengekspos virus laten, seperti HIV dan EBV, terhadap pembersihan imun in vitro ; namun, kemanjuran klinis masih bervariasi, yang menekankan perlunya validasi dan pengoptimalan yang cermat sebelum mempertimbangkan pendekatan ini untuk penerapan klinis.
Selain itu, memanfaatkan RNA untai ganda turunan R-loop untuk amplifikasi RNAi antivirus pada tumbuhan, serangga, atau bahkan sel mamalia dapat menawarkan strategi antivirus baru [ [ 98 ] ]. Potensi interferensi CRISPR dalam menargetkan wilayah genom virus yang rentan terhadap R-loop juga dapat dieksplorasi, dengan mengambil inspirasi dari mekanisme pertahanan bakteri yang memanfaatkan R-loop untuk memandu penargetan nuklease [ [ 139 ] ].
Singkatnya, dari interaksi bakteriofag-bakteri hingga integrasi retrovirus dalam sel T manusia, R-loop muncul sebagai antarmuka molekuler fundamental yang mengatur transkripsi, memengaruhi beban virus, dan membentuk kekebalan inang. Meskipun dapat berfungsi sebagai elemen pengatur, R-loop yang belum terselesaikan juga menimbulkan risiko signifikan dengan berkontribusi pada ketidakstabilan genom dan kerusakan DNA. Memahami bagaimana virus membentuk, memanfaatkan, atau menetralkan R-loop akan menjadi penting bagi virologi dasar dan pengembangan terapi antivirus generasi berikutnya, meningkatkan kemampuan untuk mengendalikan latensi virus, meningkatkan pembersihan imun, dan mencegah ketidakstabilan genom yang disebabkan oleh virus.