Abstrak
Mikroskopi krio-elektron telah menghasilkan data struktural beresolusi tinggi dari transporter efluks multiobat P-glikoprotein (ABCB1), tetapi interaksi langsung dan tidak langsungnya dalam lingkungan membran asli sebagian besar masih belum dieksplorasi. Di sini, kami membandingkan gradien fluiditas membran plasma dari garis sel CHO yang peka terhadap obat AuxB1 dan turunan P-glikoproteinnya yang mengekspresikan B30 secara berlebihan melalui anisotropi fluoresensi dari probe asam lemak n- (9-antroiloksi) yang tertanam ( n = 2, 7, 9, 12, 16) dalam kisaran suhu 10–50 °C. Bentuk profil suhu mobilitas probe sebanding dalam membran AuxB1 dan B30, tetapi tidak cocok. Ekspresi berlebih glikoprotein P memperhalus gradien transversal dari mode putaran luar bidang probe, yang dapat memfasilitasi pembagian obat hidrofobik ke dalam membran dan dengan demikian meningkatkan kecepatan glikoprotein P untuk memompa obat keluar dari sel.
Singkatan
12-AS , 12-(9-antroiloksi)asam stearat
16-AP , 16-(9-antroiloksi)asam palmitat
2-AS , 2-(9-antroiloksi)asam stearat
7-AS , 7-(9-antroiloksi)asam stearat
9-AS , 9-(9-antroiloksi)asam stearat
ABC , kaset pengikat ATP
ABCB1 , anggota subfamili ABC B 1
CHO , ovarium hamster Cina
cryo-EM , mikroskopi kriogenik elektron
DPPC , dipalmitoilgliserofosfokolin
NBD , domain pengikat nukleotida
TM , domain transmembran
Transporter kaset pengikat ATP (ABC) ABCB1 (UniProt no P08183 ) yang awalnya diberi nama P-glikoprotein [ [ 1 ] ] mentranslokasi obat dan fosfolipid melintasi membran [ [ 2 – 4 ] ]. P-glikoprotein adalah transporter multiobat polispesifik yang terlibat dalam pembersihan xenobiotik pada mamalia dan terlibat dalam resistensi kanker terhadap kemoterapi [ [ 3 ] ].
Glikoprotein P adalah transporter ABC subfamili Tipe I B [ [ 5 ] ] dengan setiap domain transmembran (TM) terdiri dari enam heliks transmembran dan diikuti oleh domain pengikat nukleotida sitosol (NBD) [ [ 4 ] ]. Mikroskopi krio-elektron (cryo-EM) dari protein terisolasi yang direkonstitusi mengungkapkan bahwa glikoprotein P membentuk konformasi berbeda yang terkait dengan ada atau tidaknya ligan dan/atau ATP [ [ 4 , 6 – 10 ] ]. Studi krio-EM yang paling baru diterbitkan [ [ 4 ] ] dapat membedakan glikoprotein P dalam keadaan tidak terikat (apo), glikoprotein P dalam keberadaan ATP/Mg 2+ , dan glikoprotein P dalam keadaan terikat substrat dan terikat inhibitor, masing-masing. Menurut data ini, konformasi glikoprotein P tanpa substrat dan ATP (apo-ABCB1) menunjukkan keadaan tertutup menghadap ke dalam dengan NBD yang berjarak dekat dan jalur TMD tertutup di bagian tengah [ [ 4 ] ]. Setelah pengikatan substrat, glikoprotein P bergeser ke keadaan terbuka menghadap ke dalam dengan pemisahan NBD yang lebih besar yang memfasilitasi pengikatan ATP dan ekstrusi substrat berikutnya melalui konformasi terbuka menghadap ke luar. Sebaliknya, setelah pengikatan inhibitor, glikoprotein P bergeser ke konformasi tersumbat menghadap ke dalam, sehingga menghambat siklus transpor [ [ 4 ] ].
Studi mikroskopi krio-elektron menghasilkan data struktural beresolusi tinggi dari glikoprotein P dalam lingkungan lipid yang ditentukan; namun, interaksi antara lingkungan membran dan konformasi glikoprotein P baru-baru ini menjadi isu yang muncul dalam biologi struktural dan simulasi dinamika molekuler [ [ 4 , 11 ] ]. Studi biokimia dan biofisika sebelumnya telah menunjukkan bahwa komposisi lipid membran memodulasi fungsi glikoprotein P, termasuk hidrolisis ATP, pengikatan obat, dan transpor obat (dirangkum dalam ref. [ [ 12 , 13 ] ]). Di sisi lain, ekspresi berlebihan glikoprotein P harus memengaruhi sifat membran plasma. Misalnya, glikoprotein P menyumbang sekitar 20% dari kandungan protein membran plasma dari garis sel CHO yang resistan terhadap banyak obat CH R B30 [ [ 14 , 15 ] ]. Penelitian awal mengenai partisi probe fluoresen merosianin 540 di membran plasma CH R B30 menunjukkan bahwa pengemasan molekul lipid di lapisan luar meningkat seiring dengan meningkatnya kadar P-glikoprotein [ [ 16 ] ]. Demikian pula, ketika P-glikoprotein yang dimurnikan dari sel CH R B30 dimasukkan ke dalam liposom, hal tersebut memodulasi partisi analog lipid fluoresen [ [ 17 ] ].
Sejak penemuannya dalam sel CHO yang resistan terhadap banyak obat [ [ 1 ] ], fitur glikoprotein P telah dipelajari secara ekstensif selama beberapa dekade terakhir. Namun, pengetahuan kita tentang dampak ekspresi berlebihan glikoprotein P pada keadaan fisik membran plasma masih terbatas [ [ 13 ] ]. Untuk mengatasi masalah ini, kami memilih lini sel CHO yang peka terhadap obat AuxB1 dan turunannya yang resistan terhadap banyak obat CH R B30, karena AuxB1 dan CH R B30 memiliki komposisi protein dan lipid yang sama dalam membran plasma [ [ 1 , 14 , 18 , 19 ] ], perbedaan jumlah glikoprotein P menjadi satu-satunya perbedaan mereka. Dengan menerapkan serangkaian probe asam lemak n- (9-anthroyloxy) fluoresensi sebagai penggaris molekuler [ [ 20 ] ], kami membandingkan lingkungan mikro membran AuxB1 dan CH R B30 pada serangkaian kedalaman yang bergradasi dari permukaan ke pusat lapisan ganda. Rotasi dalam bidang dan luar bidang dari cincin anthroyl diambil sebagai parameter ‘fluiditas’ membran [ [ 21 ] ]. Pengukuran anisotropi fluoresensi kondisi tunak menunjukkan bahwa ekspresi berlebih dari P-glikoprotein menghaluskan gradien transversal ‘fluiditas membran’ dalam rentang suhu yang luas dari 10 hingga 50 °C.
Bahan dan metode
Bahan kimia
Dipalmitoylglycerophosphocholine (DPPC) diperoleh dengan kadar purissimum dari Fluka (Buchs, Swiss). Quinine hemisulfate salt monohydrate diperoleh dari Sigma-Aldrich (St. Louis, MO, AS). Asam lemak n- (9-Anthroyloxy) ( n = 2, 7, 9, 12, 16) dibeli dari PL Biochemical (sekarang Thermo Fisher Scientific, Waltham, MA, AS) (2-AS, 2-(9-anthroyloxy)stearic acid; 7-AS, 7-(9-anthroyloxy)stearic acid; 9-AS, 9-(9-anthroyloxy)stearic acid; 12-AS, 12-(9-anthroyloxy)stearic acid; 16-AP, 16-(9-anthroyloxy)palmitic acid). Kemurniannya dikontrol dengan kromatografi lapis tipis dengan etanol–air (95 : 5, v/v) sebagai pelarut dan spektrofotometri serapan. Larutan stok individual dari kelima pewarna tersebut berbeda dari koefisien kepunahan rata-ratanya hingga 1,2% dalam kisaran spektrum serapan 320 hingga 380 nm. Semua reagen lain yang dibeli yang digunakan untuk pengukuran fluoresensi bermutu analitis dan bebas dari pengotor fluoresensi.
Kultur sel
Mutasi CHO yang sangat tahan terhadap kolkisin CH R B30 [ [ 14 , 22 ] ] dipilih dari auxotrof AuxB1 yang membutuhkan glisin, adenosin, dan timidina [ [ 23 ] ] melalui seleksi klonal, menghasilkan galur sel CH R B3, diikuti oleh seleksi bertahap, menghasilkan galur sel intermediet CH R C5, dan akhirnya melalui kultur kontinyu dalam peningkatan konsentrasi kolkisin, menghasilkan CH R B30. Aliquot dari stok sel AuxB1 dan CH R B30 yang disimpan dalam tangki nitrogen merupakan bahan awal untuk kultur sel.
Selama periode penelitian, lini sel AuxB1 dan CH R B30 diautentikasi berdasarkan fitur spesifik lini dari jumlah salinan gen mdr1 dan ekspresi:
Profil ekspresi: Kadar transkrip RNA MDR1 diukur melalui uji reaksi berantai polimerase kinetik dengan 32 nukleotida berlabel P yang dioptimalkan secara internal untuk menentukan kadar RNA hamster mdr1 dalam kisaran mRNA spesifik 0,001–1000 amol.
Kariotipe: G-banding [ [ 22 ] ].
Hibridisasi in situ dengan probe mdr1 untuk mendeteksi daerah pewarnaan homogen dari amplifikasi gen glikoprotein P hamster mdr1 pada kromosom Z4 CH R B30 sebagai perubahan kromosom karakteristik antara garis induk AuxB1 dan turunannya yang resistan terhadap banyak obat CH R B30 [ [ 22 ] ].
Pewarnaan biru Coomassie pada protein membran plasma yang dipisahkan oleh gel Fairbanks [ [ 1 , 14 , 19 ] ].
Sel ditumbuhkan dalam medium α-minimal esensial dengan nukleosida (Gibco, Paisley, Inggris) yang dilengkapi dengan 10% serum anak sapi fetal (Flow Laboratories; Gibco) dan sebagai tambahan untuk sel CH R B30 hanya dengan 30 μg·mL −1 kolkisin. Sel dikultur dalam lapisan tunggal pada suhu 37 °C di udara lembab yang mengandung 5 vol.% CO2 . Kultur diperbanyak dua kali seminggu dengan pemisahan tripsin (CH R B30 1 : 10, AuxB1 1 : 40) hingga 1 bulan. Kultur diperiksa secara berkala untuk mengetahui adanya kontaminasi dengan mikoplasma. Tidak ada mikoplasma yang terdeteksi dalam kultur sel yang diproses.
Isolasi membran
Sel-sel tripsinasi yang dicuci pada konsentrasi 5 × 10 7 ·mL −1 dalam larutan penyangga fosfat dipecah dalam pompa pada tekanan 1,2 × 10 6 Pa untuk CH R B30 dan 2,4 × 10 6 Pa untuk AuxB1, yang meminimalkan kerusakan organel intraseluler [ [ 1 ] ]. Suspensi sel yang pecah mengalami langkah-langkah sentrifugasi diferensial berikut: spin nuklir, 300 g selama 30 menit; spin mitokondria, 4000 g selama 10 menit; spin mikrosomal, 35.000 g selama 30 menit. Pelet mikrosomal disuspensikan kembali dalam larutan penyangga fosfat dan diaplikasikan pada gradien sukrosa terputus-putus yang terdiri dari 10 mL 60% (massa/vol.), 14 mL 45%, 24 mL 31%, dan 12 mL sukrosa 16%. Sentrifugasi dilakukan dalam rotor SW25.2 pada 76.900 g selama 18 jam. Fraksi pita vesikel membran plasma pada antarmuka 16/31% dihilangkan, dicuci dengan 5 m m Tris/HCl, pH 7,5, dan disuspensikan kembali pada 5–10 mg protein·mL −1 dalam penyangga yang sama yang mengandung sukrosa 0,25 M. Bahasa Indonesia: Setelah sebagian diambil untuk penentuan kandungan protein (prosedur fluorometrik menurut Böhlen et al . [ [ 24 ] ]), preparasi vesikel dibersihkan dengan nitrogen dan disimpan pada suhu -70 °C hingga digunakan. Preparasi membran plasma mengandung 0,61–0,73 μmol total fosfolipid per mg protein dan 0,44–0,50 μmol kolesterol per mg protein [ [ 18 ] ]. Untuk memeriksa komposisi protein kotor dari preparasi membran plasma yang mewakili kurang dari setengah dari 1% dari total protein sel [ [ 1 ] ], sampel dipisahkan dengan PAGE kontinu dengan 1% (b/v) SDS dan 6 M urea menggunakan prosedur Fairbanks et al . [ [ 25 ] ] yang dimodifikasi oleh Debenham et al . [ [ 26 ] ]. Glikoprotein P menyusun sekitar 20% protein dalam membran CH R B30, tetapi tidak terdeteksi oleh pewarnaan Coomassie dalam membran AuxB1.
Persiapan vesikel fosfolipid
Vesikel DPPC unilamelar disiapkan dengan injeksi menurut Parce et al . [ [ 27 ] ]. Dua mg DPPC dilarutkan dalam 5 mL dimetil eter/metanol (3 : 1, berdasarkan volume). Aliquot 0,1 mL disuntikkan dalam waktu 30 detik ke dalam 5 mL kalium fosfat 0,1 mm , pH 7, pada suhu 60 °C. Preparasi vesikel dipertahankan pada suhu 55 °C hingga digunakan.
Pengukuran fluoresensi
Spektrum fluoresensi keadaan stabil dan anisotropi emisi diukur dengan spektrofluorometer RRS 1000 (Schoeffel, Westwood, NJ, AS) yang dilengkapi dengan dua monokromator eksitasi kisi, satu monokromator emisi kisi, dan polarisator Glan Thompson. Sinyal tegangan keluaran fluorometer didigitalkan dan diimpor ke laptop untuk analisis data selanjutnya.
Kami mengikuti serangkaian tindakan yang terstandardisasi. Dimulai pada malam hari setelah pukul 6 sore, spektrum serapan 0,14 m m n- (9-antroiloksi) asam lemak dalam tetrahidrofuran direkam pada suhu kamar. Selanjutnya, dudukan kuvet termostat fluorometer dihubungkan dengan penangas air yang diatur pada suhu 10 °C dan kriostat yang diatur pada suhu 7 °C. Kemudian, spektrum fluoresensi eksitasi dan emisi (band-pass 3 nm) dari quinine sulfate standar ( E 345 = 0,0016) dan dari sediaan vesikel membran plasma (70 μg protein membran·mL −1 dalam 20 m m kalium fosfat, pH 7,2, 100 m m NaCl) diukur. Selanjutnya, 2 μL larutan stok asam lemak n- (9-antroiloksi) 0,14 m m ditambahkan ke 1400 μL suspensi vesikel membran plasma (rasio molar probe : fosfolipid ~ 1 : 200–1 : 400), dicampur dengan cara diaduk dan diinkubasi dalam gelap selama 12 jam pada suhu 4 °C. Keesokan paginya kuvet fluoresensi (Hellma, Müllheim, Jerman) diisi dengan 500 μL suspensi vesikel membran plasma fluoresen dan spektrum fluoresensi eksitasi dan emisi (band-pass 3 nm) direkam pada suhu 10 °C.
Suhu larutan diukur dengan akurasi ±0,02 °C menggunakan termistor terkalibrasi (tipe YSI 44006; Knauer, Berlin, Jerman) yang direkatkan dengan UHU plus ke dalam kapiler kaca yang memanjang melalui sumbat sel ke dalam larutan tepat di atas lintasan cahaya [ [ 28 ] ]. Termistor membentuk satu cabang dalam rangkaian jembatan suhu presisi (Knauer).
Untuk memantau ketergantungan suhu anisotropi asam lemak n- (9-antroiloksi) dalam vesikel, prisma Glan Thompson dipasang di meja kerja optik fluorimeter. Dimulai pada suhu 10 °C, suhu dalam kuvet dinaikkan pada laju 12 °C·h −1 hingga 52 °C. Anisotropi diukur secara terus-menerus secara bergantian pada panjang gelombang eksitasi 319, 333, 347, 367, dan 381 nm, yaitu, spektrum eksitasi maksimum asam lemak n- (9-antroiloksi). Untuk meminimalkan hamburan cahaya, emisi fluoresensi dikumpulkan melalui filter cutoff KV 418 (Schott, Mainz, Jerman) pada 440 nm (band-pass 3 nm).
Anisotropi emisi fluoresensi ditentukan sebagai berikut:
![]()
di mana R v = I vv / I vh merupakan rasio cahaya emisi terpolarisasi vertikal terhadap horizontal untuk cahaya eksitasi terpolarisasi vertikal, dan R h = I hv / I hh merupakan faktor kalibrasi yang mengoreksi polarisasi instrumen. Semua pengukuran dengan preparat membran AuxB1 dan B30 dilakukan dengan setiap probe sebanyak tiga kali.
Dalam kasus pengukuran dengan vesikel DPPC unilamelar dalam 0,1 mm kalium fosfat, pH 7, dua μL larutan asam lemak n- (9-antroiloksi) 0,14 mm ditambahkan ke 1400 μL buffer DPPC·mL −1 70 μg . Setelah vesikel diinkubasi dalam gelap selama 2 jam pada suhu 47 °C di atas transisi gel ke kristal cair, eksitasi fluoresensi, dan spektrum emisi direkam pada suhu 37 °C. Selanjutnya, anisotropi diukur pada suhu 37 °C dalam kisaran panjang gelombang eksitasi 250–400 nm (pita lulus 3 nm) dan emisi fluoresensi dikumpulkan melalui filter pemutus KV 418 (Schott) pada 440 nm (pita lulus 3 nm) sebagaimana dijelaskan di atas untuk membran plasma CHO.
Analisis data
Nilai anisotropi fluoresensi asam lemak n- (9-antroyloxy) diinterpretasikan menurut prosedur evaluasi Vincent et al . [ [ 21 ] ] berdasarkan formalisme yang dikembangkan oleh Weber [ [ 29 ] ] dan Shinitzky et al . [ [ 30 ] ]. Anisotropi fluoresensi keadaan tunak ditentukan oleh pemilihan foton statistik, sudut α antara momen dipol transisi penyerapan dan emisi, yang keduanya dijumlahkan sebagai anisotropi absolut r O dan pergerakan fluorofor. Dalam kasus molekul aromatik planar seperti antrasena, osilator penyerapan dan emisi bersifat koplanar. Pengukuran keadaan tunak menghasilkan laju rata-rata rotasi fluorofor yang ditentukan oleh r O dan dua mode rotasi sehubungan dengan osilator penyerapan: R op adalah laju rotasi di luar bidang, yaitu rotasi di sekitar ikatan ester pada C9 cincin antrasena. R ip adalah laju rotasi dalam bidang, yaitu gerakan reorientasi segmental rantai asil [ [ 31 ] ]. Jika laju rotasi lambat sehingga hanya terjadi rotasi kecil antara eksitasi dan emisi, anisotropi r dari pelat berputar fluoresensi ditentukan secara kira-kira oleh hubungan:
![]()
di mana τ F adalah waktu hidup keadaan tereksitasi. Variasi [( r o / r ) – 1]/τ F dengan panjang gelombang eksitasi menunjukkan gerakan anisotropik fluorofor [ [ 30 ] ]. Jika kita mengganti cos 2 α dengan ekspresinya dalam fungsi r o ,
![]()
Persamaan ( 1 ) dituliskan sebagai hubungan linier [ [ 21 ] ].
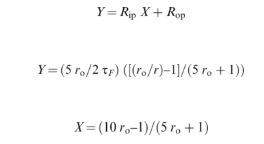
Y dan X dihitung dari nilai- r eksperimen anisotropi emisi fluoresensi pada panjang gelombang eksitasi 319, 333, 347, 367, dan 381 nm. Plot Y = f ( X ) dievaluasi dengan kurva pemasangan dan regresi linier tertimbang. Nilai waktu hidup keadaan tereksitasi rata-rata τ F dan nilai anisotropi waktu-nol r o untuk 2-AS, 7-AS, 9-AS, 12-AS, dan 16-AP dalam kisaran suhu 10–50 °C diinterpolasi dari pengukuran waktu peluruhan yang dipublikasikan dari probe dalam vesikel DPPC pada 21, 37, dan 47 °C [ [ 21 ] ].
Hasil
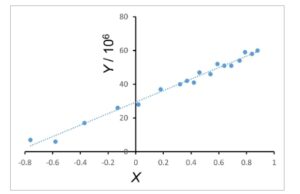
Vincent dan koleganya [ [ 21 ] ] telah mengkarakterisasi anisotropi fluoresensi asam lemak n -(9-antroyloxy) dalam vesikel DPPC melalui pengukuran beresolusi waktu. Mengambil data ini sebagai referensi untuk menguji kinerja pengaturan eksperimen kami, kami mengukur anisotropi fluoresensi 2-AS, 9-AS, dan 16-AP pada 37 °C dalam vesikel DPPC unilamelar. Anisotropi ditentukan dalam kisaran panjang gelombang eksitasi 250 hingga 400 nm. Seperti yang ditunjukkan pada Gambar 1 untuk 2-AS, plot Y = f(X) (Persamaan 2 ) bersifat linier, yang menunjukkan bahwa kumpulan data dapat diinterpretasikan dalam bentuk formalisme yang diberikan dalam Persamaan ( 1 ). Tabel 1 mencantumkan laju rotasi di luar bidang ( R op ) dan di dalam bidang ( R ip ) yang dihitung. R op dan R ip hampir identik untuk masing-masing dari tiga probe. Temuan ini sejalan dengan perilaku probe dalam media isotropik [ [ 21 ] ].
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Plot Y = f(X) untuk 2-AS dalam vesikel DPPC pada suhu 37 °C disimpulkan dari tiga persiapan vesikel independen. Parameter Y dan X dijelaskan dalam Material dan metode di bagian ‘ Analisis data ‘ [Persamaan ( 1 ) dan ( 2 )].
Tabel 1. Laju rotasi di luar bidang ( R op ) dan di dalam bidang ( R ip ) yang dihitung a dan waktu korelasi rotasi (ø) b yang sesuai dari n -(9-antroyloxy) asam lemak dalam vesikel DPPC pada suhu 37 °C.
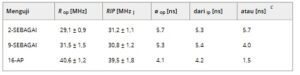
a Nilai menunjukkan rata-rata dan interval kepercayaan 95% dari regresi linier plot Y = f(X) yang disimpulkan dari tiga persiapan vesikel independen.
b Dihitung sebagai ø op = 1/(6 R op ) dan ø ip = 1/(6 R ip ) menurut Yguerabide et al . [ [ 65 ] ].
Nilai c ø diambil dari Gambar 10 di Vincent et al . [ [ 21 ] ] yang telah mengukur anisotropi pada panjang gelombang eksitasi 316 nm (band-pass 10-nm) di mana r o mendekati 0,1. Oleh karena itu, anisotropi sebagian besar ditentukan oleh rotasi luar bidang R op (lihat Persamaan 2 ).
Berdasarkan temuan-temuan pada vesikel DPPC bahwa plot Y = f(X) adalah linear dan bahwa pengukuran kondisi-mapan kami secara umum sesuai dengan pengukuran anisotropi fluoresensi beresolusi-waktu, kami menerapkan formalisme Weber [ [ 29 ] ] dan Shinitzky et al . [ [ 30 ] ] pada pengukuran kondisi-mapan kami terhadap anisotropi membran plasma sel AuxB1 yang sensitif terhadap obat dan sel CH R B30 CHO yang resistan terhadap banyak obat. Ketergantungan suhu terhadap anisotropi fluoresensi 2-AS, 7-AS, 9-AS, 12-AS, dan 16-AP dalam kisaran 10 hingga 52 °C direkam dengan perangkat keras yang sama dan protokol yang sama dalam periode studi 2 tahun. Selama setiap percobaan, anisotropi pada panjang gelombang eksitasi 319, 333, 347, 367, dan 381 nm diukur sebanyak 98 hingga 180 kali (median 130 kali) yang sesuai dengan 23–43 titik data anisotropi dalam interval suhu 10 °C. Analisis regresi mengungkapkan plot Y = f(X) linear (lihat Gambar 2 untuk 2-AS pada 20 °C sebagai contoh) yang mengonfirmasi bahwa Persamaan ( 2 ) dapat diterapkan untuk menghitung laju rotasi di luar bidang dan di dalam bidang dari kurva pemanasan kami. Dalam kesalahan eksperimental, masing-masing asam lemak n- (9-anthroyloxy) menunjukkan hasil kuantum yang cocok, spektrum emisi fluoresensi, dan kinetika serapan dalam vesikel AuxB1 dan CH R B30 yang menunjukkan bahwa probe dipartisi dengan hasil yang sama ke dalam membran plasma sel AuxB1 yang sensitif terhadap obat dan sel CHO CH R B30 yang resistan terhadap banyak obat. Demikian pula, 9,10-dimetilantrasena dan asam karboksilat metil 9-anthracena, yang dapat dianggap sebagai senyawa pengganti dari label fluoresensi dalam probe asam lemak n- (9-anthroyloxy), menunjukkan sifat partisi dan spektrofluorometrik yang cocok dalam vesikel membran plasma AuxB1 dan CH R B30. Sebaliknya, ketika kita mengekspos membran plasma ke daunomisin antrasiklin fluoresen, substrat glikoprotein P yang diketahui [ [ 32 ] ], 1,4 kali lebih banyak daunomisin dipartisi ke dalam vesikel B30 dibandingkan ke dalam vesikel AuxB1.
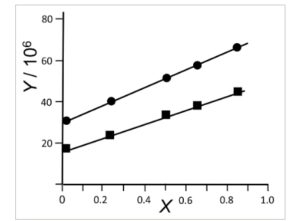
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Plot Y = f(X) untuk 2-AS dalam membran plasma AuxB1 (lingkaran padat) dan CH R B30 (kotak padat) pada suhu 20 °C ( n = 3 replikasi teknis). Parameter Y dan X dijelaskan dalam Material dan metode di bagian ‘ Analisis data ‘ [Persamaan ( 1 ) dan ( 2 )].
Plot tiga dimensi pada Gambar 3 , 4 menunjukkan nilai R op dan R ip yang dihitung dari asam lemak n- (9-antroiloksi) dari 10 hingga 50 °C dalam membran plasma AuxB1 dan CH R B30. Perubahan berkelanjutan R op dan R ip terhadap suhu diturunkan untuk setiap probe dari seluruh dataset tiga kurva panas. Perubahan R op dan R ip sepanjang gradien transversal posisi dalam rantai hidrokarbon alifatik yang diesterifikasi dengan fluorofor diinterpolasi dari kurva panas dalam langkah 5 °C.
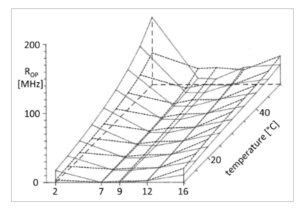
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Gradien transversal dari koefisien korelasi rotasi R op , rotasi luar bidang di sekitar ikatan ester pada C9 dari cincin antrasena dari probe asam lemak n -(9-antroiloksi) ( n = 2, 7, 9, 12, 16) yang tertanam dalam membran plasma dari garis sel CHO yang peka terhadap obat AuxB1 (garis utuh) dan turunannya yang sangat resistan terhadap banyak obat CH R B30 (garis putus-putus) dalam kisaran 10–50 °C. Kurva pemanasan direkam untuk setiap probe dan setiap garis sel dalam rangkap tiga.
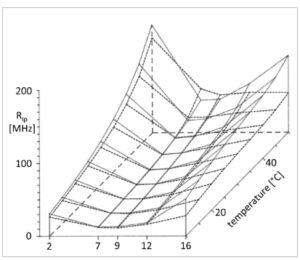
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Gradien transversal dari koefisien korelasi rotasi R ip , gerakan reorientasi segmental rantai asil dalam bidang dari n- (9-antroiloksi) asam lemak ( n = 2, 7, 9, 12, 16) yang tertanam dalam membran plasma dari garis sel CHO yang peka terhadap obat AuxB1 (garis utuh) dan turunannya yang sangat resistan terhadap banyak obat CHRB30 (garis putus-putus) dalam kisaran 10–50 °C. Kurva pemanasan direkam untuk setiap probe dan setiap garis sel dalam rangkap tiga.
Ketika kita membandingkan profil R op dan R ip pada membran AuxB1 dan CH R B30 (Gbr. 3 dan 4 ), kesamaan dalam bentuk keseluruhan, tetapi juga perbedaan yang jelas, tampak jelas. Laju rotasi terus meningkat seiring suhu dan secara konsisten memiliki nilai maksimum untuk 2-AS dan 16-AP dan nilai rendah atau sangat rendah untuk 7-AS, 9-AS, dan 12-AS di seluruh rentang suhu. R ip selalu lebih tinggi daripada R op untuk kondisi eksperimen probe, lini sel, dan suhu yang bersamaan.
Gradien transversal R op dan R ip berbeda antara membran plasma CH R B30 dan AuxB1. Pada posisi probe dan suhu yang sesuai, laju rotasi bervariasi hingga dua kali lipat antara dua garis CHO. Profil R ip hampir cocok antara AuxB1 dan CH R B30 untuk 2-AS, 7-AS, 9-AS, dan 12-AS, tetapi nilai R ip dari 16-AP sekitar dua kali lipat lebih tinggi di AuxB1 di seluruh rentang suhu. Sebaliknya, profil R op berbeda dalam membran AuxB1 dan CH R B30. Gradien transversal lebih halus di CH R B30 daripada di membran AuxB1. Nilai R op di CH R B30 lebih rendah untuk 2-AS, cocok dengan AuxB1 untuk 12-AS, dan lebih tinggi untuk 7-AS, 9-AS, dan 16-AP.
Kurva pemanasan direkam dalam buffer fosfat pada pH 7,2 tanpa adanya ATP atau substrat atau inhibitor P-glikoprotein. Oleh karena itu, P-glikoprotein dipantau dalam keadaan apo yang menurut data cryo-EM yang baru-baru ini diterbitkan dicirikan oleh ‘keadaan tertutup yang menghadap ke dalam dengan NBD yang berjarak dekat dan jalur TMD tertutup di bagian tengah’ (kutipan dari bagian Hasil ref. [ [ 4 ] ] pada konformasi apo-ABCB1). Untuk mengatasi masalah ini apakah keadaan konformasi P-glikoprotein dapat memodulasi profil R op dan R ip dari membran plasma, kami mengulangi kurva pemanasan dengan 2-AS tanpa dan dengan adanya verapamil 10 μm , inhibitor P-glikoprotein yang pertama kali terdeteksi secara historis [ [ 33 ] ]. Profil suhu anisotropi fluoresensi 2-AS tetap invarian dalam membran AuxB1 tetapi berubah dalam membran CH R B30 setelah terpapar verapamil (Gbr. 5 ). Baik nilai R ip maupun R op meningkat secara monoton sekitar 1,2 kali lipat pada 10 °C hingga 2,4 kali lipat pada suhu di atas 40 °C (Gbr. 6 ). Data ini menyiratkan bahwa perubahan keadaan konformasi glikoprotein P yang diinduksi verapamil meningkatkan mobilitas 2-AS sebagai ukuran fluiditas membran CH R B30.
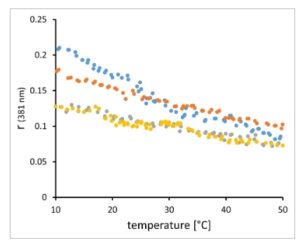
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Rekaman tunggal anisotropi fluoresensi 2-AS pada 381 nm yang tertanam dalam membran plasma AuxB1 (titik abu-abu, titik kuning) dan CH R B30 (titik oranye, titik biru) tanpa adanya (titik abu-abu, titik oranye) dan adanya (titik kuning, titik biru) verapamil 10 μ m dalam kisaran 10–50 °C. Titik-titik tersebut mewakili pengukuran individual pada 381 nm selama perekaman kurva pemanasan.
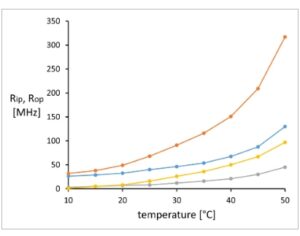
Gbr. 6
Buka di penampil gambar
Kekuatan Gambar
Koefisien korelasi rotasi R op (garis abu-abu dan kuning) dan R ip (garis biru dan oranye) dari probe 2-AS yang tertanam dalam membran plasma CH R B30 tanpa (garis abu-abu dan biru) dan dengan (garis kuning dan oranye) verapamil 10 μ m dalam kisaran 10–50 °C ( n = 2 replikasi teknis).
Diskusi
Pengukuran anisotropi fluoresensi kondisi mapan dari probe asam lemak n- (9-antroyloxy) pada membran yang mengekspresikan glikoprotein apo-P secara berlebihan mengungkapkan bahwa ekspresi berlebihan glikoprotein P hamster pada sel CHO memperlancar gradien transversal laju rotasi di sekitar ikatan ester pada C9 dari cincin antrasena dari probe asam lemak n- (9-antroyloxy), sedangkan gerakan reorientasi segmental rantai asil dari probe hanya terpengaruh di bagian tengah hidrofobik membran plasma. Resistensi multiobat terhadap agen kemoterapi dan hubungannya dengan ekspresi berlebihan glikoprotein P-transporter multiobat dalam membran plasma telah ditemukan pada lini sel CHO [ [ 1 , 14 , 34 ] ] yang menjadi subjek penelitian saat ini. Membran plasma yang digunakan untuk pengukuran fluoresensi dimurnikan dari sel CHO menurut protokol yang sama yang pertama kali memvisualisasikan glikoprotein P dalam pewarnaan Coomassie pada vesikel dari sel yang resistan terhadap obat [ [ 1 ] ]. Dengan pengecualian kelimpahan tinggi glikoprotein P dalam vesikel membran plasma sel yang resistan terhadap obat, nenek moyang yang peka terhadap obat AuxB1 dan turunannya yang resistan terhadap kolkisin menunjukkan komposisi polipeptida yang sama dalam SDS/PAGE protein membran [ [ 1 ] ] dan, dalam kesalahan eksperimental, kandungan fosfolipid dan kolesterol yang sama, komposisi asam lemak dan fosfolipid yang sama, dan komposisi asam lemak kelas fosfolipid yang sama [ [ 18 ] ]. Oleh karena itu, kita dapat menetapkan mobilitas diferensial dari probe n -(9-antroyloxy) dalam membran AuxB1 dan CH R B30 ke jumlah diferensial glikoprotein P sebagai satu-satunya perbedaan yang terdeteksi. Ekspresi berlebihan glikoprotein P dikaitkan dengan perubahan ultrastruktur membran pada permukaan protoplasma [ [ 15 ] ] yang seharusnya memengaruhi mobilitas probe. Mikroskopi elektron fraktur beku menunjukkan bahwa permukaan protoplasma membran plasma CH R B30 dicirikan oleh kepadatan partikel intramembran yang lebih tinggi dengan diameter 6–9 nm (~ 2400·μm 2 ) daripada permukaan protoplasma membran AuxB1 (~ 200·μm 2 ) [ [ 15 ] ].
Pada sel CH R B30, glikoprotein P terlokalisasi dalam mikrodomain membran kepadatan menengah yang berbeda dari domain caveolar atau rakit lipid klasik [ [ 35 ] ]. Dengan demikian, glikoprotein P berinteraksi secara langsung dengan lapisan lipid [ [ 36 , 37 ] ] dan mengikat kolesterol [ [ 38 ] ] dan lipid [ [ 39 ] ]. Lingkungan lipid memodulasi fungsi glikoprotein P seperti hidrolisis ATP, pengikatan obat, dan transportasi obat (diulas oleh Hegedüs et al . [ [ 12 ] ] dan Sharom [ [ 13 ] ]). Selain itu, glikoprotein P menggabungkan lipid dalam rongga hidrofobiknya, dan perubahan konformasinya di bagian sitoplasma dari semua domain transmembran distabilkan oleh kontak lipid yang dinamis [ [ 4 ] ]. Di sisi lain, profil suhu mobilitas rotasi asam lemak n- (9-antroyloxy) berbeda dalam membran AuxB1 dan CH R B30, yang menunjukkan bahwa ekspresi berlebihan P-glikoprotein memodulasi gradien transversal global mobilitas dan mikroviskositas membran plasma.
Kami memilih asam lemak n- (9-antroyloxy) sebagai set molekul reporter yang tepat untuk parameter yang terkait dengan kedalaman penetrasi membran [ [ 40 – 45 ] ]. Dalam model membran lipid, jarak gugus antroyloxy dari pusat dwi lapis hampir berhubungan linier dengan jumlah atom karbon antara gugus antroyloxy dan karboksil [ [ 41 ] ]. Oleh karena itu, anisotropi fluoresensi untuk probe n -AS tertentu adalah ukuran sifat membran yang bergantung pada kedalaman. Kami mengukur emisi fluoresensi pada emisi maksimum di mana peluruhan fluoresensi adalah monoeksponensial [ [ 46 , 47 ] ] yang menyiratkan bahwa ketergantungan pada anisotropi dari panjang gelombang eksitasi mencerminkan dinamika rotasi lokal dari gugus 9-antroyloxy [ [ 21 , 31 ] ]. Dengan rasio probe-lipid yang dipilih sebesar 1 : 200–1 : 400, struktur membran tidak terganggu oleh asam lemak fluoresen [ [ 43 ] ]. Dengan demikian, laju rotasi R ip dan R op yang dihitung harus mencerminkan lingkungan lokal dunia nyata pada kedalaman yang berbeda dalam membran plasma AuxB1 dan CH R B30 yang hanya berbeda dengan faktor sekitar 20 dalam kandungan P-glikoproteinnya [ [ 14 , 15 ] ]. P-glikoprotein sel CH R B30 diketahui berfungsi sebagai fosfolipid flippase [ [ 48 , 49 ] ] dan sebagai pompa efluks untuk berbagai macam substrat amfifilik dan hidrofobik [ [ 50 , 51 ] ]. Namun, tidak seperti fosfolipid, asam lemak antroiloksi mungkin bukan substrat dari P-glikoprotein hamster. Pada konsentrasi standar 0,2 μm , probe tersebut diseimbangkan dalam 80–120 menit dalam vesikel membran AuxB1 dan CH R B30 dan kemudian menunjukkan sifat spektrofluorometrik yang identik. Sebaliknya, substrat atau inhibitor P-glikoprotein yang mapan, seperti daunomisin, vinblastin, atau verapamil yang diseimbangkan dalam beberapa detik, tertanam dalam jumlah yang lebih tinggi ke dalam CH R B30 daripada ke dalam vesikel membran plasma AuxB1 dan menunjukkan pengikatan afinitas tinggi ke P-glikoprotein ([ [ 51 , 52 ] ], data sendiri yang tidak dipublikasikan). Dengan demikian, profil anisotropi asam lemak antroiloksi dalam CH RMembran B30 mungkin dipengaruhi oleh interaksi langsung dan/atau tidak langsung dengan glikoprotein P (untuk kemungkinan interaksi pengikatan lihat misalnya, ref. [ [ 4 , 6 ] ]).
Aplikasi probe asam lemak antroyloxy pada membran biologis nyata masih langka. Sebagian besar penelitian menganalisis probe dalam pelarut isotropik, vesikel lipid, atau protein/metabolit tunggal yang dimasukkan ke dalam vesikel. Penelitian yang dipublikasikan tentang anisotropi fluoresensi probe dalam membran biologis [ [ 53 – 56 ] ] dibatasi pada panjang gelombang eksitasi tunggal dan karenanya tidak memungkinkan perhitungan laju rotasi fluorofor. Dengan demikian, lebih dari 50 tahun setelah rangkaian probe ini dirancang untuk penelitian membran [ [ 57 ] ], probe kini telah digunakan untuk pertama kalinya dalam membran biologis untuk mencakup rentang suhu representatif 40 °C dari fase luas pelelehan lipid hingga lapisan lipid cair saat protein mulai terurai [ [ 58 ] ].
Pengukuran pada vesikel membran plasma dilakukan dalam buffer fosfat berair tanpa adanya ATP, substrat, atau inhibitor P-glikoprotein. Dengan demikian, P-glikoprotein berada dalam keadaan konformasi apo yang tidak aktif secara fisiologis [ [ 4 ] ]. Rotasi dalam bidang dan luar bidang fluorofor menunjukkan profil yang sama dalam ketergantungannya pada suhu dan kedalaman penetrasi membran (Gbr. 3 , 4 ). Berbeda dengan vesikel fosfolipid yang menunjukkan gradien linier mobilitas rotasi sepanjang lintasan transversal lapisan ganda [ [ 21 ] ], laju rotasi dalam membran CHO yang dekat dengan antarmuka lipid/akuatik dan dalam inti hidrofobik lapisan ganda tinggi dan rendah di antara karbon 7, 9, dan 12 dari asam lemak. Temuan bahwa mobilitas molekul memiliki minimum di area polaritas intermediet adalah khas untuk membran biologis dan telah ditafsirkan sebagai ‘penghalang mikroviskositas dari lapisan ganda’ [ [ 59 ] ]. Rotasi dalam bidang rantai asil dari probe tidak dipengaruhi oleh P-glikoprotein pada posisi 2, 7, 9, dan 12, tetapi pada ujung hidrofobik. P-glikoprotein tampaknya tidak memengaruhi gerakan rantai asil di daerah yang lebih polar dari lapisan ganda, tetapi membatasi mobilitas lingkungan lipidnya di pusat apolar. Dampak yang berlawanan, tetapi bahkan lebih kuat dari ekspresi berlebihan P-glikoprotein terlihat untuk gradien transversal rotasi probe di sekitar ikatan ester pada C9 dari cincin antrasena. Profil transversal rotasi di luar bidang dihaluskan. Dengan demikian, apo-P-glikoprotein hamster memodulasi ‘gradien fluiditas’ membran plasma CH R B30. Khususnya pada suhu yang lebih tinggi di atas 30 °C, mobilitas masih minimum pada posisi 7 dan 9, tetapi perolehan mobilitas cukup besar dibandingkan dengan membran AuxB1. Sangat menggoda untuk berasumsi bahwa modulasi profil R op ini dapat memfasilitasi pembagian obat hidrofobik ke dalam membran dan dengan demikian meningkatkan kecepatan transporter multiobat untuk memompa obat keluar dari sel. Misalnya, kami telah membandingkan pelepasan obat dari sel AuxB1 dan CH R B30 dengan analisis kinetika aliran pendinginan berdenyut ([ [ 60 – 62 ] ], data tidak dipublikasikan). Dalam waktu 15 detik, CH RSel B30 melepaskan lebih dari 90% muatan daunomisin dan 25% vinblastin dalam jumlah yang sama. Sel AuxB1 yang peka terhadap obat mengeluarkan 10% daunomisin dan 13% vinblastin dalam waktu 15 detik. Dengan demikian, kami ingin menyimpulkan bahwa glikoprotein P memodulasi lingkungan lipidnya untuk meningkatkan kemanjuran pengikatan dan pengangkutan substrat amfifilik dan hidrofobik.
Kami mengukur gradien fluiditas membran plasma CHO yang sangat murni untuk menghasilkan data berkualitas tinggi. Namun, pendekatan ini memiliki kelemahan yang tak terelakkan yaitu kami menyelidiki glikoprotein P hamster dalam keadaan apo [ [ 4 ] ], yang tentu saja bukan konformasi fisiologis glikoprotein P dalam sel hidup yang dinilai dalam eksperimen quench-flow kami. Termotivasi oleh komentar pengulas yang berharga untuk versi pertama naskah, kami telah mengulangi kurva pemanasan dengan 2-AS tanpa dan dengan adanya verapamil yang membuat sel CHO B30 hipersensitif [ [ 63 , 64 ] ]. Inhibitor verapamil mengikat dengan afinitas tinggi terhadap glikoprotein P hamster [ [ 51 ] ]. Paparan verapamil tidak memengaruhi profil suhu R ip dan R op membran AuxB1 tetapi meningkatkan rotasi dalam bidang dan luar bidang probe pada membran CH R B30 pada seluruh rentang suhu 10–50 °C (Gbr. 6 ). Karena membran AuxB1 dan CH R B30 berbeda dalam jumlah P-glikoprotein tetapi sebaliknya sama dalam komposisi lipid [ [ 18 ] ] dan polipeptida [ [ 1 ] ], peningkatan mobilitas 2-AS yang terukur dalam fluiditas membran CH R B30 dapat dikaitkan dengan kepadatan yang lebih tinggi dari partikel intramembran yang berpotensi mengganggu membran [ [ 15 ] ] atau perubahan profil konformasi P-glikoprotein yang diinduksi verapamil dari keadaan apo ke kompleks dengan substrat/inhibitor tanpa adanya ATP/Mg 2+ [ [ 4 ] ]. Berdasarkan temuan awal ini dan pengetahuan kita saat ini tentang empat konformasi berbeda dari glikoprotein P [ [ 4 ] ], masalah ini masih harus dievaluasi lebih luas apakah spektrum konformasi glikoprotein P memodulasi fluiditas membran plasma pada sel-sel yang mengekspresikan glikoprotein P yang resistan terhadap banyak obat.