Abstrak
Mengidentifikasi strategi terapi yang inovatif sangat penting untuk meningkatkan manajemen klinis kanker ovarium. Sebelumnya, kami menunjukkan bahwa apoptosis sel kanker ovarium dapat dipicu dengan menghambat protein anti-apoptotik Bcl-x L dan Mcl-1 dan/atau dengan menginduksi mitra pro-apoptotiknya Bim, Puma, dan Noxa. Ekspresi protein pro-apoptotik ini dapat dihambat oleh deasetilasi histon yang berlebihan, yang diakibatkan oleh ekspresi HDAC yang berlebihan. Penelitian ini bertujuan untuk mengevaluasi apakah belinostat, penghambat pan-HDAC yang disetujui FDA, dapat meningkatkan ekspresi Bim, Puma, dan/atau Noxa dan menginduksi kematian sel kanker ovarium, baik sendiri atau dalam kombinasi dengan strategi yang menargetkan Bcl-x L atau Mcl-1. Belinostat memberikan efek sitostatik dan, pada konsentrasi yang lebih tinggi, efek apoptosis pada sel kanker ovarium SKOV3 dan IGROV1-R10. Obat ini menyebabkan peningkatan ekspresi protein Bim, Puma, dan Noxa yang bergantung pada konsentrasi, sementara sebagian menekan ekspresi protein Bcl-x L. Penghambatan Bcl-x L membuat kedua lini sel menjadi sensitif terhadap belinostat, seperti halnya penghambatan Mcl-1 pada sel IGROV1-R10. Menariknya, aktivitas antikanker belinostat juga ditingkatkan oleh penghambat Bcl-x L atau Mcl-1 pada organoid tumor yang berasal dari pasien. Oleh karena itu, penelitian ini memposisikan strategi berbasis belinostat sebagai terapi yang menjanjikan untuk kanker ovarium.
Singkatan
H3K9
histon H3 lisin 9
Bahasa Indonesia: HDAC
histon deasetilase
HGSOC
karsinoma ovarium serosa tingkat tinggi
OCCC
karsinoma sel jernih ovarium
PDTO
organoid tumor yang berasal dari pasien
1 Pendahuluan
Kanker ovarium epitelial tetap menjadi penyebab utama kematian akibat kanker ginekologi di Amerika Serikat [ [ 1 ] ]. Sebagian besar pasien didiagnosis terlambat karena penyakit stadium awal biasanya asimtomatik. Meskipun respons awal yang baik terhadap pengobatan standar, yang mencakup operasi pengurangan massa dan kemoterapi berbasis platinum/taxane [ [ 2 ] ], sebagian besar pasien kambuh dan mengembangkan resistensi kemoterapi. Akibatnya, tingkat kelangsungan hidup relatif 5 tahun hanya 50% dan menurun menjadi sekitar 30% ketika pasien stadium lanjut dipertimbangkan [ [ 1 , 2 ] ]. Pengenalan inhibitor PARP baru-baru ini dalam pengaturan pengobatan pemeliharaan lini pertama telah memberikan manfaat yang belum pernah terjadi sebelumnya bagi pasien kanker ovarium [ [ 3 ] ]. Namun, kemanjuran terapi yang ditargetkan ini terbatas pada sebagian kecil pasien dan dapat terganggu oleh perkembangan resistensi. Dengan demikian, mengidentifikasi strategi inovatif lainnya tetap menjadi tantangan utama untuk lebih meningkatkan manajemen klinis kanker ovarium.
Salah satu ciri khas sel kanker adalah kemampuannya untuk menghindari kematian sel apoptosis. Secara khusus, ekspresi berlebihan protein anti-apoptotik dari keluarga Bcl-2 sering terlibat dalam karsinogenesis dan resistensi kemoterapi [ [ 4 ] ], terutama pada kanker ovarium [ [ 5 ] ]. Deregulasi ini mengganggu keseimbangan antara anggota anti- dan pro-apoptotik dari keluarga Bcl-2, yang mengarah pada penangkapan berlebihan protein pro-apoptotik oleh pasangan anti-apoptotiknya. Hal ini mencegah aktivasi protein multidomain Bax dan Bak oleh protein BH3-only, sehingga menghambat oligomerisasi dan permeabilisasi membran luar mitokondria berikutnya [ [ 6 ] ]. Lebih khusus lagi, penelitian kami sebelumnya telah menunjukkan bahwa kelangsungan hidup sel kanker ovarium bergantung pada kerja sama antara protein anti-apoptotik Bcl-x L dan Mcl-1 untuk mengisolasi mitra pro-apoptotiknya [ [ 7 ] ] . Selain menghambat Bcl-x L dan Mcl-1, meningkatkan tingkat ekspresi anggota pro-apoptotik ini, terutama protein BH3-only Bim, Puma, dan Noxa, telah terbukti menjadi strategi yang menarik untuk memicu apoptosis pada sel kanker ovarium [ [ 8 – 10 ] ].
Ekspresi gen yang mengkode Bim, Puma, dan Noxa dapat dibatasi oleh mekanisme epigenetik. Secara khusus, deasetilasi histon, yang meningkatkan pemadatan kromatin, mungkin bertanggung jawab untuk menekan transkripsi gen-gen ini [ [ 11 – 13 ] ]. Homeostasis asetilasi histon diatur oleh aktivitas enzim histon asetiltransferase (HAT) dan histon deasetilase (HDAC), dan dapat terganggu oleh ekspresi atau aktivitas HDAC yang berlebihan. Aberasi HDAC tersebut telah terlibat dalam karsinogenesis melalui berbagai mekanisme molekuler, khususnya penghambatan apoptosis [ [ 14 ] ]. Banyak tumor, termasuk tumor ovarium, menunjukkan ekspresi HDAC yang berlebihan, yang tampaknya merupakan faktor prognosis yang buruk [ [ 15 , 16 ] ].
Beberapa inhibitor, seperti vorinostat, panobinostat, dan belinostat, telah dikembangkan untuk menargetkan enzim HDAC [ [ 14 ] ]. Molekul-molekul ini telah terbukti efektif dalam menghambat pertumbuhan tumor dan menginduksi apoptosis sel kanker. Menariknya, mereka dapat meningkatkan ekspresi protein pro-apoptotik dari keluarga Bcl-2, seperti Bim, Puma, Noxa, dan Bax, sementara sebaliknya menekan ekspresi anggota anti-apoptotik dari keluarga ini, seperti Bcl-x L , Mcl-1, dan Bcl-2 [ [ 17 ] ]. Beberapa inhibitor HDAC telah disetujui oleh Food and Drug Administration (FDA) untuk pengobatan keganasan hematologi tertentu. Ini termasuk belinostat (PXD101, Beleodaq ® ), inhibitor pan-HDAC yang digunakan sejak 2014 untuk mengobati limfoma sel T perifer yang kambuh atau refrakter [ [ 18 ] ]. Studi praklinis telah menunjukkan bahwa ia memberikan efek antikanker, termasuk dalam model tumor padat seperti kanker pankreas [ [ 19 ] ], prostat [ [ 20 ] ], paru-paru [ [ 21 ] ], dan tiroid [ [ 22 ] ].
Tujuan dari penelitian ini adalah untuk mengevaluasi apakah belinostat dapat menjadi alat farmakologis yang menarik untuk meningkatkan ekspresi Bim, Puma, dan/atau Noxa, dan untuk menginduksi apoptosis pada kanker ovarium, baik sendiri atau dalam kombinasi dengan strategi yang menargetkan Bcl-x L atau Mcl-1.
2 Bahan dan Metode
2.1 Kultur sel dan perawatannya
Garis sel karsinoma ovarium manusia yang resistan terhadap platinum SKOV3 (RRID:CVCL_0532) dan IGROV1-R10 digunakan. Garis sel SKOV3 diperoleh dari American Type Culture Collection. Garis sel IGROV1-R10 dibuat seperti yang dijelaskan sebelumnya [ [ 23 ] ] dari garis sel IGROV1 (RRID:CVCL_1304), yang disediakan oleh Dr. Jean Bénard (Institut Gustave Roussy, Paris, Prancis). Garis sel ini diautentikasi pada bulan Januari 2024 oleh Microsynth (Balgach, Swiss), yang membandingkan profil pengulangan tandem pendeknya dengan basis data Cellosaurus. Garis sel ini disertifikasi bebas mikoplasma menggunakan uji MycoAlert (Lonza, Basel, Swiss). Sel-sel ditumbuhkan dalam RPMI 1640 + Glutamax dan HEPES (Gibco, Paisley, Inggris), ditambah dengan 10% Serum Bovin Janin yang didekomplemen (Gibco) dan 33 m m natrium bikarbonat (Gibco). Sel-sel tersebut dipelihara dalam suasana lembab dengan 5% CO2 pada suhu 37 °C.
Belinostat dan ABT-737 dipasok oleh Selleckchem (Houston, TX, AS), dan AMG 176 dipasok oleh Chemietek (Indianapolis, IN, AS). Larutan stok disiapkan dalam dimetil sulfoksida (DMSO) dan disimpan pada suhu -80 °C. Sebanyak 2 × 10 5 sel SKOV3 dan 5,5 × 10 5 sel IGROV1-R10 ditanam dalam labu 25 cm2 . Dua puluh empat jam kemudian, sel-sel diperlakukan dengan belinostat ± ABT-737 atau AMG 176. Sel-sel kontrol diekspos ke pembawa DMSO.
2.2 Transfeksi siRNA
Bcl-x L siRNA, yang disebut si-Bcl-x L (urutan antisense siRNA: 5′-auuggugagucggaucgcatt-3′), dan Mcl-1 siRNA, yang disebut si-Mcl-1 (urutan antisense siRNA: 5′-gugccuuuguggcuaaacatt-3′), disintesis secara kimia oleh Eurogentec (Seraing, Belgia). SiGENOME non-targeting control siRNA Pool#1 (SMARTpool), yang disebut si-Ctrl, dibeli dari Dharmacon (Horizon Discovery, Cambridge, Inggris). Semua siRNA diterima sebagai oligonukleotida yang dianil. Sebanyak 1,5 × 10 5 sel SKOV3 dan 3,5 × 10 5 sel IGROV1-R10 ditanam dalam labu ukur 25 cm2 dan ditransfeksi 24 jam kemudian. Singkatnya, reagen transfeksi INTERFERin (Polyplus Transfection, Illkirch-Graffenstaden, Prancis) ditambahkan ke siRNA yang diencerkan dalam Opti-MEM Reduced-Serum Medium (Gibco). Kompleks dibiarkan terbentuk selama 10 menit pada suhu ruangan sebelum diaplikasikan ke sel pada konsentrasi akhir 20 nm . Dua puluh empat jam setelah transfeksi, media sel dibuang, dan sel diobati dengan belinostat.
2.3 Analisis proliferasi dan viabilitas sel
Proliferasi dan viabilitas sel dianalisis dengan mempelajari morfologi sel dengan mikroskopi, jumlah sel yang hidup menggunakan metode pengecualian biru Trypan, dan kandungan DNA sel dengan flow cytometry. Untuk analisis flow cytometry, sel yang melekat dan mengambang digabungkan, dicuci dengan 1× Phosphate-buffered saline (PBS) dan difiksasi dalam etanol 70%. Sel kemudian disentrifugasi pada 2750 g selama 5 menit dan diinkubasi selama 30 menit pada 37 °C dalam PBS. Setelah sentrifugasi (2750 g selama 5 menit), pelet sel dipisahkan dan diinkubasi dengan RNase A (Invitrogen, Waltham, MA, AS) dan propidium iodida (Invitrogen). Sampel dianalisis menggunakan Gallios flow cytometer (Beckman Coulter) dan distribusi siklus sel dan fraksi sub-G1 ditentukan menggunakan perangkat lunak Gallios (Beckman Coulter, Brea, CA, AS).
2.4 Ekstraksi RNA dan reaksi berantai polimerase transkripsi balik kuantitatif waktu nyata (RT-qPCR)
Total RNA diekstraksi menggunakan reagen TRIzol ® (Invitrogen). Kuantitas dan kualitas RNA dinilai menggunakan spektrofotometer NanoDrop™ 2000 (ThermoScientific, Waltham, MA, AS). RNA ditranskripsi balik menggunakan Omniscript Reverse Transcription Kit (Qiagen, Venlo, Belanda) dan primer acak (Invitrogen). Ekspresi berbagai transkrip ditentukan oleh PCR kuantitatif waktu nyata, dengan GAPDH (Glyceraldehyde-3-phosphate dehydrogenase) digunakan sebagai gen referensi untuk normalisasi. Untuk menilai ekspresi BIM dan PUMA , cDNA digabungkan dengan TaqMan™ Gene Expression Assays yang diinventarisasi (Hs00708019_s1 untuk BIM , Hs00248075_m1 untuk PUMA , dan Hs99999905_m1 untuk GAPDH , Applied Biosystems, Carlsbad, CA, AS) dan Taqman™ Universal Master Mix II, tanpa UNG (Applied Biosystems). Bahasa Indonesia : Untuk menilai ekspresi BCL-X L , MCL-1 , dan NOXA , cDNA digabungkan dengan campuran reaksi PCR Master LightCycler ® 480 SYBR Green I (Roche, Basel, Swiss), dan primer maju dan mundur ( BCL-X L maju: 5′-CCTTGGATCCAGGAGAACGG-3′; BCL-X L mundur: 5′-AAGAGTGAGCCCAGCAGAAC-3′; MCL-1 maju: 5′-TAACAAACTGGGGCAGGATT-3′; MCL-1 mundur: 5′-ATGGTTCGATGCAGCTTTCT-3′; NOXA maju: 5′-GACAAACTGAACTTCCGGCA-3′; NOXA mundur: 5′-ACGTGCACCTCCTGAGAAAA-3′; GAPDH maju: 5′-GAAAGCCTGCGGTGACTAA-3′; dan kebalikan GAPDH : 5′-AGGAAAAGCATCACCCGGAG-3′, Eurogentec). Semua reaksi amplifikasi PCR dilakukan dalam rangkap tiga pada instrumen PCR LightCycler ® 480 Real-Time (Roche). Metode 2 −ΔΔCt digunakan untuk menghitung perubahan relatif dalam ekspresi gen pada sel yang diobati dibandingkan dengan sel kontrol.
2.5 Ekstraksi protein dan analisis western blot
Protein diekstraksi, dan western blot dilakukan seperti yang dijelaskan sebelumnya [ [ 9 ] ]. Antibodi Asetil-Histone H3 (Lys9) (#9649), Caspase-3 (#9662), PARP (#9542), Bim (#2819), Puma (#12450), Bcl-x L (#2764) dan Mcl-1 (#5453) dibeli dari Cell Signaling Technology (Danvers, MA, AS), antibodi Noxa (#OP180) dari Calbiochem (Darmstadt, Jerman), dan antibodi α-tubulin (#T6199) dari Sigma-Aldrich (Darmstadt, Jerman). Western blot yang ditunjukkan berasal dari satu eksperimen yang mewakili sedikitnya tiga eksperimen independen dan lisat sel. Sinyal dikuantifikasi dengan densitometri piksel menggunakan perangkat lunak ImageJ .
2.6 Eksperimen organoid tumor yang berasal dari pasien (PDTO)
2.6.1 Sampel tumor
Jaringan tumor segar dikumpulkan oleh Pusat Sumber Daya Biologi ‘OvaRessources’ (NF-S 96900: manajemen mutu 2016) dari pasien dengan karsinoma sel jernih ovarium (OCCC, nomor anonimisasi OV-009_T) dan dari pasien dengan karsinoma ovarium serosa tingkat tinggi (HGSOC, nomor anonimisasi OV-174_T), keduanya dirawat di Pusat Kanker Komprehensif François Baclesse (Pusat Unicancer, Caen, Normandy, Prancis). Pengumpulan biologis dideklarasikan kepada Kementerian Pendidikan Tinggi dan Penelitian Prancis (No. DC-2020-4221). Formulir persetujuan yang diinformasikan ditandatangani oleh pasien dan diperoleh berdasarkan persetujuan komite etik ‘North-West III’ (CPP).
2.6.2 Pembentukan, kultur, dan pengobatan PDTO
PDTO didirikan, dikulturkan, dan diperlakukan seperti yang dijelaskan sebelumnya [ [ 24 ] ] menggunakan Cultrex Reduced Growth Factor Basement Membrane Extract, Type 2 (Biotechne, Minneapolis, MN, USA) sebagai matriks ekstraseluler.
2.6.3 Penilaian respon PDTO terhadap pengobatan
Pemantauan PDTO (morfologi, ukuran, dan pertumbuhan) secara real-time dilakukan oleh IncuCyte ® S3 (Essen BioScience, Ann Arbor, MI, AS). Setelah perawatan selama 48 jam, viabilitas sel dinilai dengan mengukur kadar ATP menggunakan uji viabilitas sel CellTiter-Glo ® 3D (Promega, Madison, WI, AS) dan aktivitas caspase-3/7 dievaluasi menggunakan uji Caspase-Glo ® 3/7 (Promega). Luminesensi diukur menggunakan Centro XS3 LB 960 (Berthold Technologies, Bad Wildbad, Jerman) dengan perangkat lunak Miko Win 2000. Kurva viabilitas dan aktivitas caspase-3/7 dibuat menggunakan perangkat lunak GraphPad Prism. Hasil dinormalisasi ke kontrol DMSO.
Analisis imunohistokimia dilakukan sebagai berikut: setelah perawatan selama 48 jam, PDTO difiksasi dalam paraformaldehida 3% selama 4 jam. Kemudian, PDTO dibenamkan dalam agarosa 2%, dikeringkan, dibenamkan dalam parafin, dan dipotong sebelum pewarnaan hematoksilin dan eosin standar. Imunohistokimia otomatis menggunakan autostainer Ventana Discovery XT (Roche) dilakukan pada irisan parafin setebal 4 μm. Setelah penghilangan lilin, pelepasan epitop, dan penghambatan aktivitas peroksidase endogen, irisan diinkubasi selama 40 menit pada suhu 37 °C dengan antibodi anti-cleaved caspase-3 (Asp 175) (#9661, Cell Signaling Technology). Irisan kemudian dibilas dengan buffer reaksi, dan antibodi sekunder (Omnimap Rabbit HRP, Roche) ditambahkan selama 16 menit pada suhu 37 °C. Setelah dicuci, pewarnaan dilakukan dengan 3,3′-diaminobenzidine (DAB) dan potongan diwarnai dengan hematoxylin menggunakan reagen Ventana. Kaca objek yang diwarnai didigitalkan menggunakan pemindai ScanScope CS (Leica Biosystems, Nussloch, Jerman).
2.7 Analisis Statistik
Hasilnya dinyatakan sebagai mean ± SD (batang galat) dari sedikitnya tiga eksperimen independen untuk lini sel dan sedikitnya dua eksperimen independen untuk PDTO. Sampel dibandingkan menggunakan uji t- Student satu sampel . Perbedaan dianggap berbeda secara statistik jika P < 0,05 (*), P < 0,01 (**), atau P < 0,001 (***).
3 Hasil
3.1 Belinostat menunjukkan efek sitostatik atau sitotoksik, tergantung pada konsentrasi yang digunakan, pada garis sel kanker ovarium SKOV3 dan IGROV1-R10
Kami menganalisis efek belinostat sebagai agen tunggal dalam lini sel kanker ovarium yang resistan terhadap platinum, SKOV3 dan IGROV1-R10. Kami pertama-tama memeriksa bahwa pengobatan dengan molekul ini meningkatkan asetilasi histon H3 lisin 9 (H3K9), yang menunjukkan penghambatan aktivitas HDAC yang efisien (Gbr. 1A ).
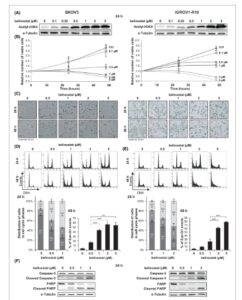
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Belinostat menunjukkan efek sitostatik atau sitotoksik, tergantung pada konsentrasi yang digunakan, pada lini sel kanker ovarium SKOV3 dan IGROV1-R10. Efek belinostat pada berbagai konsentrasi dianalisis pada lini sel kanker ovarium SKOV3 (kolom kiri) dan IGROV1-R10 (kolom kanan) pada 24 jam dan 48 jam. Tingkat asetilasi histon H3 lisin 9 (H3K9) dinilai dengan western blot (A). Proliferasi sel dan induksi apoptosis dipelajari dengan menganalisis jumlah relatif sel yang hidup menggunakan uji pengecualian biru tripan (B), morfologi sel (skala batang: 20 μm) (C), dan histogram kandungan DNA yang diperoleh dengan flow cytometry (D dan E, atas). Distribusi sel dalam fase siklus sel (D dan E, kiri bawah) dan persentase kejadian sub-G1 (D dan E, kanan bawah) disimpulkan dari histogram ini. Hasilnya dinyatakan sebagai mean ± SD (batang galat) dari tiga percobaan independen. Selain itu, pembelahan caspase-3 dan PARP dipelajari dengan western blot (F). *** P < 0,001 (Uji t Student ).
Kami menunjukkan bahwa belinostat menunjukkan efek sitostatik pada sel SKOV3 dan IGROV1-R10 ketika digunakan pada konsentrasi 0,5 μ m dan 1 μ m , masing-masing. Dengan demikian, pengobatan dengan konsentrasi ini sangat membatasi peningkatan jumlah sel yang hidup seiring berjalannya waktu, sebagaimana dibuktikan oleh kurva pertumbuhan (Gbr. 1B ) dan tingkat konfluensi sel (Gbr. 1C ). Efek antiproliferatif ini dikaitkan dengan blok siklus sel G2/M pada 24 jam (Gbr. 1D,E , atas). Dibandingkan dengan kontrol, jumlah relatif sel dalam fase G2/M meningkat 2,1 kali lipat pada sel SKOV3 yang diobati dengan belinostat 0,5 μ m dan 1,6 kali lipat pada sel IGROV1-R10 yang diobati dengan belinostat 1 μ m , dan selanjutnya meningkat sebagai respons terhadap konsentrasi yang lebih tinggi (Gbr. 1D,E , kiri bawah).
Selain itu, belinostat menginduksi apoptosis dari 1 μ m pada lini sel SKOV3 dan dari 2 μ m pada lini sel IGROV1-R10. Memang, pengobatan dengan konsentrasi ini menyebabkan pengurangan jumlah sel yang hidup seiring berjalannya waktu (Gbr. 1B ), yang dikaitkan dengan pelepasan sel (Gbr. 1C ) dan munculnya puncak sub-G1 yang tinggi (Gbr. 1D,E , atas). Secara khusus, persentase kejadian sub-G1 mencapai 44% pada sel SKOV3 dan 61% pada sel IGROV1-R10 setelah pengobatan 48 jam dengan belinostat 1 μ m dan 2 μ m , masing-masing (Gbr. 1D,E , kanan bawah). Akhirnya, induksi kematian sel apoptosis sebagai respons terhadap konsentrasi ini dikonfirmasi oleh deteksi pembelahan caspase-3 dan PARP (Gbr. 1F ).
Secara keseluruhan, hasil ini menunjukkan bahwa belinostat memberikan efek anti-proliferatif dan pro-apoptosis pada kedua garis sel, dengan sel SKOV3 tampaknya lebih sensitif daripada sel IGROV1-R10.
3.2 Belinostat menginduksi ekspresi Bim dan Puma dan sebagian menghambat ekspresi Bcl-x L , bahkan pada konsentrasi sub-apoptotik
Kami kemudian mengeksplorasi efek belinostat pada ekspresi protein keluarga Bcl-2 yang sebelumnya telah dijelaskan sebagai krusial untuk mengatur apoptosis sel kanker ovarium [ [ 7 – 10 ] ]. Perawatan 24 jam dengan belinostat menginduksi peningkatan ekspresi protein Bim dan Puma yang bergantung pada konsentrasi di kedua lini sel (Gbr. 2A ). Menariknya, peningkatan regulasi ini diamati bahkan sebagai respons terhadap konsentrasi sitostatik (0,5 μ m di lini sel SKOV3 dan 1 μ m di lini sel IGROV1-R10). Sedikit peningkatan ekspresi protein Noxa juga terdeteksi, tetapi hanya sebagai respons terhadap konsentrasi apoptosis (1 μ m di sel SKOV3 dan 2 μ m di sel IGROV1-R10). Lebih jauh lagi, belinostat menimbulkan penurunan ekspresi protein Bcl-x L yang bergantung pada konsentrasi , dengan penghambatan terkuat (50%) diamati pada konsentrasi apoptosis (Gbr. 2B ). Sebaliknya, pengobatan belinostat memiliki dampak kecil pada ekspresi protein Mcl-1. Perlu dicatat bahwa variasi dalam ekspresi protein Bim, Puma, Noxa, dan Bcl-x L sebagai respons terhadap belinostat disertai dengan variasi yang sesuai dalam ekspresi mRNA masing-masing (Gbr. 2C ).
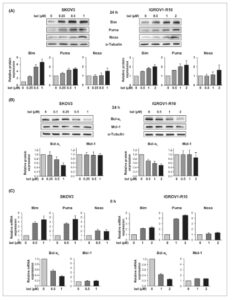
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Belinostat menginduksi ekspresi Bim dan Puma dan sebagian menghambat ekspresi Bcl-x L , bahkan pada konsentrasi sub-apoptotik. Efek belinostat (bel) pada berbagai konsentrasi pada ekspresi protein pro-apoptotik Bim, Puma, dan Noxa (A) dan protein anti-apoptotik Bcl-x L dan Mcl-1 (B) dalam lini sel SKOV3 dan IGROV1-R10 diselidiki dengan western blot pada 24 jam. Tingkat ekspresi protein ini diukur menggunakan perangkat lunak ImageJ dan dinormalisasi dengan α-tubulin. Histogram menggambarkan ekspresi protein relatif dalam sel yang diobati yang dinormalisasi dengan sel kontrol. Hasilnya dinyatakan sebagai mean ± SD (batang galat) dari tiga (A) atau empat (B) percobaan independen. Efek belinostat pada berbagai konsentrasi pada ekspresi mRNA Bim, Puma, Noxa, Bcl-x L , dan Mcl-1 dalam lini sel SKOV3 dan IGROV1-R10 dinilai dengan RT-qPCR pada 8 jam (C). GAPDH digunakan sebagai referensi gen untuk normalisasi. Histogram menunjukkan ekspresi mRNA relatif dalam sel yang diobati yang dinormalisasi dengan sel kontrol. Hasilnya dinyatakan sebagai mean ± SD (batang galat) dari tiga (untuk Noxa dan Mcl-1) atau empat (untuk Bim, Puma, dan Bcl-x L ) eksperimen independen.
Karena protein Bim, Puma, dan Noxa meningkat dalam menanggapi konsentrasi apoptotik belinostat, kami bertujuan untuk menentukan apakah mereka dapat memainkan peran dalam efek sitotoksiknya. Menggunakan siRNA, kami menghambat ekspresi masing-masing protein ini dalam sel SKOV3 dan IGROV1-R10 sebelum memaparkannya pada konsentrasi apoptotik belinostat (Gbr. S1A ). Pada sel SKOV3, penilaian jumlah relatif sel yang hidup dan persentase kejadian sub-G1 menunjukkan bahwa penghambatan Noxa melindungi sel dari apoptosis yang diinduksi belinostat (Gbr. S1B , panel kiri). Hal ini dikonfirmasi oleh peningkatan konfluensi sel dan tidak adanya pembelahan caspase-3 yang diamati pada sel yang diobati di mana Noxa telah dibungkam (Gbr. S1C,D , panel kiri). Pada sel IGROV1-R10, hasil kami secara kolektif menunjukkan bahwa Bim mungkin berperan dalam efek apoptosis belinostat, karena penghambatan ekspresinya sebagian melindungi sel dari kematian (Gbr. S1B–D , panel kanan).
Karena belinostat yang digunakan pada konsentrasi sitostatik meningkatkan ekspresi Bim dan Puma sementara sebagian menekan ekspresi Bcl-x L , kami berhipotesis bahwa menggabungkannya dengan strategi menghambat protein sisa Bcl-x L atau Mcl-1 mungkin efektif dalam menginduksi apoptosis pada sel kanker ovarium.
3.3 Penghambatan Bcl-x L membuat garis sel kanker ovarium SKOV3 dan IGROV1-R10 menjadi sensitif terhadap belinostat
Kami pertama kali menyelidiki apakah pembungkaman ekspresi Bcl-x L menggunakan siRNA dapat mempotensiasi efek belinostat ketika digunakan pada konsentrasi sitostatik pada sel SKOV3 dan IGROV1-R10. Kami memeriksa bahwa ekspresi protein anti-apoptotik ini ditekan 48 jam setelah transfeksi dengan si-Bcl-x L , apakah sel tersebut diobati dengan belinostat atau tidak (Gbr. 3A ). Menariknya, menghambat ekspresi Bcl-x L membuat sel SKOV3 dan IGROV1-R10 peka terhadap belinostat, sehingga menghasilkan induksi kematian sel apoptosis. Hal ini dibuktikan dengan penurunan jumlah sel yang hidup dan peningkatan bersamaan dalam persentase kejadian sub-G1 yang diamati dalam kondisi si-Bcl-x L /belinostat, dibandingkan dengan kondisi si-Bcl-x L /DMSO dan si-Ctrl/belinostat (Gbr. 3B ). Hal ini juga didukung oleh deteksi pembelahan caspase-3 dan PARP yang signifikan pada kondisi si-Bcl-x L /belinostat (Gambar 3C ).
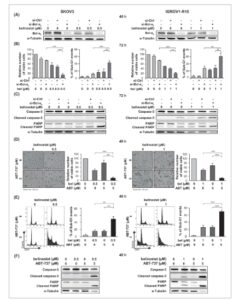
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Penghambatan Bcl-x L membuat garis sel kanker ovarium SKOV3 dan IGROV1-R10 menjadi sensitif terhadap belinostat. Sel SKOV3 (kolom kiri) dan IGROV1-R10 (kolom kanan) ditransfeksi dengan siRNA Kontrol (si-Ctrl) atau Bcl-x L (si-Bcl-x L ) dan diobati 24 jam kemudian dengan belinostat (bel) pada konsentrasi sitostatik (A–C). Kemanjuran pembungkaman Bcl-x L dipantau dengan western blot 48 jam setelah transfeksi (A). Dampak dari menggabungkan pengobatan belinostat dengan penghambatan Bcl-x L diselidiki pada 72 jam dengan menganalisis jumlah relatif sel yang hidup menggunakan uji pengecualian biru trypan dan persentase kejadian sub-G1 yang diperoleh dengan flow cytometry (B), serta dengan mempelajari pembelahan caspase-3 dan PARP dengan western blot (C). Sel SKOV3 (kolom kiri) dan IGROV1-R10 (kolom kanan) diobati dengan belinostat pada konsentrasi sitostatik dan penghambat Bcl-x L ABT-737 pada 5 μm selama 48 jam (D–F). Kemanjuran pengobatan bersama dieksplorasi dengan menganalisis morfologi sel (skala batang: 20 μm) dan jumlah relatif sel yang hidup menggunakan uji pengecualian biru trypan (D), histogram kandungan DNA dan persentase kejadian sub-G1, keduanya diperoleh dengan flow cytometry (E), dan pembelahan caspase-3 dan PARP yang dideteksi oleh western blot (F). Hasil yang ditunjukkan dalam grafik dinyatakan sebagai mean ± SD (batang galat) dari empat (B) atau tiga (D dan E) eksperimen independen. ** P < 0,01; *** P < 0,001 ( Uji-t Student ).
Aktivitas Bcl-x L dapat dihambat menggunakan molekul-molekul BH3-mimetik, seperti ABT-737, yang mengikat dengan afinitas tinggi pada alur hidrofobik Bcl-x L , Bcl-2, dan Bcl-w dan menghambat fungsi anti-apoptosis mereka [ [ 25 ] ]. Kami kemudian mengevaluasi dampak pengobatan yang menggabungkan belinostat pada konsentrasi sitostatik dengan ABT-737 pada 5 μm selama 48 jam. Berbeda dengan pengobatan dengan salah satu molekul ini saja, pengobatan bersama memicu pelepasan sel utama di kedua lini sel, disertai dengan pengurangan drastis dalam jumlah sel yang hidup (Gbr. 3D ). Ini adalah konsekuensi dari induksi apoptosis yang kuat, seperti yang didukung oleh puncak sub-G1 yang tinggi (Gbr. 3E ) dan pembelahan caspase-3 dan PARP yang nyata (Gbr. 3F ). Persentase kejadian sub-G1 sebagai respons terhadap pengobatan kombinasi mencapai 49% dalam sel SKOV3 (dibandingkan dengan sekitar 15% sebagai respons terhadap belinostat atau ABT-737 saja, Gambar 3E , panel kiri) dan 70% dalam sel IGROV1-R10 (dibandingkan dengan sekitar 25% sebagai respons terhadap belinostat atau ABT-737 saja, Gambar 3E , panel kanan). Efek apoptotik serupa diperoleh dengan menggabungkan belinostat dengan inhibitor selektif Bcl-x L , A-1331852 (Gambar S2A–C ) [ [ 26 ] ].
Sebagai kesimpulan, menghambat ekspresi atau aktivitas Bcl-x L merupakan strategi yang relevan untuk meningkatkan efek antikanker belinostat pada sel SKOV3 dan IGROV1-R10.
3.4 Penghambatan Mcl-1 membuat garis sel kanker ovarium IGROV1-R10 menjadi sensitif terhadap belinostat
Tujuan kami berikutnya adalah untuk mengeksplorasi dampak penghambatan Mcl-1 pada respons sel SKOV3 dan IGROV1-R10 terhadap belinostat yang digunakan pada konsentrasi sitostatik. Kami pertama-tama menekan ekspresi protein Mcl-1 menggunakan siRNA (Gbr. 4A ). Pada lini sel SKOV3, pembungkaman Mcl-1 tidak mengubah respons sel terhadap belinostat 0,5 μ m (Gbr. 4B,C , panel kiri). Sebaliknya, penghambatan ekspresi Mcl-1 secara efektif membuat sel IGROV1-R10 peka terhadap belinostat yang digunakan pada konsentrasi sitostatik. Sel yang ditransfeksi dengan si-Mcl-1 dan diobati dengan belinostat menunjukkan penurunan signifikan pada jumlah sel yang hidup dan akumulasi substansial peristiwa sub-G1 (Gbr. 4B , panel kanan), serta pembelahan caspase-3 dan PARP yang lebih jelas (Gbr. 4C , panel kanan), dibandingkan dengan kondisi si-Mcl-1/DMSO dan si-Ctrl/belinostat.
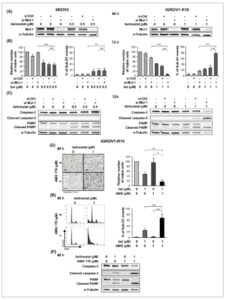
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Penghambatan Mcl-1 membuat lini sel kanker ovarium IGROV1-R10 menjadi lebih sensitif terhadap belinostat. Sel SKOV3 (kolom kiri) dan IGROV1-R10 (kolom kanan) ditransfeksi dengan siRNA Kontrol (si-Ctrl) atau Mcl-1 (si-Mcl-1) dan diobati 24 jam kemudian dengan belinostat (bel) pada konsentrasi sitostatik (A–C). Kemanjuran pembungkaman Mcl-1 dipantau dengan western blot 48 jam setelah transfeksi (A). Dampak dari menggabungkan pengobatan belinostat dengan penghambatan Mcl-1 diteliti pada 72 jam dengan menganalisis jumlah relatif sel yang hidup menggunakan uji pengecualian biru trypan dan persentase kejadian sub-G1 yang diperoleh dengan flow cytometry (B), serta dengan mempelajari pembelahan caspase-3 dan PARP dengan western blot (C). Sel IGROV1-R10 diobati dengan belinostat pada konsentrasi sitostatik dan penghambat Mcl-1 AMG 176 pada 1 μm selama 48 jam (D–F). Kemanjuran pengobatan bersama dieksplorasi dengan menganalisis morfologi sel (skala batang: 20 μm) dan jumlah relatif sel yang hidup menggunakan uji pengecualian biru trypan (D), histogram kandungan DNA dan persentase kejadian sub-G1, keduanya diperoleh dengan flow cytometry (E), dan pembelahan caspase-3 dan PARP yang dideteksi oleh western blot (F). Hasil yang ditunjukkan dalam grafik dinyatakan sebagai mean ±SD (batang galat) dari empat (B) atau tiga (D dan E) percobaan independen. NS: tidak signifikan; ** P < 0,01; *** P < 0,001 (uji- t Student ).
Kami kemudian berusaha untuk mengonfirmasi hasil ini menggunakan AMG 176, senyawa BH3-mimetik yang menghambat aktivitas Mcl-1 dengan afinitas dan selektivitas tinggi [ [ 27 ] ], dalam sel IGROV1-R10. Perlakuan yang menggabungkan belinostat (1 μ m ) dan AMG 176 (1 μ m ) selama 48 jam terbukti sangat efektif dalam menginduksi apoptosis pada sel-sel ini. Perlakuan bersama ini menyebabkan hilangnya lapisan sel yang melekat, dengan jumlah relatif sel yang hidup menurun hingga 17% (Gbr. 4D ), sementara secara dramatis meningkatkan keberadaan badan apoptosis, dengan persentase kejadian sub-G1 sebesar 68% (Gbr. 4E ). Pembelahan caspase-3 dan PARP yang signifikan yang diamati sebagai respons terhadap kombinasi belinostat/AMG 176 selanjutnya mengonfirmasi kemanjurannya (Gbr. 4F ). Sebaliknya, pada konsentrasi yang digunakan, baik AMG 176 maupun belinostat sendiri tidak menunjukkan efek apoptosis utama (Gbr. 4D–F ).
Secara keseluruhan, hasil ini menyoroti bahwa penghambatan Mcl-1 membuat sel IGROV1-R10 sensitif, tetapi tidak sel SKOV3, terhadap belinostat.
3.5 Belinostat menunjukkan efek antikanker pada model PDTO, yang ditingkatkan oleh inhibitor Bcl-x L atau Mcl-1
Tujuan akhir kami adalah untuk memvalidasi hasil kami menggunakan model yang lebih akurat mereproduksi situasi klinis daripada lini sel. Oleh karena itu, kami menilai dampak belinostat sebagai agen tunggal atau dalam kombinasi dengan inhibitor Bcl-x L atau Mcl-1 pada model organoid tumor yang berasal dari pasien.
Awalnya kami mempelajari efek pengobatan 48 jam dengan belinostat pada konsentrasi berbeda dalam model PDTO yang dibuat dari karsinoma sel jernih ovarium, yang disebut model OV-009_T. Belinostat menyebabkan perubahan struktur PDTO mulai dari 1 μ m (Gbr. 5A ) dan menyebabkan penurunan viabilitas yang bergantung pada konsentrasi (IC50 = 1,07 μ m ) (Gbr. 5B ). Efek ini berkorelasi dengan induksi apoptosis, yang didukung oleh peningkatan aktivitas caspase-3/7 sebagai respons terhadap pengobatan (Gbr. 5C ) dan munculnya pembelahan caspase-3 yang dideteksi oleh imunohistokimia (Gbr. 5D ). Kami kemudian menggabungkan belinostat pada konsentrasi yang berdampak lemah pada viabilitas (0,5 μ m ) dengan inhibitor Bcl-x L (ABT-737) atau Mcl-1 (AMG 176). Menariknya, baik ABT-737 maupun AMG 176 mensensitisasi OV-009_T PDTO terhadap belinostat, seperti yang ditunjukkan oleh penurunan signifikan dalam viabilitasnya sebagai respons terhadap pengobatan gabungan (viabilitas 23% dan 42% sebagai respons terhadap kombinasi belinostat/ABT-737 dan belinostat/AMG 176, masing-masing), dibandingkan dengan masing-masing molekul saja (viabilitas 78%, 88%, dan 94% sebagai respons terhadap belinostat, ABT-737, dan AMG 176, masing-masing; Gambar 5E ). Hasil serupa diperoleh ketika ABT-737 digantikan dengan inhibitor selektif Bcl-x L A-1331852, yang mengonfirmasi bahwa efek sensitisasi ABT-737 dapat dikaitkan dengan penghambatan Bcl-x L (Gambar S2D ).
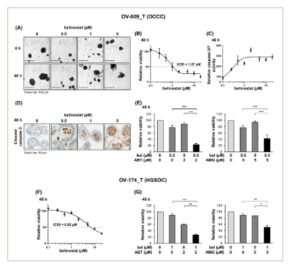
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Belinostat menunjukkan efek antikanker dalam model PDTO, yang ditingkatkan oleh inhibitor Bcl-x L atau Mcl-1. Model PDTO OV-009_T, yang dibuat dari OCCC, diobati selama 48 jam dengan belinostat pada berbagai konsentrasi (A–D). Dampak belinostat pada PDTO diteliti dengan menganalisis morfologinya (skala batang: 400 μm) (A), viabilitasnya, yang dinilai oleh uji viabilitas sel CellTiter-Glo®3D (B), aktivitas caspase-3/7, yang dinilai oleh uji Caspase-Glo ® 3/7 (C) dan pembelahan caspase-3 yang dideteksi oleh imunohistokimia (skala batang: 50 μm) (D). PDTO OV-009_T diobati bersama selama 48 jam dengan belinostat (bel) pada 0,5 μ m (konsentrasi toksik rendah) dan penghambat Bcl-x L ABT-737 pada 2 μ m (E, panel kiri) atau penghambat Mcl-1 AMG 176 pada 5 μ m (E, panel kanan). Efek dari kombinasi ini dianalisis dengan mengevaluasi viabilitas PDTO menggunakan uji viabilitas sel CellTiter-Glo ® 3D. Model PDTO OV-174_T, yang dibuat dari HGSOC, diobati selama 48 jam dengan belinostat pada berbagai konsentrasi (F) atau diobati bersama dengan belinostat pada 1 μ m (konsentrasi toksik rendah) dan ABT-737 pada 2 μ m (G, panel kiri) atau AMG 176 pada 5 μ m (G, panel kanan). Efek dari perawatan dianalisis dengan mengevaluasi viabilitas PDTO menggunakan uji viabilitas sel 3D CellTiter-Glo ® . Hasil grafik yang ditunjukkan pada (E) dan (G) dinyatakan sebagai rerata ± SD (batang galat) dari empat dan dua percobaan independen, masing-masing. * P < 0,05; ** P < 0,01; *** P < 0,001 (Uji t Student ).
Akhirnya kami menyelidiki efek belinostat dalam model PDTO kedua, OV-174_T, yang berasal dari karsinoma ovarium serosa tingkat tinggi. Terungkap bahwa model ini kurang sensitif terhadap belinostat dibandingkan model OV-009_T (IC50 = 6,82 μ m ) (Gbr. 5F ). Akan tetapi, baik ABT-737 maupun AMG 176 juga secara efisien mensensitisasi model PDTO ini terhadap belinostat (Gbr. 5G ).
Secara kolektif, hasil yang diperoleh dalam dua model PDTO yang berasal dari OCCC atau HGSOC mengonfirmasi temuan kami sebelumnya, yang menunjukkan bahwa belinostat menampilkan sifat antikanker, yang ditingkatkan dengan adanya penghambat Bcl-x L atau Mcl-1.
4 Diskusi
Meskipun perkembangan terkini yang dicapai melalui pengembangan penghambat PARP, penerapan terapi terarah untuk pengobatan karsinoma ovarium masih tertinggal dibandingkan dengan keganasan lainnya. Hal ini sebagian menjelaskan mengapa prognosis patologi ini tetap buruk dan menekankan perlunya mengidentifikasi strategi terapi baru.
Pekerjaan kami sebelumnya telah menunjukkan bahwa pada sel kanker ovarium, ambang batas untuk memicu apoptosis dapat dicapai dengan mengurangi rasio [Bcl-x L dan Mcl-1]/[Bim, Puma, dan Noxa]. Memang, kami awalnya menunjukkan bahwa penghambatan simultan ekspresi protein anti-apoptosis Bcl-x L dan Mcl-1 menggunakan siRNA menginduksi kematian sel masif pada lini sel kanker ovarium [ [ 7 ] ]. Lebih jauh lagi, kami menemukan bahwa peningkatan ekspresi mitra BH3-only pro-apoptosis mereka, Bim, Puma, dan Noxa, menggunakan inhibitor MEK yang dikombinasikan dengan inhibitor mTOR atau antagonis reseptor α 1 -adrenergik, juga disertai dengan induksi apoptosis [ [ 8 , 10 ] ]. Karena ekspresi protein pro-apoptotik ini dapat dihambat oleh deasetilasi histon [ [ 11 – 13 ] ], tujuan dari penelitian ini adalah untuk menilai kemanjuran belinostat, penghambat HDAC yang digunakan secara klinis, dalam meningkatkan tingkat ekspresinya dan menginduksi kematian sel apoptosis pada kanker ovarium.
Kami pertama kali menyelidiki efek belinostat pada lini sel kanker ovarium resistan-platinum SKOV3 dan IGROV1-R10. Hasil kami menunjukkan bahwa belinostat memberikan (i) efek sitostatik pada konsentrasi rendah, terkait dengan blok G2/M, dan (ii) efek apoptosis pada konsentrasi yang lebih tinggi. Lini sel SKOV3 tampaknya lebih sensitif terhadap inhibitor HDAC ini daripada lini sel IGROV1-R10. Hasil ini konvergen dengan dua penelitian sebelumnya yang terutama dilakukan pada lini sel kanker ovarium A2780. Belinostat menghambat pertumbuhan sel A2780 ketika dikultur in vitro dan xenograft in vivo [ [ 28 , 29 ] ], dan menginduksi apoptosis in vitro , meskipun pada konsentrasi yang sangat tinggi (10 kali lipat lebih tinggi daripada IC50) [ [ 28 ] ].
Bahasa Indonesia: Untuk memvalidasi minat terapeutik belinostat dalam model praklinis kanker ovarium yang menunjukkan relevansi klinis yang lebih besar daripada lini sel 2D tradisional, kami memilih organoid tumor yang berasal dari pasien. Model tiga dimensi ini menawarkan keuntungan dari rekapitulasi fitur histologis dan genomik tumor tempat mereka berasal [ [ 30 ] ]. Selain itu, respons mereka terhadap pengobatan telah terbukti berkorelasi dengan respons klinis pasien [ [ 24 , 31 ] ]. Akibatnya, mereka muncul sebagai tolok ukur baru untuk model praklinis, dengan potensi besar dalam pengobatan presisi dalam onkologi [ [ 32 ] ]. Kami mempelajari dampak belinostat pada PDTO yang berasal dari dua tumor ovarium dengan subtipe histologis yang berbeda: satu dari OCCC, bentuk kanker ovarium langka yang menunjukkan fenotipe resistan obat, dan yang lainnya dari HGSOC, jenis kanker ovarium yang paling umum. Menariknya, belinostat menunjukkan efek antikanker dalam model turunan OCCC (model OV-009_T), konsisten dengan temuan kami sebelumnya [ [ 24 ] ], serta dalam model turunan HGSOC (model OV-174_T). Yang paling sensitif dari kedua model tersebut adalah OV-009_T. Dalam PDTO ini, penurunan viabilitas berkorelasi dengan induksi apoptosis, sebagaimana dibuktikan oleh peningkatan aktivitas caspase-3/7 dan deteksi pembelahan caspase-3 dengan imunohistokimia. Caspase-3 yang terbelah diamati terlokalisasi di bagian tengah PDTO daripada di lapisan sel luar yang menempel pada matriks, sebagaimana dijelaskan di tempat lain [ [ 33 ] ]. Hal ini dapat dijelaskan oleh sinyal pro-survival yang berasal dari matriks ekstraseluler yang dapat melawan sinyal apoptosis. Efek antikanker belinostat sebelumnya telah dinilai pada model 3D kanker ovarium lainnya – organoid yang dihasilkan dari lini sel yang berasal dari pasien HGSOC – dalam sebuah penelitian yang menyaring 22 obat atau kombinasi obat yang relevan secara klinis [ [ 34 ] ]. Dengan menggunakan uji berbasis mikroskopi otomatis untuk menilai kematian sel yang diinduksi obat dan penghambatan proliferasi, penulis menyoroti bahwa belinostat adalah salah satu agen terapeutik yang paling efektif. Namun, kemanjuran belinostat tampaknya cukup sederhana dalam uji klinis fase II, meskipun molekul ini ditoleransi dengan baik, dengan kelelahan dan mual yang merupakan efek samping yang paling umum [ [ 35 ]]. Dalam uji klinis yang dilakukan pada pasien dengan kanker ovarium rekuren yang resistan terhadap platinum, penyakit stabil diamati pada 9 dari 15 kasus. Mengidentifikasi penanda prediktif respons terhadap belinostat dan/atau menggabungkannya dengan molekul lain dapat meningkatkan kemanjuran klinisnya. Hubungan belinostat dengan karboplatin dan paclitaxel telah menunjukkan manfaat klinis pada pasien kanker ovarium yang sebelumnya telah menjalani pengobatan berat [ [ 36 ] ].
Seperti yang diharapkan, belinostat meningkatkan ekspresi protein Bim, Puma, dan Noxa pada lini sel kanker ovarium kami. Peningkatan ekspresi protein Bim yang diinduksi belinostat juga telah dilaporkan pada lini sel leukemia [ [ 37 ] ] dan limfoma [ [ 38 ] ], serta pada model karsinoma paru [ [ 39 ] ], sementara induksi protein Noxa sebagai respons terhadap inhibitor HDAC ini telah dijelaskan pada lini sel limfoma [ [ 40 ] ]. Namun, sepengetahuan kami, peningkatan ekspresi protein Puma sebagai respons terhadap belinostat belum pernah didokumentasikan sebelumnya. Belinostat juga menurunkan sebagian ekspresi protein Bcl-x L pada sel SKOV3 dan IGROV1-R10, seperti yang sebelumnya diamati pada model leukemia [ [ 37 ] ], kanker pankreas [ [ 19 ] ], dan kanker prostat [ [ 20 ] ]. Perubahan dalam tingkat ekspresi protein Bim, Puma, Noxa, dan Bcl-x L dikaitkan dengan perubahan yang sesuai dalam tingkat ekspresi mRNA masing-masing, yang menunjukkan keterlibatan mekanisme transkripsi. Konsentrasi belinostat yang menghasilkan rasio [Bcl-x L dan Mcl-1]/[Bim, Puma, dan Noxa] terendah (1 μm dalam sel SKOV3 dan 2 μm dalam sel IGROV1-R10) adalah yang memicu kematian sel apoptosis. Perlu dicatat, Noxa dan Bim yang diinduksi belinostat ditemukan berperan dalam apoptosis ini pada sel SKOV3 dan IGROV1-R10, masing-masing. Namun, peningkatan ekspresi Bim dan Puma dan penghambatan parsial ekspresi Bcl-x L sudah dapat diamati sebagai respons terhadap konsentrasi sitostatik belinostat, meskipun pada tingkat yang lebih rendah. Kami berhipotesis bahwa dalam kondisi ini, Bim dan Puma tetap dibuffer oleh Mcl-1 dan/atau sisa Bcl-x L , sehingga mencegah apoptosis. Oleh karena itu, kami menyelidiki dampak penggabungan belinostat pada konsentrasi sitostatik dengan strategi yang menghambat Bcl-x L atau Mcl-1.
Menghambat Bcl-x L menggunakan siRNA atau BH3-mimetik ABT-737 atau A-1331852 sangat efektif dalam mensensitisasi lini sel kanker ovarium terhadap belinostat. Penelitian sebelumnya telah melaporkan kemanjuran asosiasi inhibitor HDAC lainnya, seperti vorinostat, dengan ABT-737 atau turunannya yang tersedia secara oral ABT-263, dalam model praklinis kanker hematologi [ [ 41 – 44 ] ] dan tumor padat [ [ 45 – 47 ] ]. Namun, asosiasi tersebut belum pernah dinilai dalam model praklinis kanker ovarium sebelumnya. Selain itu, penelitian kami memberikan bukti pertama tentang potensi antikanker dari menggabungkan inhibitor HDAC belinostat dengan inhibitor Bcl-x L. Menariknya, khasiat pengobatan bersama belinostat/ABT-737 dikonfirmasi dalam dua model PDTO kami, terlepas dari (i) subtipe histologis tumor tempat tumor tersebut terbentuk (HGSOC atau OCCC) dan (ii) sensitivitasnya terhadap belinostat. Mengganti ABT-737 dengan A-1331852 tidak mengubah khasiat kombinasi, yang menunjukkan bahwa efek sensitisasi ABT-737 memang disebabkan oleh penghambatan Bcl-x L. Evaluasi asli dari kombinasi penghambat HDAC dengan penghambat Bcl-x L dalam model praklinis 3D yang merangkum karakteristik tumor padat pasien selanjutnya mendukung potensi klinis dari strategi tersebut.
Penghambatan Mcl-1 telah terbukti memperkuat efek antikanker dari penghambat HDAC (panobinostat) dalam model kanker hematologi [ [ 48 , 49 ] ]. Namun, kemanjuran strategi tersebut masih harus dieksplorasi dalam model tumor padat. Ini tampaknya sangat relevan karena resistensi terhadap penghambat HDAC vorinostat telah dilaporkan bergantung pada tingkat fosforilasi Mcl-1 dalam model kanker usus besar [ [ 50 ] ]. Kami pertama-tama mengeksplorasi potensi apoptosis dengan menggabungkan penghambatan Mcl-1 dengan belinostat pada konsentrasi sitostatik dalam lini sel kanker ovarium kami. Membungkam ekspresi Mcl-1 menggunakan siRNA cukup untuk menurunkan ambang apoptosis cukup untuk membuat sel IGROV1-R10 peka terhadap belinostat. Sesuai dengan itu, kombinasi belinostat dengan AMG 176 yang meniru BH3 menyebabkan kematian sel besar-besaran dalam lini sel ini. Sebaliknya, penghambatan Mcl-1 tidak membuat sel SKOV3 peka terhadap belinostat. Data kami sebelumnya menunjukkan bahwa dalam keadaan basal, sel SKOV3 menampilkan rasio ekspresi protein Bcl-x L / Mcl-1 sekitar 4 kali lipat lebih tinggi daripada sel IGROV1-R10, karena tingkat ekspresi Mcl-1 yang lebih rendah [ [ 10 ] ]. Perbedaan dalam rasio protein ini antara garis sel dipertahankan sebagai respons terhadap belinostat, karena molekul ini mengurangi ekspresi Bcl-x L secara cukup mirip di kedua garis sel dan tidak memodulasi ekspresi Mcl-1. Oleh karena itu, dapat dihipotesiskan bahwa sel SKOV3 lebih bergantung pada Bcl-x L daripada pada Mcl-1 untuk kelangsungan hidup mereka dibandingkan dengan sel IGROV1-R10, bahkan sebagai respons terhadap belinostat. Namun, dalam dua model PDTO kami, kombinasi belinostat/AMG 176 menunjukkan aktivitas antikanker yang efektif, mendukung konsep bahwa penghambatan Mcl-1 akan menjadi strategi yang menjanjikan untuk membuat tumor ovarium peka terhadap belinostat.
5 Kesimpulan
Sebagai kesimpulan, penelitian kami menggarisbawahi potensi antikanker belinostat, yang digunakan sendiri atau dikombinasikan dengan inhibitor Bcl-x L atau Mcl-1, dalam model praklinis kanker ovarium. Secara khusus, menunjukkan kemanjuran strategi ini dalam PDTO yang terbentuk dari karsinoma ovarium dengan subtipe histologis yang berbeda menekankan relevansi klinisnya. Sementara belinostat adalah molekul terapeutik yang disetujui FDA, penggunaan klinis molekul BH3-mimetik yang menargetkan Bcl-x L atau Mcl-1 saat ini terbatas karena toksisitas yang ditimbulkannya pada trombosit dan kardiomiosit. Kita dapat berharap bahwa penggunaan molekul ini dalam kombinasi dengan belinostat dapat memungkinkan pengurangan dosisnya ke tingkat di mana toksisitasnya menjadi dapat dikelola. Alternatifnya, pendekatan untuk menghambat Bcl-x L atau Mcl-1 sambil menghindari trombositopenia atau toksisitas jantung mencakup penggunaan proteolysis-targeting chimeras (PROTAC) yang menyebabkan degradasi target mereka dalam cara spesifik jaringan [ [ 51 , 52 ] ] atau konjugat antibodi-obat (ADC) yang secara selektif mengirimkan inhibitor ke sel tumor [ [ 53 ] ]. Dengan demikian, penelitian kami membuka jalan bagi pengembangan strategi terapi berbasis belinostat untuk kanker ovarium, dengan biomarker prediktif respons yang masih harus diidentifikasi.
