Abstrak
Onkoprotein KRAS merupakan pemicu tumor yang sering terjadi pada kanker paru-paru, pankreas, dan kolorektal dan telah terbukti menjadi target farmasi yang menantang. Terapi pertama yang ditargetkan pada KRAS kini sedang diuji dalam uji klinis, tetapi konsekuensi dari penargetan yang lebih disukai pada status GDP atau GTP dari KRAS dan relevansi pengelompokan nano RAS masih belum jelas. Di sini kami melaporkan Protein Pengulangan Ankyrin yang Dirancang (DARPin) yang mengenali daerah sakelar RAS I/II dengan afinitas n m rendah , terlepas dari ikatan nukleotida (status GDP atau GTP). DARPin ini, yang disebut ‘784_F5’, menempati lobus pengenalan efektor, yang mengakibatkan gangguan pada aktivasi yang dimediasi SOS, interaksi efektor hilir RAS, dan pengelompokan nano KRAS. Akibatnya, DARPin anti-RAS ini secara ampuh memblokir pensinyalan hilir, yang mengarah pada pengurangan yang kuat dalam proliferasi dan pertumbuhan yang tidak bergantung pada penjangkaran pada lini sel yang bergantung pada RAS. Kami menunjukkan bahwa ekspresi ‘784_F5’, pan-RAS, DARPin independen nukleotida dapat menyebabkan regresi tumor dalam model xenograft kolorektal yang mungkin menjanjikan untuk penyelidikan dan pengembangan lebih lanjut.
Singkatan
BERTINDAK
protein kinase B (timoma strain tikus AKR)
BCA
pengujian asam bicinchoninat
BRET
transfer energi resonansi bioluminesensi
Bahasa Indonesia: CMV
sitomegalovirus
DARPIN
Protein Pengulangan Ankyrin yang Dirancang
Bahasa Indonesia: DMEM
Dulbecco’s Modified Eagle Ukuran Sedang
DTT
ditiotreitol
Asam EDTA
asam etilendiamintetraasetat
Tes ELISA
uji imunosorben terkait enzim
FCS
serum janin sapi
PDB
guanosin difosfat
GMP-PNP
5′-guanosin-β,γ-imidodifosfat
GTP
guanosin-5′-trifosfat
GTPγS
guanosin 5′-O-(3-thio)trifosfat
DIA
Pewarnaan Hematoksilin & Eosin
HPLC
kromatografi cair kinerja tinggi
HRAS
Homolog onkogen virus sarkoma tikus Harvey
HTRF
fluoresensi waktu-terselesaikan homogen
Bahasa Indonesia: IMAC
kromatografi afinitas ion logam terimobilisasi
AKU P
imunopresipitasi
Bahasa Indonesia: IPTG
isopropil β- d -thiogalactopyranoside
KD
konstanta disosiasi kesetimbangan
KRIS
Homolog onkogen virus sarkoma tikus Kirsten
LNP (Lembaga Penerbangan dan Antariksa Nasional)
nanopartikel lipid
Bahasa Inggris
antibodi monoklonal
PETA/ERK
mitogen-activated protein kinase/kinase yang diatur oleh sinyal ekstraseluler
Bahasa Indonesia: mTOR
target mamalia rapamycin
MWCO
batas berat molekul
Ester NHS
Ester N -hidroksisuksimida
NMR
resonansi magnetik nuklir
NRAS
homolog onkogen virus neuroblastoma RAS
Tikus NSG
Tikus NOD scid gamma
Bahasa Indonesia: PBS
garam penyangga fosfat
PDB
Bank Data Protein
PI3K
fosfatidilinositol-3-kinase
Sistem Pemrosesan Akhir (PLC)
fosfolipase C
Bahasa Inggris QET
memadamkan transfer energi resonansi
Angkatan Udara
fibrosarkoma yang dipercepat dengan cepat
RALGD
Stimulator disosiasi nukleotida guanin Ral
RBD
Domain pengikat RAS
RPMI 1640
Institut Peringatan Taman Roswell 1640 sedang
SA
streptavidin
scFv
fragmen variabel rantai tunggal dari antibodi
SDS/HALAMAN
elektroforesis gel poliakrilamid natrium dodecyl-sulfat
SOS
putra dari tujuh orang tanpa tujuh orang
SPR
resonansi plasmon permukaan
TEV
Virus Etch Tembakau
TR-FRET
transfer energi resonansi Förster yang diselesaikan waktu
dengan/tanpa
berat/volume
1 Pendahuluan
Keluarga RAS dari GTPase kecil, termasuk KRAS, NRAS, dan HRAS, bertindak sebagai sakelar molekuler yang mengendalikan berbagai proses pensinyalan intraseluler. Sifat onkogenik anggota keluarga Ras yang bermutasi telah dikenali selama lebih dari 25 tahun [ [ 1 ] ]. Mutasi pada protein RAS ditemukan pada sekitar 19–23% kanker manusia dan sering dianggap sebagai mutasi pendorong [ [ 2 – 4 ] ]. Mutasi pada KRAS sangat umum terjadi, terjadi pada hingga 90% pankreas, 50% usus besar, dan 25% adenokarsinoma paru-paru, dan sering dikaitkan dengan prognosis yang buruk [ [ 5 , 6 ] ]. Secara umum, aktivasi terus menerus sakelar molekuler RAS, yang disebabkan oleh hilangnya aktivitas GTPase, menyebabkan inisiasi permanen pensinyalan hilir, yang mengakibatkan proliferasi sel yang tidak terkendali. Protein RAS dapat mengaktifkan berbagai efektor hilir termasuk serangkaian kinase dan faktor pertukaran nukleotida, seperti PI3K, RALGDS, RAF, dan PLC [ [ 7 ] ]. Di antara komponen pensinyalan hilir onkogenesis yang dimediasi RAS, jalur MAPK/ERK dan PI3K-AKT dianggap yang paling penting, berkontribusi secara signifikan terhadap proliferasi sel, kelangsungan hidup, invasi jaringan, dan metastasis [ [ 8 , 9 ] ].
Bahasa Indonesia : Meskipun ada upaya yang intens dan kebangkitan minat baru-baru ini dalam menargetkan anggota keluarga RAS, pilihan pengobatan untuk pasien dengan kanker yang didorong oleh RAS masih sangat terbatas [ [ 10 ] ]. Penargetan langsung protein RAS, terutama bentuk mutan KRAS, secara historis menantang karena afinitas protein yang tinggi untuk GTP dan kurangnya kantong pengikat molekul kecil yang sesuai. Hal ini menjadikan KRAS salah satu target ‘yang tidak dapat diobati’ yang paling terkenal dalam terapi kanker. Namun, penemuan kantong switch II (SII-P) oleh laboratorium Shokat menandai terobosan signifikan, yang memungkinkan pengembangan inhibitor kovalen yang secara khusus menargetkan bentuk mutan G12C dari KRAS dengan mengikat secara ireversibel pada residu sistein mutan [ [ 11 , 12 ] ]. Dalam beberapa tahun terakhir, kemajuan lebih lanjut telah dibuat dalam penargetan nonkovalen dari mutasi KRAS lainnya, terutama mutasi G12D [ [ 13 , 14 ] ]. Selain itu, pengembangan penghambat pan-KRAS dan multi-RAS(ON) merupakan pendekatan inovatif tambahan dalam lanskap penargetan RAS [ [ 15 , 16 ] ].
Pengikatan RAS dan interferensi selanjutnya dengan fungsi RAS juga dapat dicapai melalui protein eksogen. Sementara gagasan menargetkan RAS dengan biologik telah ditetapkan sejak awal [ [ 17 ] ], kemajuan signifikan dalam pengembangan pengikat RAS yang berkarakterisasi dengan baik telah dibuat dalam 20 tahun terakhir. Inhibitor RAS yang berasal dari protein yang tersedia bervariasi dalam perancah molekulernya, spesifisitas dalam hal isoform dan mutan RAS, serta kemampuannya untuk mengenali berbagai keadaan terikat nukleotida RAS. Tomazini dan Shifman baru-baru ini merangkum banyak koleksi biologik RAS yang dijelaskan hingga saat ini [ [ 18 ] ]. Pendekatan lebih lanjut telah dilaporkan di mana pengikat RAS telah dikombinasikan dengan domain E3-ligase untuk menginduksi degradasi proteasomal [ [ 19 , 20 ] ], atau di mana protease pembelah RAS telah digunakan [ [ 21 ] ] atau efektor RAS negatif dominan telah direkayasa [ [ 22 , 23 ] ].
Namun, penggunaan terapeutik protein sebagai inhibitor intraseluler saat ini dibatasi oleh teknologi pengiriman. Meskipun demikian, protein ini dapat berfungsi sebagai cetak biru untuk pengembangan obat molekul kecil atau peptida, dan teknologi pengiriman protein dan gen terus dikembangkan lebih lanjut [ [ 24 , 25 ] ]. Titik awal yang ideal untuk menyelidiki fitur penting dari obat tersebut adalah kumpulan inhibitor berdasarkan perancah yang sama yang bervariasi dalam epitop dan/atau spesifisitasnya untuk (K)RAS. Sementara set tersebut hampir lengkap untuk kelas monobodi, kelas Designed Ankyrin Repeat Proteins (DARPins) agak tidak lengkap [ [ 19 , 26 – 29 ] ]. Sampai saat ini, DARPins pan-RAS spesifik GDP dan GTP telah dijelaskan untuk lobus efektor [ [ 30 ] ]. Selain itu, DARPin agnostik keadaan nukleotida spesifik KRAS dilaporkan mengenali lobus alosterik [ [ 31 ] ].
DARPin adalah protein pengikat yang sangat stabil yang dapat dipilih terhadap sebagian besar target, menyediakan antarmuka pengikatan cekung yang berkesinambungan [ [ 32 ] ]. Dengan ukuran lebih kecil dari 20 kDa dan tidak ada jembatan disulfida, mereka mempertahankan konformasi dan aktivitasnya dalam sitosol tanpa memerlukan protein fusi penstabil [ [ 33 , 34 ] ]. Hal ini memungkinkan karakterisasi efek pengikat yang lebih langsung tanpa perlu mempertimbangkan kontribusi sterik tambahan dari protein fusi, seperti yang diperlukan dalam kasus monobodi [ [ 26 – 29 ] ].
Sebelumnya kami menyebutkan DARPin pengikat RAS yang bersaing dengan RAF untuk pengikatan RAS (disebut RAS0104 dan RAS0107) atau tidak bersaing (RAS0109). DARPin ini digunakan sebagai alat untuk mengonfirmasi peran RAS dalam aktivasi kompensasi jalur PI3K/AKT pada sel BT474, yang menumbangkan penghambatan HER2 [ [ 35 ] ]. Dalam penelitian ini, kami menyajikan karakterisasi ekstensif DARPin (RAS0107, berganti nama menjadi 784_F5) yang mengikat erat semua isoform RAS, baik dalam keadaan aktif yang dimuat GTPγS maupun dalam keadaan tidak aktif yang dimuat GDP. Kami menyediakan karakterisasi biokimia dan fungsional DARPin ini, yang bertujuan untuk menghubungkan mekanisme penghambatan RAS dengan konsekuensinya pada proliferasi, pensinyalan hilir RAS, pertumbuhan yang tidak bergantung pada penjangkaran, dan pertumbuhan in vivo dari lini sel yang bergantung RAS.
2 Bahan dan Metode
2.1 Tampilan ribosom dan penyaringan DARPin
Pemilihan tampilan ribosom terhadap KRAS Q61H dilakukan pada dasarnya seperti yang dijelaskan sebelumnya, meskipun dalam format 96-well jika memungkinkan [ [ 36 ] ]. Target, yang mengandung residu 1–169, diekspresikan dengan Avi-tag C-terminal. Sel E. coli BL21 (DE3) ditransformasi bersama dengan plasmid ekspresi E. coli biotin ligase BirA untuk biotinilasi in vivo .
Pustaka sintetis penuh terdiri dari N3C-DARPins dengan tiga pengulangan internal acak, yang berisi campuran pengulangan capping N-terminal dan C-terminal acak dan tidak acak [ [ 32 , 37 ] ]. Seleksi dilakukan selama empat putaran dengan konsentrasi protein target terbiotinilasi yang menurun untuk tiga siklus pertama, seleksi off-rate menggunakan protein target non-biotinilasi pada siklus ketiga diikuti oleh putaran keempat dengan kondisi yang kurang ketat [ [ 36 , 38 ] ]. Kumpulan cDNA pengkode DARPin yang diperkaya terakhir dikloning sebagai fusi dengan MRGSHis 6 – N-terminal dan FLAG-tag C-terminal ke dalam turunan pQE30 (QIAGEN, Hilden, Jerman) yang mengandung gen lacI q melalui situs restriksi BamHI dan HindIII yang unik di bawah kendali promotor T5lac.
Setelah transformasi E. coli , 800 klon DARPin tunggal per seleksi diekspresikan dalam format 96-well dan dilisiskan dengan penambahan buffer lisis berbasis Tris/HCl pekat yang mengandung n-oktil β- d -thioglucopyranoside (OTG), lisozim, dan nuklease universal. ELISA ekstrak kasar dan sekuensing berikutnya untuk mengidentifikasi klon unik menghasilkan total 94 DARPin unik terhadap kedua klon (65 terhadap KRAS Q61H, 29 terhadap NRAS wt). Hit positif selanjutnya dianalisis untuk pengikatan oleh fluoresensi waktu-terselesaikan homogen (HTRF) melalui 6xHis dan tag FLAG mereka. Untuk tujuan ini, pengikatan DARPin berlabel FLAG ke protein target biotinilasi yang diimobilisasi streptavidin diukur menggunakan HTRF (donor: Streptavidin-Tb cryptate (610SATLB, Cisbio, Codolet, Prancis), akseptor: mAb anti-FLAG M2-d2 (61FG2DLB, Cisbio)). Eksperimen dilakukan pada suhu ruangan dalam pelat Optiplate 384-well putih (PerkinElmer, Waltham, MA, AS) menggunakan buffer uji Taglite (Cisbio) pada volume akhir 20 μL per well.
Klon tunggal diekspresikan dalam skala kecil dan dimurnikan menggunakan kolom IMAC 96-well (pelat HisPur™ Cobalt, Thermo Scientific, Waltham, MA, AS). DARPin setelah pemurnian IMAC dianalisis untuk kecenderungan oligomerisasi potensial pada konsentrasi 10 μ m pada kolom Superdex 200 increase 5/150 GL (GE Healthcare, Chicago, IL, AS) menggunakan sistem HPLC LC1200 (Agilent, Santa Clara, CA, AS) dengan PBS yang mengandung 400 m m NaCl sebagai buffer berjalan. Absorbansi pada 280 nm direkam.
2.2 Ekspresi protein
DARPin diekspresikan seperti yang dijelaskan sebelumnya [ [ 39 – 41 ] ]. Semua konstruksi ekspresi ditunjukkan pada Tabel S1 . Protein RAS terbiotinilasi yang membawa Avi-tag diekspresikan dalam E. coli AVB100 (Avidity). Ekspresi dilakukan selama 16 jam pada suhu 18 °C dalam Terrific Broth yang mengandung 2% (v/v) EtOH. Ekspresi KRAS diinduksi dengan 0,2 m m IPTG setelah kultur mencapai OD600 = 0,8. Semua langkah pemurnian protein dilakukan pada suhu 4 °C. Pelet bakteri disuspensikan kembali dalam buffer lisis (50 mm Tris /HCl pH 8,0, 10% (b/v) gliserol, 300 mm NaCl , 20 mm imidazol ; 10 mm MgCl2 , 0,1 mm GDP yang mengandung 25 ng·mL −1 DNAse, 1 mg·mL −1 lisozim, dan inhibitor protease Leupeptin, Petabloc SC, dan Pepstatin-A dan dilisis melalui sonikasi). Setelah klarifikasi, protein RAS dimurnikan menggunakan kromatografi afinitas ion logam terimobilisasi Ni-NTA (IMAC) dan didialisis ke 50 mm HEPES pH 7,4, 10% (b/v) gliserol, 1 mm DTT , 150 mm NaCl , 20 mm imidazol ; 10 m m MgCl 2 yang melibatkan pembelahan TEV jika diperlukan. Protease TEV dan protein yang tidak terurai dihilangkan dengan reverse IMAC dan dimurnikan lebih lanjut dengan kromatografi pengecualian ukuran untuk menghasilkan protein monomerik.
2.3 Pemuatan RAS dengan nukleotida
Untuk memuat varian Ras dengan nukleotida GTPγS, GMP-PNP, atau GDP, EDTA ditambahkan ke 10 m m , dan nukleotida ditambahkan ke konsentrasi akhir 2 m m . Campuran diinkubasi selama 15 menit pada suhu 30 °C, setelah itu MgCl2 ditambahkan ke 64 m m untuk menghentikan reaksi pertukaran. Pertukaran buffer ke buffer yang diinginkan untuk percobaan dilakukan menggunakan kolom Spin ZEBA MWCO 7 kDa (Thermo Scientific) dan dialisis semalam.
2.4 Resonansi plasmon permukaan
ProteOn XPR36 (Bio-Rad, Hercules, CA, AS) digunakan untuk semua percobaan resonansi plasmon permukaan (SPR). Varian RAS, yang dibiotinilasi melalui Avi-tag, diaktifkan dengan nukleotida yang diinginkan seperti dijelaskan di atas dan diimobilisasi pada chip sensor berlapis neutravidin (ProteOn NLC, Bio-Rad) pada kepadatan sekitar 2,5–5,0 ng·μL −1 dalam buffer berjalan (PBS, 0,005% Tween-20, 5 m m MgCl 2 , 10 μ m GTPɤS). DARPin dijalankan di atas chip dalam duplikat pada konsentrasi 3,16, 10, 31,6, dan 100 n m . Untuk analisis, model kecocokan terinduksi dua-keadaan digunakan dari perangkat lunak manajer proteon versi 3.1.0.6 (Bio-Rad). Dalam model ini, DARPin ( A ) dan Ras ( B ) membentuk kompleks awal AB , yang kemudian tersusun ulang menjadi kompleks akhir ( AB )* (E).
![]()
Konstanta kesetimbangan dari masing-masing langkah kemudian dijelaskan dengan persamaan ( 2 )
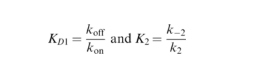
2.5 Kloning molekular
Untuk menghasilkan garis sel yang dapat diinduksi doksisiklin, DARPin 784_F5 dan DARPin kontrol E3_5 pertama kali disubklon, termasuk MRGS-6xHis N-terminal dan tag FLAG C-terminal dari tulang punggung pQIq ke dalam vektor shuttle pDONR221 (Invitrogen, Carlsbad, CA, AS) melalui kloning Gateway menggunakan primer berikut:
5′-GGGGACAAGTTTGTACAAAAAAGCAGGCTTCACCATGGGCATGAGAGGATCGCATCACCAT-3′
5′-GGGGACCACTTTGTACAAGAAAGCTGGGTTTTACTTGTCGTCGTCATCCTTGTAGTC-3′.
Vektor ekspresi yang dapat diinduksi doksisiklin kemudian dihasilkan dengan mengkloning sub DARPin ke dalam vektor Gateway pLenti CMV/TO Puro DEST.
Untuk memantau pengelompokan nano KRAS dalam uji BRET, fusi N-terminal KRAS ke mNeonGreen atau NanoLuc dibangun dalam vektor pcDNA3.1(+) (Invitrogen). Mutasi titik KRAS diperkenalkan baik oleh mutagenesis yang diarahkan situs (QuikChange, Agilent) atau dengan mengganti cDNA KRAS dengan untaian DNA sintetis (GeneArt, Regensburg, Jerman) yang membawa mutasi yang diinginkan. Demikian pula, DARPin dikloning sebagai fusi N-terminal ke mNeonGreen untuk menilai keterlibatan target dalam sel melalui BRET. Semua sekuens dikonfirmasi oleh sekuensing Sanger. DARPin atau monobodi NS1 [ [ 28 ] ] yang digunakan sebagai inhibitor dalam uji pengelompokan nano KRAS dikloning ke dalam vektor pcDNA3.1(+) juga.
Plasmid pLenti CMV/TO Puro DEST (670-1) merupakan hadiah dari Eric Campeau dan Paul Kaufman (plasmid Addgene # 17293, Watertown, MA, AS) [ [ 42 ] ].
2.6 Kristalisasi
Untuk menghasilkan kompleks, KRAS(1–186) yang dimuat GMP-PNP dan DARPin 784_F5 dicampur dalam jumlah yang sama dan diinkubasi selama 1 jam pada suhu 4 °C. Campuran tersebut kemudian diaplikasikan pada kromatografi pengecualian ukuran preparatif untuk mengisolasi kompleks. Protein yang dikomplekskan kemudian dipekatkan hingga 8,8 mg·mL −1 dan disiapkan untuk kristalisasi dalam eksperimen difusi uap tetes-duduk pada pelat 96-sumur. Tiga rasio yang berbeda dari larutan reservoir : protein (1 : 1, 2 : 1, dan 3 : 1) dalam tetes 300 nL digunakan per sumur dan diinkubasi terhadap larutan reservoir 75 μL pada suhu 4 °C. Kristal tumbuh dalam waktu 25 hari dalam 0,2 m kalium natrium tartrat, 20% b/v PEG 3350.
Kristal dipasang dalam cryo-loop dari Hampton Research dan didinginkan dengan cepat dalam nitrogen cair dengan etilen glikol sebagai krioprotektan lebih lanjut. Data difraksi sinar-X dikumpulkan pada panjang gelombang 1,0 Å pada garis sinar X06SA di Swiss Light Source, Paul Scherrer Institute (PSI), Villigen, Swiss, dilengkapi dengan detektor EIGER 16M (Dectris, Baden-Wattwil, Swiss). Data diproses dengan xds , xscale , dan xdsconv [ [ 43 ] ]. Struktur dipecahkan dengan penggantian molekuler dengan phaser [ [ 44 ] ] menggunakan struktur 4YDW dan 5F2E sebagai model referensi. Perhitungan kerapatan elektron dan penyempurnaan dilakukan menggunakan phenix.refine [ [ 45 ] ]. Untuk membangun model dan menyiapkan gambar, kami menggunakan phenix.autobuild , phenix.refine , coot , dan pymol [ [ 46 – 48 ] ]. Interaksi protein:protein dianalisis dengan bantuan perangkat lunak pdbepisa dan ligplot [ [ 49 , 50 ] ].
2.7 Ko-imunopresipitasi
Sel HEK293T ditransfeksi dengan HRAS, NRAS, atau KRAS4B berlabel HA dalam tulang punggung pcDNA3.1 menggunakan TransIT®-LT1 (Mirus, Madison, WI, AS). Sel dicuci dan dilisiskan setelah 60 jam dalam buffer IP (50 mm Tris /HCl pH 7,4, 150 mm NaCl , 1% NP-40, 5% gliserol, 10 mm MgCl 2 , 50 unit·mL −1 Benzonase). Konsentrasi protein total ditentukan melalui uji protein BCA dan dinormalisasi untuk masukan protein 500 μg. DARPin diimobilisasi pada manik anti-FLAG magnetik (Pierce, Rockford, IL, AS) dan digunakan untuk melakukan ko-imunopresipitasi RAS dari lisat sel. Kompleks DARPin-RAS dielusi dengan peptida DYKDDDDK 3x (Pierce) dan divisualisasikan melalui western blotting, pewarnaan tag HA dan FLAG yang representatif.
2.8 Kultur sel
Semua lini sel dijaga pada suhu 37 °C dengan 5% CO2 dan diuji secara berkala untuk mikoplasma. Sel-sel ditumbuhkan dalam DMEM yang dilengkapi dengan 10% serum janin sapi (FCS) dan 1% penisilin/streptomisin. Semua lini sel telah diautentikasi dalam 3 tahun terakhir melalui profil polimorfisme nukleotida tunggal (SNP).
2.9 Uji BRET
Sel HEK293T disemai dalam pelat dasar bening 96-sumur putih (Corning) 24 jam sebelum transfeksi. Ko-transfeksi plasmid reporter dilakukan dengan TransIT-293 (Mirus) menggunakan protokol yang disarankan pabrik. 24 jam pasca-transfeksi, medium ditukar dengan DMEM tanpa fenol merah (Life Technologies, Carlsbad, CA, AS) yang mengandung 4% FCS. 48 jam pasca-transfeksi, pengukuran BRET dilakukan pada Victor 3 Multilabel Plate Reader setelah penambahan 10 μL 32 μ m coelenterazine 400a (Cayman Chemical, Ann Arbor, MI, AS), yang menghasilkan konsentrasi akhir 2,9 μ m . Emisi mNeonGreen dan NanoLuc diamati selama 2 detik pada 535 ± 25 dan 460 ± 25 nm, masing-masing. Ekspresi kedua reporter dipantau dengan mengukur mNeonGreen (Ex 485 nm, Em 535 nm) sebelum penambahan substrat luciferase dan mengukur total luminesensi langsung setelah pengukuran BRET selama 0,3 detik.
Rasio BRET dihitung berdasarkan rumus berikut untuk setiap sumur yang ditransfeksi:

2.10 Generasi garis sel yang dapat diinduksi
Sel-sel ditransduksi secara berurutan dengan plasmid lentivirus yang membawa protein penekan tetrasiklin TetR (pLenti TetR Blast) dan yang membawa DARPins E3_5 atau 784_F5 (pLenti CMV/TO Puro DEST). Partikel lentivirus diproduksi melalui ko-transfeksi sel HEK293T dengan vektor ekspresi pLenti, plasmid pengemasan psPAX2, dan plasmid amplop pMD2.G menggunakan TransIT®-LT1, dan virus dipanen setelah 48 dan 72 jam. Sel-sel diinkubasi dengan supernatan lentivirus dengan adanya 8 μg·mL −1 polybrene selama 30 jam, dan sel yang terinfeksi dipilih dengan 5 μg·mL −1 blasticidin (TetR) selama 14 hari atau 3 μg·mL −1 puromycin selama 5 hari.
Plasmid pMD2.G dan psPAX2 merupakan hadiah dari Didier Trono (plasmid Addgene #12259 dan #12260). Plasmid pLenti TetR Blast (716-1) merupakan hadiah dari Eric Campeau dan Paul Kaufman (plasmid Addgene #17492) [ [ 42 ] ].
2.11 Proliferasi dan pembentukan koloni
Garis sel ditanam dalam pelat 96 sumur untuk pengujian proliferasi (1000–4000 sel per sumur) atau dalam pelat 6 sumur untuk pengujian pembentukan koloni dengan atau tanpa 1 μg·mL −1 doksisiklin untuk menginduksi ekspresi DARPin.
Proliferasi dipantau selama empat hari berturut-turut melalui CellTiter 96 AQueous One Solution Cell Proliferation Assay (Promega, Madison, WI, AS) dan nilainya dinormalisasi ke hari pertama (HEK293T) atau diukur setelah 72 jam dengan CellTiter-Blue (Promega).
Untuk uji pembentukan koloni, 1000 sel disemai sebagai sel tunggal dalam 3 mL medium lengkap dan dibiarkan membentuk koloni selama 10 hari, sambil mengganti media setiap 72 jam. Sel kemudian dicuci dengan PBS, difiksasi selama 10 menit dengan metanol dingin, dan selanjutnya diwarnai dengan larutan kristal violet 2,5% (b/v) (Sigma-Aldrich, Burlingtin, MA, AS) selama 20 menit. Setelah menghilangkan pewarna berlebih, pelat dicuci bersih dengan air dan dikeringkan semalaman. Pelat yang diwarnai kristal violet dicitrakan, dan area yang tertutup dianalisis dengan plugin ImageJ ColonyArea [ [ 51 ] ].
2.12 Pertumbuhan yang tidak bergantung pada pelabuhan
Pengujian agar lunak dilakukan pada pelat 12-sumur. 10.000 sel disemai dalam RPMI 1640 yang mengandung 10% FCS dan 0,35% agar mulia dengan atau tanpa 1 μg·mL −1 doksisiklin dan ditanam di atas lapisan RPMI 1640 yang mengandung 10% FCS dan 0,5% agar mulia. 200 μL media diaplikasikan pada hari ke-3 setelah penyemaian dan diganti setiap 72 jam. Setelah 10 hari, koloni diwarnai dengan 0,5% (b/v) kristal violet dan difoto dengan Zeiss Cell Observer. Gambar diproses menggunakan perangkat lunak zeiss axiovision .
2.13 Western blotting
Sel-sel dilisiskan dalam buffer RIPA yang mengandung 1x koktail penghambat protease Halt (Pierce) dan 1x koktail penghambat fosfatase Halt (Pierce). Semua antibodi primer diperoleh dari Cell Signaling Technology (Danvers, MA, AS) kecuali dinyatakan lain: fosfo-AKT S473 (#9271S), total AKT (#2967), fosfo-MEK1/2 (#9154S), total MEK1/2 (#4694S), fosfo-ERK1/2 (#4370), total ERK (#9102), fosfo-p90RSK S380 (11989S), tag Anti-FLAG (#2368). Sebanyak 50 μg protein total dipisahkan dengan SDS/PAGE, dipindahkan ke membran nitroselulosa, dan diblokir dalam buffer pemblokiran Odyssey. Imunodeteksi dilakukan dengan antibodi primer yang ditunjukkan, diikuti oleh antibodi kambing, anti-kelinci, dan anti-tikus sekunder yang diberi label CF680 atau CF790 (Biotium, Fremont, CA, AS), dan pencitraan dilakukan menggunakan instrumen Odyssey CLx (LI-COR Biosciences, Lincoln, NE, AS).
2.14 Pelabelan Alexa647-GDP, Alexa647-GTP, dan Eu(III)-GTP
Konjugasi non-dentat Eu(III)-kelat ke GDP dilakukan seperti yang dijelaskan sebelumnya dengan GTP [ [ 52 , 53 ] ]. Konjugasi dengan ester Alexa Fluor 647 NHS dilakukan dengan cara yang sama dalam buffer karbonat 50 mm pH 8,3 [ [ 54 ] ] . Secara singkat, label dikonjugasikan ke 2′/3′-(6-aminohexylcarbamoyl)-GTP (2′/3′-AHC-GTP) atau 2′/3′-AHC-GDP (BIOLOG Life Science Institute, Bremen, Jerman) dalam buffer karbonat 50 mm , pH 9,8, menggunakan rasio molar nukleotida/label 1 : 3 dalam total volume reaksi 150 μL. Reaksi konjugasi dilindungi dari cahaya dan diinkubasi selama 18 jam pada suhu ruangan dengan pengocokan lambat. {2,2′,2″,2‴-{[4′-(4‴-isothiocyanatophenyl)-2,2′,6′,2″-terpyridine-6,6″-diyl]bis(methylenenitrilo)}tetrakis(acetate)}europium(III) (Nonadentate Eu(III)-chelate) dibeli dari QRET Technologies (Turku, Finlandia). Alexa Fluor 680 NHS (A37567) dan Alexa Fluor 647 NHS (A37573) dibeli dari Thermo Fisher Scientific.
2.15 Pelabelan Raf-RBD-Alexa680 dan Eu(III)-streptavidin (SA)
Ester Alexa Fluor 680 NHS digunakan dalam konjugasi domain pengikatan RAS Raf (Raf-RBD) untuk menyiapkan Raf-RBD-Alexa680 seperti yang dijelaskan sebelumnya [ [ 53 ] ]. Raf-RBD (0,1 mg) diberi label dengan kelebihan molar dua kali lipat Alexa680 dalam 175 μL dalam buffer karbonat 50 mm pH 8,3 selama 30 menit sambil terlindungi dari cahaya. Konjugat Alexa680-RBD dipisahkan dari label Alexa680 bebas menggunakan kolom NAP-5 (GE Healthcare) dalam HEPES 50 mm ( pH 7) sesuai dengan petunjuk pabrik. Derajat pelabelan untuk Alexa680-RBD ditentukan berdasarkan absorbansi yang dipantau pada 280 dan 680 nm. Demikian pula, konjugasi streptavidin (SA) 0,5 mg (BioSpa, Milano, Italia) dengan heptadentat ITC-TEKES-Eu(III)-kelat (QRET Technologies), disebut Eu(III)-SA, dilakukan dengan kelebihan molar Eu(III)-kelat sebanyak 10 kali lipat dalam reaksi 3 jam (RT) dalam 300 μL. Produk terkonjugasi juga dimurnikan dengan kolom NAP-5. Konsentrasi Eu-GTP ditentukan berdasarkan konsentrasi ion Eu(III) dengan membandingkan sinyal luminesensi yang diamati dengan standar Eu(III) komersial. Standar EuCl3 dan larutan peningkatan DELFIA (DES) dibeli dari PerkinElmer Life and Analytical Sciences [ [ 52 ] ].
2.16 Uji asosiasi nukleotida dengan K-Ras
Dalam uji pertukaran nukleotida transfer energi resonansi pendinginan (QRET) [ [ 53 , 55 ] ], kinetika asosiasi dan disosiasi Eu(III)-GDP dilakukan dalam buffer uji 1 (20 mm HEPES , pH 7,5, 1 mm MgCl 2 , 10 mm NaCl , 0,01% Triton-X 100, 0,005% γ-globulin). Eu(III) tereksitasi pada 340 nm, dan sinyal yang dihasilkan diukur dengan penundaan 800 μs pada 615 nm selama 400 μs. KRAS (400 nm ) pertama kali ditambahkan dalam 8 μL dan dicampur dengan buffer atau 2 μL DARPin 784_F5 atau DARPin E3_5 (2 μm ) . Eu(III)-GDP (50 nm ) , yang telah dicampur sebelumnya dengan 55 μm Malachite Green (Sigma-Aldrich) kemudian ditambahkan dalam 8 μL dan sinyalnya dipantau setelah 5 menit inkubasi. Kinetika asosiasi Eu(III)-GDP diikuti selama 800 detik setelah penambahan domain katalitik SOS1 (SOS cat , 564–1048) (5 nm ) dalam 2 μL. Asosiasi Eu(III)-GDP dihentikan dengan menambahkan 2 μL GDP (10 μm ) di setiap sumur. Kinetika disosiasi Eu(III)-GDP dipantau selama 800 detik setelah penambahan GDP. Semua reaksi dilakukan dalam rangkap tiga, dan reaksi tanpa SOS cat atau DARPin digunakan sebagai kontrol.
Untuk menentukan IC50 , pengujian dilakukan dalam format titik akhir. Untuk tujuan ini, pengujian dilakukan dalam buffer pengujian 2 (20 mm HEPES , pH 7,5, 1 mm MgCl2 , 10 mm NaCl , 0,01% NP40) dengan Alexa647-GDP 10 nm atau Alexa647-GTP, masing-masing. KRAS(1–188) (10 nm ) dan 0–4 μm dari setiap DARPin (784_F5 dan E3_5) pertama-tama diinkubasi selama 10 menit sebelum menambahkan Eu(III)-GDP atau Eu(III)-GTP (5 nm ) dalam kompleks dengan MT2 (2,5 μm , QRET Technologies). Setelah 5 menit, sinyal awal dipantau dan SOS cat (5 nm ) ditambahkan. Pemblokiran asosiasi dipantau setelah 15 menit pada 620 nm. Data mewakili mean ± SD ( n = 3).
2.17 Pemantauan interaksi K-Ras dengan Raf-RBD
Kemampuan DARPin untuk memblokir interaksi KRAS dengan RAF-RBD dipantau menggunakan pembacaan TR-FRET. Titrasi DARPin 784_F5 atau E3_5 (kontrol negatif) dilakukan dalam buffer pengujian 1 menggunakan protokol titik akhir. Untuk tujuan ini, asosiasi Alexa647-GTP (10 nm ) ke KRAS (50 nm ) dimulai dengan SOS cat (5 nm ) selama 10 menit. Setelah itu, 0–3 μm 784_F5 atau kontrol E3_5 DARPin ditambahkan, dan reaksi diinkubasi selama 10 menit. RAF1-RBD-biotin (10 nm ) dan Eu(III)-SA (2 nm ) kemudian ditambahkan, dan sinyal TR-FRET dipantau setelah 15 menit pada 665 nm.
Penentuan kinetik kemampuan DARPin untuk memblokir interaksi KRAS dengan RAF1-RBD juga dipantau menggunakan pembacaan TR-FRET. Avi-KRAS(1–188) (25 nm ) , GTP (2 μm ) , dan Eu(III)-SA (5 nm ) pertama-tama diinkubasi selama 15 menit dengan SOS cat (5 nm ) untuk memungkinkan pembentukan GTP-Ras. Setelah itu, Alexa680-RAF1-RBD (25 nm ) ditambahkan dan kinetika interaksi KRAS dengan RAF1-RBD-Alexa680 dipantau pada 730 nm selama 330 detik sebelum penambahan DARPin (2 μm ) dan pemantauan disosiasi RAF1-RBD—Alexa680 selama 480 detik. Dalam kedua pengujian, semua komponen pengujian individual ditambahkan dalam volume 2 μL dan volume akhir adalah 10 μL. Semua reaksi dilakukan dalam rangkap tiga, dan reaksi tanpa DARPin dan tanpa SOS cat digunakan sebagai kontrol.
2.18 Studi Xenograft
2,5 × 106 sel HCT116, yang mengekspresikan DARPins 784_F5 atau E3_5 secara induksi dalam 20% matrigel, ditanamkan secara subkutan di sisi kanan tikus NSG berusia 6–8 minggu (NOD.Cg- Prkdc scid Il2rg tm1Wjl /SzJ). Tikus didistribusikan untuk membuat kelompok kontrol dan kelompok perlakuan yang homogen. Dalam studi 1, kelompok yang tidak diinduksi (−Dox) mencakup lima hewan, sedangkan kelompok yang diinduksi (+Dox) mencakup tujuh hewan, yang dua di antaranya dikorbankan pada hari ke-10 perlakuan untuk histologi. Studi 2 hanya mencakup lima hewan yang mengekspresikan DARPins 784_F5. Perawatan dengan doksisiklin (0,5 mg/mL + sukrosa 5% dalam air minum) dan kontrol (sukrosa 5%) dimulai ketika volume tumor mencapai ≥ 125 mm3 . Volume tumor dipantau dengan mengukur panjang tumor ( L ) dan lebar ( W ) menggunakan jangka sorong. Volume tumor ( V ) dihitung menggunakan rumus standar: V = W × W × L /2, di mana L merupakan dimensi terpanjang dan W merupakan dimensi pendek tegak lurus. Semua pengukuran dilakukan secara buta oleh peneliti terlatih yang sama untuk meminimalkan variabilitas. Pengukuran dilakukan setiap 3–4 hari, dimulai 1 minggu pasca-inokulasi dan dua kali seminggu selama perawatan. Tumor yang melampaui batas etika atau menunjukkan tanda-tanda ulserasi memicu kriteria titik akhir manusiawi, sesuai dengan pedoman perawatan hewan institusional. Semua prosedur percobaan hewan dilakukan menurut Federasi Asosiasi Ilmu Hewan Laboratorium Eropa (FELASA). Protokol studi hewan disetujui oleh Dewan Peninjauan Institusional (Comité d’éthique CEEA 50) Universitas Bordeaux (kode protokol APAFIS10089-2017052408559377, tanggal persetujuan 31/05/2018).
2.19 Histologi
Sampel tumor yang diambil dari implan tikus difiksasi dalam formalin buffer 10% (Sigma), dibenamkan dalam parafin, dan dievaluasi dengan pewarnaan hematoksilin & eosin (H&E) konvensional. Antibodi yang digunakan untuk imunopewarnaan termasuk antibodi yang dikembangkan untuk melawan Histone 3 terfosforilasi (06-570, Millipore, Burlington, MA, AS).
3 Hasil
3.1 Pengembangan dan penyaringan DARPin pengikat RAS
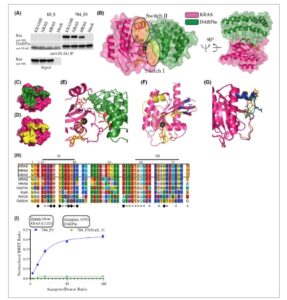
Bahasa Indonesia: Untuk mengembangkan Designed Ankyrin Repeat Proteins (DARPins) yang mengikat RAS, tampilan ribosom dilakukan dalam format 96-well high-throughput dengan mutan KRAS Q61H (1–169) yang dibiotinilasi melalui Avi-tag C-terminal. Mutan tersebut menunjukkan kemampuan yang sangat terganggu untuk menghidrolisis GTP [ [ 56 ] ]. Setelah empat putaran seleksi dari pustaka DARPin, E. coli ditransformasi dengan kumpulan DARPin yang dipilih dan klon individu dipilih. Ekstrak kasar E. coli yang mengandung DARPin yang diekspresikan disiapkan menggunakan klon ini. Pengikatan DARPin ke RAS yang diimobilisasi melalui Avi-tag dikonfirmasi oleh ELISA dan kemudian dikuatkan melalui fluoresensi waktu-terselesaikan homogen (HTRF) untuk sebagian klon. Kami kemudian mengevaluasi sekumpulan DARPin pengikat RAS untuk mengetahui kemampuannya dalam memblokir interaksi RAS–RAF dan menemukan kemampuan yang sangat bervariasi untuk melakukannya dalam IP berbasis RAF1-RBD (Gbr. S1 ). Di sini kami mengidentifikasi DARPin 784_F5, yang sebelumnya dilaporkan sebagai RAS0107 tanpa karakterisasi mendalam [ [ 35 ] ], sebagai kandidat yang paling menjanjikan yang diselidiki secara rinci dalam penelitian ini.
3.2 Pengenalan semua isoform RAS melalui wilayah switch I/II secara independen dari ikatan nukleotida
Bahasa Indonesia: Untuk mengkarakterisasi profil interaksi DARPin 784_F5 dengan isoform RAS individual dalam keadaan aktif dan nonaktif, kami menentukan afinitasnya untuk NRAS, KRAS, dan mutan KRAS G12V menggunakan resonansi plasmon permukaan (SPR). Afinitas diukur terhadap bentuk tidak aktif yang dimuat GDP dan bentuk aktif yang dimuat GTPγS. DARPin mengenali semua protein RAS yang diuji terlepas dari ikatan nukleotida. Dengan menggunakan model dua langkah, semua kurva SPR dapat dipasang dengan baik (Gbr. S2 ) dan menunjukkan nilai K D keseluruhan yang sangat mirip mulai dari 6,7 hingga 23,8 nM (Tabel 1 ). Selain pengukuran afinitas, kami melakukan imunopresipitasi isoform RAS berlabel HA dari lisat sel yang disiapkan dari sel HEK293T yang ditransfeksi. Pengikat RAS 784_F5 secara jelas mengenali semua isoform sebagai protein berukuran penuh juga ketika diproduksi dan diproses dalam sel mamalia (Gbr. 1A ), sedangkan hal ini tidak berlaku untuk DARPin E3_5 yang tidak mengikat, yang digunakan sebagai kontrol.
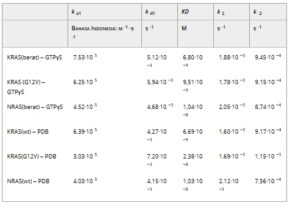
Tabel 1. Penentuan afinitas DARPin 784_F5. K D pada KRAS(wt), KRAS(G12V) dan NRAS(wt) yang diukur dengan resonansi plasmon permukaan (SPR) dan dipasang dengan model dua-keadaan (lihat Bagian 2). Sensorgram individual ditampilkan dalam Gambar S2 .
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Mode pengikatan pan-RAS DARPin 784_F5. (A) Ko-imunopresipitasi (Co-IP) dari tiga isoform RAS oleh DARPin 784_F5. Isoform berlabel HA diekspresikan dalam sel HEK293T dan mengalami Co-IP oleh DARPin berlabel FLAG yang diimobilisasi pada manik anti-FLAG ( n = 1). (B) Struktur kristal DARPin 784_F5 (hijau) dalam kompleks dengan KRAS (merah muda), mengkristal dengan adanya GMP-PNP. Dua tampilan kompleks ditunjukkan, diputar 90° pada sumbu vertikal dan horizontal, dengan daerah sakelar 1 dan sakelar 2 diberi anotasi. (C) Representasi permukaan KRAS (merah muda) yang menunjukkan area yang tercakup saat terikat pada DARPin 784_F5 (hijau). (D) Representasi permukaan KRAS (merah muda) yang menunjukkan daerah sakelar I/II (kuning). (E) Antarmuka pengikatan DARPin 784_F5 (hijau) dan KRAS (merah muda). Residu yang memediasi interaksi langsung ditampilkan sebagai batang. Residu utama, W36, K46, dan R112, yang bermutasi menjadi alanin dalam 784_F5(Null_3) diwarnai merah. (F) Residu pada KRAS terlibat dalam interaksi langsung dan yang dimediasi air dengan DARPin 784_F5. Residu yang terletak di daerah sakelar diwarnai kuning sedangkan yang di luar diwarnai biru. (G) Hamparan tiga molekul KRAS dalam sel satuan. Daerah sakelar I/II diwarnai berdasarkan rantai, dan residu 61–64 ditampilkan sebagai batang. (H) Penjajaran sekuens daerah sakelar I/II GTPase kecil representatif dibandingkan dengan KRAS. Interaksi DARPin RAS langsung dan yang dimediasi air ditunjukkan dengan lingkaran terisi di bawah penjajaran. Residu antarmuka tambahan sebagaimana didefinisikan oleh PDBePISA ditunjukkan dengan tanda bintang. (I) Uji BRET menunjukkan keterlibatan target dalam sel KRAS(G12D) oleh DARPin 784_F5 ( n = 3, garis kesalahan menunjukkan SD). Interaksi RAS DARPin tidak ada untuk 784_F5(Null_3) yang membawa mutasi W36A, K46A, dan R112A. Kontrol yang menunjukkan tingkat ekspresi yang sebanding tersedia dalam Gambar S4 .
Kami selanjutnya mengkristalkan DARPin 784_F5 dalam kompleks dengan KRAS yang terikat pada analog GTP GMP-PNP untuk merasionalisasi profil interaksi yang kami amati (Tabel S2 ). DARPin menutupi seluruh wilayah switch I dan menempati area besar di wilayah switch II, memediasi kontak langsung dengan kedua wilayah, dengan demikian menempati situs pengikatan berbagai efektor hilir RAS (Gbr. 1B–E ). Menariknya, wilayah switch I/switch II tidak terlalu menyerupai konformasi yang diketahui dari struktur KRAS yang tidak aktif (terikat GDP) atau aktif (terikat GTP) tetapi dalam kedua kasus mengadopsi konformasi intermediet [ [ 57 , 58 ] ]. Sementara heliks α2 ditemukan dalam konformasi terbuka yang mirip dengan keadaan GDP, loop switch II lebih selaras dengan inti protein seperti yang diamati dalam struktur lain [ [ 59 ] ]. Sebaliknya, wilayah sakelar I lebih meluas dari inti domain-G dibandingkan yang diharapkan dari struktur KRAS efektor atau tak terikat yang dilaporkan, namun tidak selaras dengan konformasi sakelar I yang terbuka sepenuhnya yang diamati dalam kompleks dengan RAS GEF SOS1 [ [ 59 – 61 ] ].
Yang penting, struktur ini memungkinkan kita untuk merasionalisasi bagaimana DARPin 784_F5 mampu mengikat RAS dalam kedua keadaan nukleotida, meskipun epitopnya—daerah sakelar—mengadopsi konformasi yang berbeda ketika GDP atau GTP terikat. Pertama, tiga interaksi langsungnya dengan KRAS terletak pada lembaran β yang kaku secara konformasi (β1-3), yang menyediakan daerah kontak yang konstan (Gbr. 1F ). Selain itu, DARPin 784_F5 menunjukkan toleransi yang tinggi terhadap konformasi loop sakelar II. Di dalam kristal, satu sel satuan tersusun dari tiga pasangan DARPin KRAS yang, ketika ditumpangkan, menunjukkan variabilitas yang mengejutkan dalam residu 61–64 dari sakelar II KRAS (Gbr. 1G ). Menganalisis interaksi langsung dan yang dimediasi air antara kedua molekul tersebut mengungkapkan interaksi yang bervariasi sebagian, tergantung pada konformasi loop sakelar II. Misalnya, K134 dari DARPin 784_F5 dapat berinteraksi dengan E62 atau E63 (Gbr. S3 ). Pengamatan ini selaras dengan model dua langkah yang digunakan untuk menyesuaikan data pengikatan kinetik. Model tersebut mengasumsikan pertemuan awal afinitas rendah yang diikuti oleh transisi konformasi ke kompleks afinitas tinggi. Di sini, pertemuan awal kemungkinan melibatkan interaksi dengan lembaran β1-3 dan wilayah sakelar I, sementara interaksi stabil dengan loop sakelar II yang sangat fleksibel terbentuk pada langkah berikutnya.
Selain toleransi konformasionalnya berkenaan dengan keadaan nukleotida RAS, struktur tersebut menunjukkan spesifisitas bersama untuk tiga isoform RAS, KRAS, NRAS, dan HRAS. Sebaliknya, penyelarasan protein representatif dari RAS dan keluarga GTPase kecil lainnya menunjukkan residu yang berbeda dalam setidaknya satu interaksi langsung (ikatan hidrogen atau jembatan garam) dan dua atau lebih interaksi lebih lanjut dibandingkan dengan KRAS (Gbr. 1H ).
Untuk memvalidasi spesifisitas interaksi DARPin dengan KRAS dan kemampuannya untuk melibatkan targetnya dalam sel mamalia, kami menguji interaksi tersebut dalam uji BRET. Sementara DARPin 784_F5 dengan mudah melibatkan KRAS (G12D) dalam sel HEK293T, mutasi tiga residu yang terlibat dalam interaksi langsung (W36A, K46A, dan R112A) menghapuskan interaksi tersebut (Gbr. 1I ).
3.3 Pengikatan DARPin mempengaruhi pertukaran nukleotida yang dimediasi SOS dan keterlibatan efektor RAS
Karena DARPin 784_F5 mengikat lobus efektor KRAS dengan afinitas tinggi di kedua keadaan nukleotida, kami berhipotesis bahwa itu akan melindungi KRAS dari berinteraksi dengan efektor pertukaran nukleotida SOS serta efektornya seperti RAF. Kedua interaksi tersebut penting untuk (re)aktivasi RAS dan transduksi sinyal ke jalur MAPK dan PI3K/AKT/mTOR. Untuk memvalidasi asumsi kami, pertama-tama kami menyelidiki kemampuan anti-RAS DARPin 784_F5 untuk mengganggu interaksi KRAS dengan domain pengikatan RAS (RBD) RAF1 setelah pemuatan GTP KRAS oleh SOS dalam uji time-resolved (TR)-FRET (Gbr. 2A ) [ [ 53 ] ]. Yang penting, DARPin 784_F5 tidak hanya memblokir asosiasi RAF1-RBD tetapi juga berkompetisi dengannya dalam kompleks pra-rakitan dengan KRAS sementara kontrol non-pengikatan DARPin E3_5 tidak melakukannya (Gbr. 2B ). Kami mengamati IC50 sebesar 38,44 nm untuk menghambat interaksi KRAS-RAF1 (Gbr. 2C ). Karena RAF1 dianggap sebagai efektor dengan afinitas tertinggi untuk KRAS, kemungkinan DARPin 784_F5 berkompetisi dengan efektor lain, seperti PI3K, dengan cara yang sama [ [ 62 ] ].
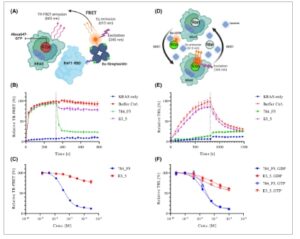
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Aktivitas DARPin 784_F5 pada interaksi RAS–RAF dan pertukaran nukleotida yang dimediasi SOS. (A) Representasi skematis dari uji RAS–RAF berbasis TR-FRET. Interaksi diukur sebagai sinyal FRET yang dihasilkan dari KRAS yang dimuati Alexa680-GTP sebagai akseptor, yang diikat oleh RAF1-RBD yang terbiotinilasi dengan adanya donor Streptavidin berlabel Eu(III). (B) Interaksi RAS–RAF dimulai oleh aktivasi KRAS4B yang dimediasi SOS. Seperti yang ditunjukkan dalam (A), setelah sinyal stabil terbentuk, kompetitor ditambahkan dan sinyal tersebut diikuti dari waktu ke waktu. Penambahan kompetitor, atau jumlah buffer yang sama ditunjukkan oleh garis putus-putus vertikal. (C) Kurva penghambatan dosis anti-RAS DARPin 784_F5 dan kontrol non-pengikatan DARPin E3_5 dalam uji interaksi RAS–RAF. (D) Representasi skematis dari uji QRET, yang memungkinkan pengamatan pertukaran nukleotida yang dimediasi SOS. Sinyal dihasilkan dari pemuatan KRAS yang dimediasi SOS dengan GDP atau GTP berlabel Eu(III). Sinyal Eu dipadamkan saat dalam larutan oleh pemadam yang dapat larut. (E) Semua komponen dicampur sebelum pemuatan nukleotida dimulai dengan penambahan SOS dan diamati dari waktu ke waktu. GDP yang tidak berlabel ditambahkan secara berlebihan setelah 800 detik dan memungkinkan pemantauan pertukaran balik nukleotida yang berlabel. Sinyal diukur sebagai pendaran waktu yang diselesaikan (TRL). (F) Kurva penghambatan dosis anti-RAS DARPin 784_F5 dan kontrol non-pengikatan DARPin E3_5 dalam uji pertukaran nukleotida. Data mewakili tiga replikasi teknis; batang galat menunjukkan SD.
Kami juga menyelidiki pertukaran nukleotida yang dimediasi SOS dalam uji transfer energi resonansi pendinginan (QRET) (Gbr. 2D ) [ [ 52 ] ]. DARPin 784_F5 secara ampuh menghambat pertukaran nukleotida KRAS terikat GDP dengan GDP dan GTP berlabel Eu dengan nilai IC 50 masing-masing sebesar 18,78 dan 34,32 nm ( Gbr. 2E,F ). Dalam kedua kasus, nilai IC 50 yang diamati cukup mencerminkan potensi yang diharapkan dari K D yang diukur . Kemampuan untuk memblokir pertukaran nukleotida yang dimediasi SOS dan interaksi dengan RAF1-RBD menggarisbawahi keterlibatan RAS baik dalam keadaan tidak aktif yang dimuat GDP maupun keadaan aktif yang dimuat GTP.
3.4 Pengikatan DARPin memengaruhi multimerisasi KRAS dan mendukung model dimer KRAS asimetris
Dalam jalur MAPK, beberapa protein RAS berkumpul di membran sel dengan protein efektor RAS dari famili RAF untuk memungkinkan transduksi sinyal hilir [ [ 63 – 66 ] ]. Meskipun semakin banyak bukti untuk asosiasi diri RAS yang ditentukan secara struktural, antarmuka interaksi yang tepat dan ukuran multimer tersebut masih menjadi bahan penyelidikan dan diskusi yang sedang berlangsung [ [ 67 – 69 ] ]. Untuk menguji dampak pengikat RAS pada pengelompokan nano KRAS, kami mempertimbangkan dua model yang hanya dilaporkan untuk keadaan terikat GTP dari KRAS sebagai relevan secara khusus: dimer α4/α5 simetris serta model dimer asimetris yang dimediasi GTP (GMA) yang melibatkan wilayah sakelar I selain heliks α4/α5 [ [ 28 , 70 , 71 ] ]. Kami berhipotesis bahwa memblokir salah satu epitop yang terlibat pada satu waktu, heliks α4/α5 atau daerah switch I, akan memungkinkan untuk menyelidiki relevansi epitop individu dalam pembentukan nanocluster RAS. Untuk melakukan ini, kami menggunakan monobody NS1 yang dilaporkan sebelumnya [ [ 28 ] ] yang mengenali daerah α4-β6-α5 dari lobus alosterik dan DARPin 784_F5 yang dilaporkan di sini, yang mengenali lobus efektor switch I/II (Gbr. 3A ). Penyelarasan kompleks DARPin 784_F5- atau monobody NS1-terikat RAS dengan kedua model dimer KRAS dengan jelas menunjukkan bahwa monobody NS1 akan mengganggu kedua model, sedangkan DARPin 784_F5 hanya akan dapat mengganggu model dimer GMA asimetris (Gbr. 3B,C ).
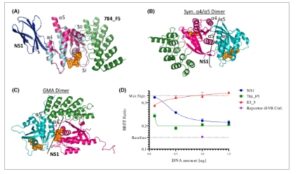
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Efek pengikat RAS pada pengelompokan nano KRAS. (A) Hamparan DARPin 784_F5 (hijau) yang terikat KRAS (merah muda) dan monobodi NS1 (biru) yang terikat HRAS (sian) (PDB: 5E95 ). Dapat dilihat bahwa mereka mengikat sisi berlawanan dari KRAS. (B) Hamparan DARPin 784_F5 (hijau) yang terikat pada KRAS (merah muda) dan model dimer α4-α5 yang simetris. Situs pengikatan monobodi NS1 ditunjukkan dengan garis putus-putus. (C) Interferensi sterik DARPin 784_F5 dengan antarmuka dimer asimetris. Situs pengikatan monobodi NS1 ditunjukkan dengan garis putus-putus. (D) Pengelompokan nano KRAS diukur dengan BRET 2 ( n = 3, garis galat menunjukkan SD). KRAS difusikan secara N-terminal ke nanoLuciferase (Donor) atau mNeonGreen (Akseptor) dan ditransfeksi bersama dengan inhibitor dan kontrol yang ditunjukkan dalam sel HEK293T. Sinyal yang diamati untuk DARPin E3_5 yang tidak mengikat menunjukkan sinyal BRET maksimum dan memperhitungkan efek umum transfeksi dan ekspresi DARPin. Sinyal dasar ditentukan oleh interaksi non-spesifik reporter yang ditambatkan dalam membran melalui urutan KRAS4B-HVR.
Kami menggunakan uji BRET 2 yang dimodifikasi , yang sebelumnya divalidasi dalam konteks pengelompokan nano RAS [ [ 70 ] ], untuk menilai dampak pengikat ini. Secara singkat, KRAS menyatu di N-terminal baik dengan nanoLuciferase, yang berfungsi sebagai donor BRET setelah penambahan substratnya Coelenterazine 400a, atau mNeonGreen, yang berfungsi sebagai akseptor BRET ketika kedua protein berada dalam jarak dekat. Kami menunjukkan bahwa baik KRAS4B yang terpotong HVR (1–169) maupun reporter yang menyatu dengan KRAS4B-HVR tidak menghasilkan sinyal BRET 2 yang produktif (Gbr. S5 ). Ini menyoroti bahwa lokalisasi membran seperti KRAS tidak cukup untuk menginduksi gradien konsentrasi lokal seperti klaster sambil menunjukkan bahwa domain G KRAS tidak mampu membentuk nanoklaster tanpa perlekatan membran. Ini mendukung perakitan KRAS4B yang teratur di membran.
Untuk kedua pengikat yang ditargetkan pada RAS, 784_F5 dan NS1, kami mengamati penghambatan yang bergantung pada dosis terhadap pengelompokan nano KRAS pada tingkat yang sama dalam uji BRET 2 (Gbr. 3D ). Karena monobodi NS1 dan DARPin 784_F5 mengenali dua epitop yang berbeda dan tidak tumpang tindih, hasil ini menunjukkan relevansi efektor yang ditargetkan pada DARPin 784_5 dan lobus alosterik, yang dikenali oleh monobodi NS1, untuk pengelompokan nano KRAS.
Khususnya, DARPin 784_F5 juga dapat memediasi efek ini melalui penghambatan pertukaran nukleotida, dengan asumsi bahwa pengelompokan nano KRAS memerlukan aktivasi yang dimediasi SOS sebelumnya. Sayangnya, epitop yang tumpang tindih dari RAF-RBD dan DARPin 784_F5 tidak memungkinkan pemeriksaan jumlah KRAS yang dimuat GTP dalam lingkungan seluler dengan imunopresipitasi RAF-RBD. Akibatnya, kami tidak dapat menyimpulkan apakah oklusi sterik lobus efektor atau pengayaan GDP-KRAS bertanggung jawab atas gangguan pengelompokan nano.
3.5 Ekspresi DARPin anti-RAS intraseluler mempengaruhi proliferasi garis sel yang bergantung pada RAS dalam kultur 2D & 3D
Pada langkah berikutnya, kami menyelidiki apakah DARPin 784_F5 akan memengaruhi pensinyalan hilir RAS dan proliferasi pada lini sel yang bergantung pada RAS [ [ 72 ] ]. Kami berhipotesis bahwa gangguan pada pertukaran nukleotida dan keterlibatan efektor hilir akan menghasilkan penghambatan jalur pensinyalan hilir RAS. Untuk menguji ini, kami secara stabil mentransduksi lini sel yang bergantung pada RAS HCT116 (KRAS G13D), LoVo (KRAS G13D), dan RD (NRAS Q61H) dengan anti-RAS DARPin 784_F5 yang dapat diinduksi doksisiklin atau DARPin E3_5 yang tidak mengikat. Ekspresi DARPin diinduksi dengan doksisiklin selama 24 jam, dan aktivitas dari dua jalur pensinyalan yang dimediasi RAS yang paling relevan, MAPK/ERK dan PI3K/AKT, ditentukan oleh analisis western blot menggunakan antibodi spesifik-fosfo. Ekspresi DARPin E3_5 kontrol tidak menunjukkan efek jika dibandingkan dengan sel yang tidak diinduksi (Gbr. 4A ). Sebaliknya, kadar fosfo-MEK (S217/S221), fosfo-ERK (T202/Y204), dan fosfo-RSK (S380) sangat berkurang di ketiga lini sel 24 jam setelah induksi DARPin 784_F5 jika dibandingkan dengan sel yang tidak diinduksi atau sel yang mengekspresikan DARPin E3_5 kontrol, yang menunjukkan penghambatan jalur MAPK/ERK. Selain itu, pengurangan fosfo-AKT (S473) setelah ekspresi DARPin 784_F5 terbukti di lini sel karsinoma kolon HCT116 dan LoVo, yang menunjukkan bahwa jalur PI3K/AKT juga dapat dirusak oleh DARPin 784_F5. Fosforilasi AKT yang tidak terpengaruh pada garis sel rhabdomyosarcoma RD kemungkinan besar disebabkan oleh keterlibatan jalur hilir RAS yang spesifik terhadap jenis kanker, seperti, misalnya, yang sebelumnya ditunjukkan untuk tumor paru-paru dibandingkan tumor pankreas [ [ 73 ] ].
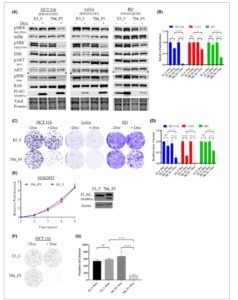
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Penghambatan pensinyalan RAS yang diperantarai DARPin membatasi proliferasi lini sel yang bergantung pada RAS (A) Efek DARPin 784_F5 pada pensinyalan hilir RAS. Lini sel yang bergantung pada RAS yang secara stabil mengekspresikan anti-RAS DARPin 784_F5 atau non-binding DARPin E3_5 dengan cara yang dapat diinduksi doksisiklin dikenakan western blotting 24 jam pasca-induksi ( n = 1). (B) Proliferasi lini sel yang ditunjukkan dengan dan tanpa anti-RAS atau DARPin kontrol selama 4 hari dalam kultur 2D ( n = 3, garis galat menunjukkan SD). (C) Uji pembentukan koloni 2D. Gambar representatif sel yang diwarnai dengan kristal violet setelah 10 hari pertumbuhan. (D) Kuantifikasi dan evaluasi statistik perbedaan dalam pembentukan koloni ( n = 3, garis galat menunjukkan SD). (E) Proliferasi sel HEK293T, yang mengekspresikan DARPin 784_F5 anti-RAS secara stabil atau DARPin E3_5 kontrol seperti yang ditunjukkan oleh western blot ( n = 3, garis galat menunjukkan SD). Pita ganda yang diamati untuk DARPin 784_F5 sesuai dengan fraksi (tidak)terlipat dari DARPin pada gel SDS karena stabilitasnya yang tinggi. (F) Uji agar lunak 3D. Gambar representatif sampel yang diwarnai setelah 10 hari pertumbuhan. (G) Kuantifikasi dan evaluasi statistik perbedaan dalam pertumbuhan yang tidak bergantung pada penjangkaran ( n = 3, garis galat menunjukkan SD). Semua percobaan dilakukan sebagai tiga replikasi biologis. Signifikansi statistik dihitung melalui ANOVA dua arah. Tingkat signifikansi direpresentasikan dalam nomenklatur berikut: * P ≤ 0,05; ** P ≤ 0,01; *** P ≤ 0,001; **** P ≤ 0,0001.
Berdasarkan keberhasilan penurunan regulasi sinyal KRAS melalui jalur hilirnya, dapat diharapkan bahwa anti-RAS DARPin 784_F5 akan berdampak pada proliferasi pada lini sel yang bergantung pada RAS. Seperti yang ditunjukkan pada Gambar 4B–D , proliferasi sel dan pembentukan koloni dalam kultur 2D berkurang secara signifikan setelah ekspresi anti-KRAS DARPin 784_F5 pada semua lini sel yang diuji. Penurunan kecil dalam proliferasi dan pembentukan koloni juga diamati setelah induksi kontrol DARPin E3_5 pada lini sel HCT116 dan LoVo. Dalam kasus ini, doksisiklin dan ekspresi berlebihan yang kuat dari protein yang tidak relevan mungkin telah menyebabkan efek ini.
Untuk memastikan bahwa DARPin 784_F5 tidak memiliki sitotoksisitas umum, efeknya pada sel HEK293T yang tidak memiliki RAS bermutasi diuji. Oleh karena itu, sel HEK293T ditransduksi dengan lentivirus pengkode DARPin, dan proliferasi sel terpilih yang mengekspresikan DARPin 784_F5 anti-RAS atau DARPin E3_5 kontrol dianalisis. Tidak ada perbedaan dalam proliferasi sel yang diamati saat membandingkan DARPin kontrol dan anti-RAS (Gbr. 4E ). Hasil ini menunjukkan bahwa penghambatan RAS yang dimediasi DARPin umumnya tidak beracun bagi sel.
Selain proliferasi sel, kami kemudian menyelidiki apakah ekspresi anti-KRAS DARPin 784_F5 juga memengaruhi pertumbuhan sel kanker yang tidak bergantung pada penjangkaran. Untuk uji 3D ini, kami memilih lini sel HCT116 untuk membandingkannya dengan hasil yang dilaporkan untuk reagen afinitas yang ditargetkan RAS lainnya, seperti DARPin K27 dan K55, serta antibodi domain tunggal iDab6 [ [ 30 , 74 ] ]. Kami menemukan bahwa pertumbuhan yang tidak bergantung pada penjangkaran sangat berkurang setelah ekspresi anti-KRAS DARPin 784_F5 dibandingkan dengan semua kondisi lainnya (Gbr. 4F,G ).
Secara keseluruhan, semua pengujian yang dilakukan mengonfirmasi pengurangan yang kuat dalam proliferasi dan pembentukan koloni sebagai respons terhadap ekspresi DARPin 784_F5 pada garis sel yang diuji, yang mencerminkan potensinya dalam menekan pembentukan tumor.
3.6 Ekspresi anti-RAS DARPin intraseluler memungkinkan pengendalian tumor secara in vivo
Menjelajahi efek anti-RAS DARPin 784_F5 dalam model xenograft adalah langkah selanjutnya yang konsekuen berdasarkan potensinya dalam uji in vitro . Kami menggunakan lini sel HCT116 yang telah terbentuk sebelumnya dan dapat diinduksi yang mengekspresikan DARPin E3_5 yang tidak mengikat atau anti-RAS DARPin 784_F5 setelah terpapar doksisiklin untuk membentuk tumor pada tikus NSG. Yang penting, kami membiarkan pembentukan tumor hingga volume setidaknya 125 mm3 sebelum pengobatan (Gbr. 5A ). Penambahan doksisiklin ke dalam air minum menghasilkan pengurangan beban tumor sebesar 27–66% (rata-rata 50%) dalam minggu pertama pengobatan untuk kelompok yang mengekspresikan DARPin 784_F5, sementara kelompok kontrol menggandakan volume tumor mereka secara rata-rata (Gbr. 5B ). Sejumlah kecil tikus dikorbankan sekitar waktu respons maksimal (hari ke-10 pada doksisiklin) dan diproses untuk karakterisasi histopatologis. Tumor yang mengekspresikan DARPin 784_F5 menunjukkan pleomorfisme nuklir yang berkurang, peningkatan infiltrasi stroma, dan pengurangan proliferasi sebagaimana dinilai oleh histon H3 terfosforilasi (Ser10), jika dibandingkan dengan kontrol DARPin E3_5 (Gbr. 5D–F ).
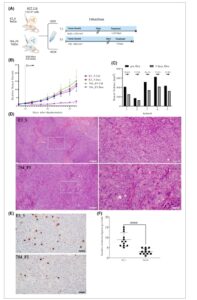
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Pan-RAS DARPin 784_F5 menekan pertumbuhan tumor in vivo . (A) Representasi skematis dari desain penelitian. Tikus dibagi menjadi dua kelompok per lini sel (HCT116 Tet On 784_F5/E3_5) dan salah satunya diberi doksisiklin dengan minum air (2 mg Dox·mL −1 ). Dalam penelitian pertama, tumor yang lebih kecil diikuti hingga 23 hari sementara dalam penelitian kedua, tumor dibiarkan tumbuh lebih besar sebelum dimulainya pengobatan. (B) Pertumbuhan tumor relatif seperti yang diamati dalam penelitian pertama dihitung berdasarkan ukuran tumor pada hari ke-7 pasca-implantasi. Rata-rata ukuran tumor ± simpangan baku pada titik waktu induksi ekspresi DARPin yang dimediasi doksisiklin ditunjukkan sebagai garis putus-putus. Volume tumor individu ditampilkan dalam Gambar. ( C) Volume tumor dari lima hewan individu seperti yang diamati dalam penelitian kedua sebelum dan setelah 5 hari pengobatan doksisiklin. Perubahan relatif dalam volume tumor ditunjukkan. (D) Pewarnaan hematoxylin/eosin representatif dari xenograft HCT116 subkutan yang diperoleh setelah 10 hari menjalani pengobatan doksisiklin selama studi pertama. Sisipan menunjukkan area yang direpresentasikan pada perbesaran yang lebih tinggi (panel kanan). Batang skala: 200 μm. (E) Pewarnaan imun representatif untuk histon H3 terfosforilasi (Ser10) sebagai penanda mitosis dalam penampang xenograft seperti dijelaskan dalam (D). Batang skala: 200 μm. (F) Kuantifikasi figur mitosis positif untuk histon H3 Ser10 terfosforilasi dalam bidang yang dipilih secara acak. Dua xenograft independen per kondisi digunakan ( n = 6 bidang dikuantifikasi per penampang, batang galat menunjukkan SD). Signifikansi statistik dihitung melalui uji- t Student . Tingkat signifikansi direpresentasikan dalam nomenklatur berikut: * P ≤ 0,05; ** P ≤ 0,01; Nilai p <0,001 adalah 0,0001 .
Namun, kami mengamati peningkatan volume tumor yang lambat tetapi stabil pada kelompok yang diobati dengan DARPin 784_F5 setelah minggu pertama, kemungkinan besar disebabkan oleh tekanan selektif yang menyebabkan hilangnya ekspresi DARPin 784_F5 (Gbr. S6b ). Untuk mengonfirmasi regresi tumor yang terlihat dalam studi awal, kami menguji efek DARPin 784_F5 pada tikus yang memiliki tumor yang jauh lebih besar (150–600 mm3 ) dan mengamati pengurangan serupa pada volume tumor dalam waktu 5 hari pengobatan (Gbr. 5C ). Sepengetahuan kami, ini adalah laporan pertama tentang regresi tumor dan/atau kontrol tumor yang lebih besar sebagai respons terhadap ekspresi intraseluler pengikat protein yang diarahkan oleh RAS [ [ 27 , 74 , 75 ] ].
4 Diskusi
Kami mengisolasi DARPin 784_F5 yang tidak membedakan antara isoform atau mutan RAS, seperti yang ditunjukkan oleh resonansi plasmon permukaan (SPR) dan ko-imunopresipitasi (Co-IP). Hebatnya, kami juga tidak dapat menemukan preferensi yang signifikan untuk status RAS-aktif/RAS-nonaktif yang direpresentasikan oleh KRAS yang terikat GDP atau GTPγS. Kemampuan untuk mengenali epitop sakelar I/II yang mirip dengan situs pengikatan efektor hilir RAS, yang ditunjukkan oleh kristalografi sinar-X, agak mengejutkan, mengingat fleksibilitas konformasi wilayah ini. Sementara domain pengikatan RAS alami RAF sangat bergantung pada konformasi RAS-GTP terutama pada wilayah sakelar I, varian rekayasa RAF1-RBD terbukti mengikat secara independen dari ikatan nukleotida [ [ 76 ] ]. Namun, model pengikatan dua langkah yang diperlukan untuk menyesuaikan kinetika pengikatan DARPin 784_F5 dengan KRAS dan antarmuka pengikatan adaptif yang diamati dalam kompleks tersebut sejalan dengan kompatibilitas untuk kedua keadaan nukleotida. Dalam uji biokimia, DARPin dicirikan sebagai penghambat ganda pertukaran nukleotida yang dimediasi SOS dan interaksi RAS dengan RAF1-RBD dengan IC50 masing -masing 34,3 dan 38,4 nm .
Lebih jauh, ketersediaan reagen afinitas yang mengikat epitop yang berbeda pada KRAS memungkinkan kami untuk menyelidiki keterlibatan mereka dalam pengelompokan nano KRAS. Kami memilih pengikat RAS yang tidak tumpang tindih 784_F5 dan NS1 untuk menilai efek pemblokiran lobus alosterik α4/α5 atau lobus efektor switch I/II. Dengan mempertimbangkan epitop yang diblokir, kami dapat memvalidasi apakah kedua antarmuka tersebut penting untuk pembentukan dimer KRAS. Hasil kami menunjukkan bahwa pengikat switch I/II 784_F5 mengganggu pengelompokan nano yang dipantau BRET 2 setidaknya pada tingkat yang sama dengan monobodi NS1 yang ditargetkan α4/α5, yang mendukung relevansi kedua antarmuka untuk pengelompokan nano RAS. Pengamatan ini konsisten dengan temuan baru-baru ini yang menggambarkan keterlibatan lobus alosterik dan efektor dalam pembentukan dimer KRAS dan oligomer tingkat tinggi yang bergantung pada GTP [ [ 70 , 71 ] ]. Secara khusus, Lee dan Lee telah memberikan bukti biokimia untuk interaksi kedua antarmuka dalam konteks nanoclustering dalam pendekatan berbasis NMR, dengan membentuk sistem di mana hingga empat molekul KRAS, yang diberi label pada dua epitop, dapat berdifusi bebas dalam nanodisk [ [ 71 ] ]. Kami yakin bahwa reagen afinitas RAS seperti DARPin yang dijelaskan di sini adalah alat yang berharga dalam memvalidasi epitop yang terlibat dalam nanoclustering RAS karena mereka memungkinkan oklusi yang terdefinisi dengan baik dari epitop spesifik pada RAS. Hal ini memungkinkan para peneliti untuk menjelaskan mekanisme kompleks yang mendorong nanoclustering RAS dan perannya dalam transduksi sinyal, yang pada akhirnya membuka jalan bagi pengembangan strategi terapi baru yang menargetkan kanker yang didorong oleh RAS.
Baru-baru ini, pengembangan inhibitor molekul kecil kovalen untuk KRAS (G12C), yang menargetkan keadaan GDP yang tidak aktif, atau keadaan GTP yang aktif, menyebabkan diskusi apakah satu pilihan memberikan keuntungan signifikan atas yang lain [ [ 77 – 79 ] ]. Penelitian tambahan, berdasarkan inhibitor KRAS (G12D) MRTX 1133 [ [ 13 ] ] dan inhibitor KRAS (G12C) BBO-8520 (NCT06343402) mengeksplorasi konsekuensi dari pengenalan kedua keadaan tersebut. Sementara Guillard et al. [ [ 30 ] ] mengembangkan DARPin yang spesifik untuk masing-masing keadaan tersebut, DARPin 784_F5 adalah satu-satunya pengikat yang tidak bergantung nukleotida yang mengenali lobus efektor RAS yang secara fungsional dikarakterisasi dalam sel [ [ 22 ] ]. Selain itu, laporan pada dua reagen afinitas RAS lain yang berkarakterisasi dengan baik, iDab6 spesifik GTP-RAS dan monobodi NS1 alosterik, memberikan hasil dari model xenograft [ [ 74 , 75 ] ]. Dalam studi kasus ini, reagen afinitas RAS hanya dapat menunda atau mengendalikan perkembangan tumor tetapi tidak menyebabkan regresi tumor, seperti yang diamati untuk DARPin 784_F5. Khususnya, scFv iDab6, dalam versi yang ditingkatkan dan ditargetkan pada membran, diuji dalam model HCT116 yang sama. Apakah efek ini memang ditentukan oleh spesifisitas untuk RAS yang terikat GDP dan terikat GTP dan dengan demikian oleh mekanisme penghambatan yang tepat yang dijelaskan di sini, atau dihasilkan dari tingkat ekspresi yang berbeda secara individual, masih harus dibuktikan. Secara bersamaan, anti-RAS DARPin 784_F5 yang dijelaskan di sini melengkapi serangkaian pengikat RAS yang berasal dari protein scaffold yang sama [ 32 ] , mengenali epitop yang sangat mirip dengan afinitas yang sebanding, tetapi mengenali RAS baik dalam status GDP (K27), status GTP (K55) atau keduanya (784_F5). Ini mungkin memberikan peluang unik untuk menyelidiki konsekuensi dari penghambatan (pan)-RAS berdasarkan keterlibatan target yang bergantung pada status. Lebih jauh lagi, kemajuan terkini dalam teknologi nanopartikel lipid (LNP) dapat memberikan harapan untuk pengiriman biologik yang ditargetkan pada RAS secara in vivo , seperti yang ditunjukkan oleh lab Andrew Tsourkas [ [ 80 ] ]. Secara khusus, pengiriman pan-RAS OFF DARPin K27 yang diformulasikan dalam LNP menghasilkan pengurangan beban tumor dalam model karsinoma hepatoseluler mutan NRAS.
5 Kesimpulan
Dengan studi ini, kami menambahkan pan-RAS, nukleotida-independen, DARPin 784_F5 yang menargetkan switch I/II ke koleksi biologik anti-RAS. Hal ini memungkinkan kami untuk menghubungkan mekanisme penghambatan RAS dan konsekuensinya pada pensinyalan hilir RAS, proliferasi, dan pertumbuhan in vivo dari lini sel yang bergantung pada RAS. Pustaka senyawa alat makromolekul yang berkembang memungkinkan kami untuk mengidentifikasi dan memvalidasi konsep penting dari kerentanan terkait RAS dengan melewati batasan generasi molekul kecil. Pengikatan nukleotida-independen 784_F5 ke RAS berkontribusi pada diskusi yang sedang berlangsung tentang keadaan konformasi RAS yang paling bermanfaat untuk ditargetkan untuk intervensi terapeutik. Data kami menunjukkan bahwa menghambat keadaan aktif dan tidak aktif RAS dapat menyebabkan efek anti-tumor yang kuat. Namun, studi lebih lanjut diperlukan untuk menjelaskan tingkat penghambatan RAS mana yang dapat memberikan jendela terapeutik yang wajar. Secara keseluruhan, temuan kami menyoroti pentingnya memahami kompleksitas biologi RAS dalam pencarian pengobatan kanker yang efektif.