Abstrak
Imunoterapi kombinasi telah memasuki persenjataan pengobatan onkologi, tetapi masih terdapat kesenjangan pengetahuan yang penting dalam pemahaman kita tentang cara kerja terapi ini. Sebuah studi baru-baru ini oleh Rolig, Peng, dan rekan-rekannya telah memberikan pandangan baru tentang bagaimana blokade ganda PD1 dan LAG3 meningkatkan imunitas antitumor. Para penulis pertama-tama menginterogasi ekspresi LAG3 pada sel-T di seluruh model tumor murine, mengklasifikasikan model-model tersebut sebagai LAG3 hi atau LAG3 lo . Selanjutnya, mereka menemukan bahwa model LAG3 hi tidak responsif terhadap anti-PD1 saja tetapi responsif terhadap terapi kombinasi dengan anti-PD1 + anti-LAG3. Yang mengejutkan, respons terhadap anti-PD1 + anti-LAG3 dalam model LAG3 hi dikaitkan dengan pemrograman ulang sel-T regulatori CD4 + (Treg) dari keadaan imunosupresif kanonik ke keadaan inflamasi yang ditandai dengan hilangnya ekspresi faktor transkripsi Foxp3 dan peningkatan regulasi faktor transkripsi Tbet. Yang penting, status Treg yang diprogram ulang secara analog dikaitkan dengan respons terhadap anti-PD1 + anti-LAG3 dan kelangsungan hidup keseluruhan yang lebih lama pada pasien dengan melanoma metastatik. Karya ini menyoroti pentingnya sel di luar sel T CD8 + sitotoksik sebagai pendorong respons terhadap imunoterapi dan menyiapkan landasan untuk studi mekanistik dan translasi berikutnya.
Singkatan
Saya
imunoterapi
Treg
Sel T regulator CD4 +
PBMC
sel mononuklear darah tepi
Imunoterapi (IO) sekarang secara rutin digunakan untuk pengobatan banyak tumor padat, tetapi tidak semua pasien memperoleh manfaat terapeutik jangka panjang. Dengan demikian, terapi kombinasi sekarang ditargetkan untuk meningkatkan tingkat respons [ [ 1 , 2 ] ]. Dua rejimen yang disetujui Badan Pengawas Obat dan Makanan yang menargetkan jalur penghambatan adalah anti-PD1/anti-CTLA4 atau anti-PD1/anti-LAG3; rejimen lain dan strategi dosis alternatif sedang diupayakan secara aktif dalam berbagai tahap uji klinis. Namun, meskipun minat yang kuat dan kemanjuran klinis imunoterapi kombinasi, masih banyak yang harus dijelaskan mengenai mekanisme biologis yang terkait dengan manfaat klinis pada pasien. Memahami mekanisme yang terlibat dalam respons dan resistensi akan memberikan dua manfaat: (a) wawasan tentang biologi mendasar dari penekanan fungsi imun yang dimediasi reseptor penghambat dan (b) desain rasional dari strategi terapi kombinasi yang optimal. Pada akhirnya, pemahaman yang lebih baik tentang mekanisme yang mengatur respons IO akan memungkinkan pengembangan strategi imunoterapi yang lebih mujarab.
Rolig, Peng, dan koleganya baru-baru ini menambahkan literatur yang berkembang tentang mekanisme yang terkait dengan respons IO setelah terapi kombinasi dengan anti-PD1 dan anti-LAG3 [ [ 3 ] ]. Pekerjaan ini membangun pengamatan mereka sebelumnya bahwa respons terhadap monoterapi anti-PD1 dapat digambarkan oleh dua imunotipe darah tepi pada pasien dengan kanker urotelial atau melanoma metastasis: LAG3 hi dan LAG3 lo , dengan yang terakhir responsif terhadap monoterapi anti-PD1 dan yang pertama resisten [ [ 4 ] ]. Untuk menjelaskan mekanisme yang terkait dengan imunotipe ini, penulis mengevaluasi 10 model tumor di dua galur tikus yang berbeda untuk merangkum imunotipe manusia yang diamati sebelumnya. Dari penelitian ini, tikus yang memiliki tumor CT26 dan B16F10 menyerupai imunotipe LAG3 hi dan yang memiliki MCA-205 menyerupai imunotipe LAG3 lo . Pengamatan utama muncul dengan penipisan sel T CD8 + atau CD4 + bersamaan dengan terapi anti-PD1+ anti-LAG3; seperti yang diharapkan, penipisan sel T CD8 + menghilangkan efek IO, tetapi yang mengejutkan, penipisan sel T CD4 + meningkatkan kelangsungan hidup pada model tikus CT26. Pengamatan ini menunjukkan bahwa sel T CD4 + memainkan peran yang merugikan dalam konteks imunotipe LAG3 hi dan memerlukan pembedahan lebih lanjut.
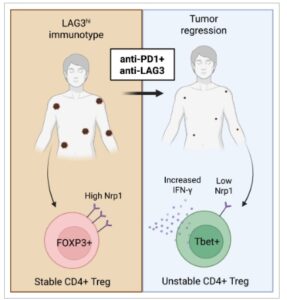
Penentuan bagaimana sel T CD4 + berkontribusi pada resistensi IO selanjutnya dibedah melalui interogasi model murine dan spesimen pasien. Melalui eksperimen RNAseq sel tunggal dan flow cytometry berdimensi tinggi, responden terhadap terapi kombinasi mengandung populasi sel T regulator CD4 + (Treg) yang meningkatkan sitokin efektor IFN-y dan faktor transkripsi terkait sel T pembantu tipe 1 Tbet dengan penurunan regulasi Nrp1 (penggerak utama stabilitas Treg [ [ 5 , 6 ] ]; Gambar 1 ). Dari data ini, penulis berhipotesis bahwa Treg mungkin mengalami konversi dari Treg yang stabil dan supresif menjadi Treg yang rapuh atau bekas. Keadaan Treg ini telah dideskripsikan di beberapa sistem, dengan Treg yang stabil menjadi populasi imunosupresif kanonik, Treg yang rapuh mempertahankan ekspresi Foxp3 tetapi mendapatkan sekresi IFN-γ [ [ 7 ] ], dan Treg yang tidak stabil atau ex-Treg telah kehilangan ekspresi Foxp3 sepenuhnya dan mengadopsi keadaan yang mirip dengan sel T pembantu konvensional [ [ 8 ] ]. Eksperimen tambahan diperlukan untuk mengidentifikasi keadaan Treg pada responden terhadap kombinasi IO.
Gbr. 1
Buka di penampil gambar
Kekuatan Gambar
Terapi anti-PD1 + anti-LAG3 mengubah sel-sel T regulator CD4 + yang stabil (Treg) menjadi Treg yang tidak stabil pada model murine dan pasien dengan imunotipe LAG3 hi . Beberapa modul tumor murine dan sebagian pasien dapat diklasifikasikan sebagai memiliki imunotipe LAG3 hi . Treg secara kanonik merupakan populasi imunosupresif yang mengekspresikan kadar tinggi faktor transkripsi FOXP3 dan kadar tinggi Nrp1 pada permukaan sel. Namun, setelah imunoterapi kombinasi dengan anti-PD1 + anti-LAG3 pada kedua model murine dan pasien dengan melanoma metastasis, Treg diprogram ulang ke keadaan inflamasi yang ditandai dengan ekspresi rendah FOXP3 dan Nrp1 dan ekspresi tinggi faktor transkripsi Tbet, yang disebut Treg ‘tidak stabil’. Treg yang tidak stabil ini dikaitkan dengan peningkatan kekebalan antitumor dan peningkatan kelangsungan hidup secara keseluruhan pada pasien melanoma.
Untuk menjawab pertanyaan ini, penulis menggunakan eksperimen penelusuran garis keturunan genetik, di mana ekspresi Foxp3 dilaporkan oleh GFP dan secara simultan menginduksi ekspresi permanen YFP. Eksperimen ini mengungkapkan bahwa subpopulasi Treg kehilangan ekspresi Foxp3 (yaitu, YFP+ GFP–) pada tikus yang merespons kombinasi IO. Pekerjaan sebelumnya telah mengidentifikasi populasi Treg rapuh yang mengekspresikan Foxp3 yang bertanggung jawab atas respons IO [ [ 7 ] ]; pekerjaan ini menunjukkan bahwa blokade simultan LAG3 dan PD1 mengganggu ekspresi Foxp3 dan menyebabkan ex-Treg. Akhirnya, penulis melakukan flow cytometry berdimensi tinggi dalam sel mononuklear darah tepi (PBMC) dari kelompok besar pasien melanoma metastasis yang menerima anti-PD1 + anti-LAG3. Seperti model tikus, pasien yang merespons terapi kombinasi memiliki subpopulasi Treg dengan MFI FOXP3 yang lebih rendah dan peningkatan regulasi Tbet. Secara keseluruhan, penulis menemukan populasi Treg yang diprogram ulang yang tampaknya bersifat inflamasi daripada imunosupresif yang terkait dengan respons terhadap kombinasi IO dengan anti-PD1 + anti-LAG3 pada tikus dan pasien.
Temuan dari studi ini mendorong beberapa set pertanyaan baru. Pertama, penting untuk menilai sejauh mana Treg manusia dalam lingkungan mikro tumor mencerminkan fenotipe Treg murine yang menyusup ke tumor. Kedua, peringatan potensial adalah penggunaan inokulasi tumor subkutan pada model murine, yang dikaitkan dengan perbedaan dalam imunitas antitumor versus tumor ortotopik [ [ 9 – 11 ] ]. Ketiga, temuan ini dibangun di atas studi sebelumnya dalam PBMC dan menunjukkan bahwa kompartemen ini memainkan peran penting dalam menentukan respons IO pada sebagian kecil pasien. Seperti yang disarankan oleh penulis, studi prospektif di masa depan harus menjelaskan apakah ada biomarker PBMC sebelum IO yang prediktif terhadap resistensi awal terhadap monoterapi anti-PD1 dan menunjukkan manfaat klinis khususnya untuk terapi kombinasi anti-PD1 + anti-LAG3 (yaitu, imunotipe LAG3 hi ). Prioritas ini berpotensi menyelamatkan pasien dari pengobatan dengan IO yang berpotensi tidak efektif dan akan memberikan justifikasi untuk terapi kombinasi dan peningkatan risiko efek samping terkait imun yang menyertainya. Akhirnya, akan menarik untuk menentukan apakah imunotipe LAG3 hi ini mencerminkan pasien yang akan merespons anti-PD1 + anti-LAG3 pada kanker di luar melanoma metastasis. Identifikasi populasi pasien di awal perjalanan penyakit yang akan mendapat manfaat dari IO kombinasi juga akan berdampak secara klinis. Secara keseluruhan, Rolig, Peng, dan rekan-rekannya telah menunjukkan peran penting bagi populasi di luar sel T CD8 + dalam respons terhadap IO kombinasi, yang akan membantu menginformasikan strategi IO kombinasi di masa mendatang.